Регистрируются патологические значения параметра начало турбулентности
Регистрируются патологические значения параметра начало турбулентности
Новости
Турбулентность ритма сердца – новый метод стратификации риска внезапной сердечной смерти
В.Н. Комолятова, Л.М. Макаров
Центр синкопальных и сердечных аритмий у детей и подростков Федерального Медико – Биологического Агентства на базе ФГУЗ ДКБ №38 – ЦЭП ФМБА России. Кафедра клинической физиологии и функциональной диагностики ИПК ФМБА России.
Согласно современным представлениям ТРС — это физиологическая, двухфазная реакция синусового узла на преждевременное желудочковое сокращение. Механизм ТРС заключается в барорефлекторном ответе ритма и АД на преждевременный желудочковый комплекс. В ответ на экстрасистолу происходит кратковременное изменение артериального давления в виде его снижения, а затем увеличение с соответствующими компенсаторными изменениями ЧСС, которые и тестируются при анализе ТРС. Если автономный контроль ритма сердца в норме, эти изменения регистрируются немедленно с мгновенным ответом в виде ТРС. При нарушенном автономном контроле эта реакция ослаблена или полностью отсутствует, что подтверждается результатами ряда целенаправленных исследований. Большинство исследований, проведенных в этой области, сосредоточены на определении прогностических показателей ТРС у взрослых пациентов, в основном с ишемиче ской болезнью сердца. Полученные результаты предполагают перспективность использования данных методов в педиатрии. Однако это возможно только при знании нормативных половозрастных лимитов новых маркеров ЭНМ, их адекватной физиологической и клинической интерпретации. Вышеизложенное послужило основанием для проведения настоящего исследования, определило его цель. Целью настоящего исследования явилось определение нормативных параметров ТРС у детей с идиопатическими аритмиями.
Пациенты и методы исследования
На основании существующих рекомендаций, использовались следующие ограничения для включения желудочковых экстрасистол в анализ ТРС: наличие не менее 20 синусовых интервалов RR перед и после желудочковой экстрасистолы. Исключались из анализа экстрасистолы, если им предшествовала выраженная тахи — или брадикардия с интервалами RR менее 300 мс или более 2000 мс. Минимальный индекс преждевременности экстрасистолического комплекса составлял 20% и постэкстрасистолическая пауза была длиннее по крайне мере на 20% нормального RR и интервала (критерий исключения вставочных ЖЭС).
Результаты и обсуждение
У 20 (91%) из 22 пациентов с патологическими значениями ТО отмечено неблагоприятное течение заболевания (синкопе, толерантность к антиаритмической терапии, аритмогенная дилятация полостей, летальный исход заболевания). Чувствительность выявления патологических значений ТО для определения плохого прогноза заболевания и/или аритмогенных осложнений у детей составила 54%, специфичность — 97%.
1. Турбулентность ритма сердца является новым высокоспецифичным критерием прогноза желудочковых тахиаритмий, доступным для использования в широкой клинической практике и характеризуется двумя независимыми показателями: «начала» турбулентности — ТО (норма TS (норма > 2,5 у пациентов старшего возраста и > 6 у молодых пациентов);
2. В анализе изменения турбулентности ритма сердца необходимо интерпретировать с учетом патофизиологических механизмов
3. Большая плотность желудочковой экстрасистолии (более 20% за сутки) ассоциирована с редукцией ранней фазы турбулентности ритма сердца (значение показателя «начала» турбулентности — ТО более 0%), которая является высокоспецифичным ( Sp — 94%) и чувствительным ( Se — 54%) маркером неблагоприятного течения желудочковых тахиаритмий у детей.
Журнал «Функциональная дигностика» №3, 2010 год
Турбулентность сердечного ритма в оценке риска внезапной сердечной смерти
Метод электрокардиографии (ЭКГ) на сегодняшний день остается самым простым и доступным способом анализа электрической деятельности сердца. Использование ЭКГ в таких исследованиях как нагрузочные пробы, холтеровское мониторирование (ХМ), электрофизиологическое исследование, значительно расширило возможности ставшей уже рутинной методики. На ее основе базируются способы диагностики, в которых количественные критерии позволяют выявить закономерности, невидимые при обычном анализе ЭКГ.
Было замечено, что за желудочковой экстрасистолой (ЖЭ) следуют короткие колебания продолжительности синусового цикла (RR интервалов). Этот феномен впервые был описан исследовательской группой под руководством G.Schmidt [1] в 1999 году, в дальнейшем он и послужил основой понятия «турбулентность сердечного ритма» (ТСР). Итак, термин ТСР применяется для описания краткосрочных колебаний в продолжительности синусового цикла, которые следуют после ЖЭ. Обычно сразу после ЖЭ синусовый ритм учащается и затем вновь замедляется, приходя к исходным значениям (рис. 1).
Кроме того, к оценке ТСР допускаются те записи ЭКГ, в которых имеются ЖЭ с индексом преждевременности >20% и постэкстрасистолическим интервалом, который длиннее среднего RR на 20% и более. Феномен ТСР наблюдается не только после эктопических эпизодов, он также может быть индуцирован (т.н. «индуцированная» ТСР) внутрисердечной стимуляцией в условиях электрофизиологической лаборатории [4, 5, 6, 7, 8] или у пациентов с имплантированным электрокардиостимулятором (ЭКС) или кардиовертером-дефибриллятором (ИКД) [9].
МЕХАНИЗМЫ ФОРМИРОВАНИЯ ТСР
Попытка объяснить механизм ТСР и двух основных её параметров сводится к следующему [10]:
Феномен TO связан с тем, что многочисленные ионные каналы кардиомиоцитов к моменту преждевременного эктопического сокращения еще не полностью восстановлены, что приводит к укорочению потенциала действия (ПД). Преждевременное сокращение связано с неполным диастолическим наполнением камер сердца, вследствие чего снижается ударный объем и уменьшается сократимость (механизм Франка-Старлинга). Это, в свою очередь, снижает уровень АД, приводя к активизации аортальных и каротидных барорецепторов и через барорефлекторную дугу к увеличению частоты сердечных сокращений (ЧСС). Десинхронизация сокращений желудочков при ЖЭ также имеет определенное значение.
Феномен TS можно объяснить так: с момента компенсаторной паузы медленные ионные каналы кардиомиоцитов полностью восстанавливаются, что ведет к удлинению ПД, увеличению ударного объема, повышению АД (феномен постэкстрасистолического потенцирования), а увеличенное АД через барорефлекс снижает ЧСС. Таким образом, формирование ТСР схематично можно представить следующей последовательностью: ЖЭ вызывает компенсаторную паузу вследствие чего снижается АД, что через барорефлекс вызывает рост ЧСС и увеличение АД, которое (через барорефлекс) приводит к снижению ЧСС.
В работе A.Voss с соавт. показана сопоставимость записей ЭКГ и АД у здоровых субъектов [11]. Из анализа ЭКГ в этих исследованиях следует, что вслед за ЖЭ наблюдается укорочение RR интервалов, а затем их удлинение. При этом вызванные ЖЭ изменения АД схожи с ТСР, определенной по RR интервалам. После компенсаторной паузы, как систолическое, так и диастолическое АД повышается ко 2-му удару, а затем медленно снижается, возвращаясь к исходным значениям. Если такое поведение АД типично для нормального ответа, то ТСР полностью отражает турбулентность АД.
В отличие от описанного в общих чертах механизма, некоторые аспекты ТСР остаются невыясненными. Большинство вопросов касаются симпатовагального баланса. Так, остается спорным ответ на вопрос, что происходит при учащении синусового ритма, определяемого ТО: уходят вагусные влияния или активизируется симпатические? И в каком соотношении находятся эти системы при замедлении синусового ритма, определяемого показателем TS?
Ответы на эти вопросы крайне важны, т.к. они могут стать путем к пониманию ТСР, как предиктора сердечной смерти и, следовательно, её профилактики. В некоторых исследованиях получены косвенные доказательства преобладания вагусных влияний на ТСР, одним из которых является факт устранения феномена ТСР атропином [7, 12], в то время как введение эсмолола не влияло на показатели ТСР [13]. Возможно, это объясняет сохранение прогностической значимости данного показателя у пациентов, получающих b-адреноблокаторы [14], хотя до сих пор существуют противоречивые данные об их влиянии на ТСР.
Математическая модель показала, что b-адреноблокаторы снижают значения TS, хотя не влияют на TO [15]. Однако до того как делать какие-либо заключения, необходимо учитывать т.н. феномен акцентуированного антагонизма. Симпатический и парасимпатический эффекты не просто дополняют друг друга: один компонент не может существовать без другого, при уменьшении тонуса одного, снижается активность другого. К примеру, вагусные эффекты сильнее выражены при активизации симпатического тонуса, чем при его снижении. Следовательно, вклад активности симпатической нервной системы в явлении ТСР у здоровых лиц не может быть точно определен на основании исследований с использованием атропина и b-адреноблокаторов. Тот факт, что значения TS и TO являются независимыми факторами риска сердечной смерти, также говорит о том, что ТСР не может быть объяснена только вагусными влияниями.
Для изучения ТСР, как предиктора остановки сердца были использованы данные исследования Autonomic Tone and Reflexes after Myocardial Infarction (ATRAMI) [19]. В него включались пациенты, перенесшие ИМ, с меньшим риском сердечной смерти в сравнении с EMIAT, где участвовали пациенты с ФВ 80 уд/мин) [6, 36, 37]. Анализ «индуцированной» ТСР у 28 пациентов с суправентрикулярной тахикардией (СВТ) и ЖТ, показали сильную корреляцию между значением TS и ЧСС (p 40% (r=-0,61, 0,68 соответственно, p
Регистрируются патологические значения параметра начало турбулентности
К началу XXI века распространенность артериальной гипертонии (АГ) в нашей стране приобрела характер эпидемии. Артериальное давление (АД) повышено у 40 % взрослого населения Российской Федерации [4, 5]. АГ является одним из главных модифицируемых факторов риска сердечных и церебральных «катастроф» [8] и одной из ведущих причин смертности и инвалидизации населения.
В настоящее время прилагается много усилий для диагностики и лечения АГ. Это вполне обоснованно, так как АГ страдает в основном трудоспособное население. Существенно меньшее внимание уделяется лицам с высоким нормальным артериальным давлением (ВНАД) – состоянием, когда систолическое АД (САД) находится в пределах 130–139 мм рт.ст. и/или диастолическое АД (ДАД) в пределах 85–89 мм рт.ст. Являясь формально нормальным АД, ВНАД ассоциируется с семикратным повышением риска развития сердечно-сосудистых осложнений по сравнению с таковым при оптимальном АД [9]. Пациенты с ВНАД тем не менее представляют собой неоднородную в прогностическом отношении группу, из которой происходит пополнение рядов больных АГ. Поэтому важным в практическом отношении является вопрос выявления предикторов трансформации ВНАД в АГ. Выделив такие предикторы, мы могли бы a priori отнести пациента с ВНАД к группе высокого или низкого риска развития АГ и, в частности, определить, показана или не показана данному пациенту превентивная фармакотерапия.
Материал и методы исследования
Данная работа является фрагментом продольного проспективного обсервационного исследования спонтанной трансформации ВНАД в АГ. В исследование включено 122 человека, у которых было констатировано ВНАД. Констатацию производили, если во время двух визитов с интервалом 7–10 дней при офисном измерении АД были получены результаты (САД 130–139 и ДАД ≤ 89) или (САД ≤ 139 и ДАД 85–89) мм рт.ст. Средний возраст обследуемых составлял 43,8 ± 4,7 лет, 62 мужчины и 60 женщин. Все включенные лица вели обычный образ жизни, не были субъективно мотивированы на какое-либо медикаментозное лечение, у пациентов отсутствовали ассоциированные клинические состояния, требующие обязательного проведения фармакотерапии.
После получения информированного согласия пациента на включение в исследование на начальном этапе каждому обследуемому было проведено холтеровское мониторирование электрокардиограммы (ХМ ЭКГ) в течение 24 часов с использованием системы МЭКГ-НС-02 («ДМС Передовые Технологии», Москва), в ходе которого определяли, в частности, суточное количество желудочковых (ЖЭС) и суправентрикулярных (СВЭС) экстрасистол. При наличии ЖЭС фиксировали рассчитанные системой средние показатели турбулентности сердечного ритма (ТСР), а именно начало (ТО) и наклон (TS) турбулентности [7].
На конечном этапе, спустя 5 лет, у каждого обследуемого оценивали уровень АД. Для этого в течение двух визитов с интервалом 7–10 дней проводили офисное измерение АД, на основании которого констатировали два варианта эволюции состояния пациента:
1) сохранение уровня АД, соответствующего высокому нормальному – при цифрах САД и ДАД, удовлетворяющих вышеприведенному условию;
2) развитие АГ – при САД ≥ 140 мм рт.ст. и/или ДАД ≥ 90 мм рт.ст. Учитывая значительную продолжительность периода наблюдения, из исследования по разным причинам выбыли 22 человека. Таким образом, в статистический анализ были включены 100 человек (средний возраст на начало проекта 43,1 ± 4,6 лет, 52 женщины). Статистическую обработку (расчет точного критерия Фишера) проводили с использованием пакета Statistica 8.0 (StatSoft, США).
Результаты исследования и их обсуждение
В результате исследования были получены следующие результаты. Из 100 человек с ВНАД через 5 лет наблюдения у 80 была констатирована АГ (у 67 пациентов 1-й степени, у 13 – 2-й степени), у 20 – уровень АД по-прежнему соответствовал высокому нормальному. Таким образом, включенные в исследование ретроспективно были разделены на две группы: I (n = 80, с развившейся впоследствии АГ) и II (n = 20, с неразвившейся АГ).
Предикторами трансформации ВНАД в АГ можно считать такие признаки, которые при априорном исследовании в I группе выявляются достоверно чаще, чем во II. Задача усложняется в связи с тем, что некоторые из изучаемых нами признаков (суточное количество ЖЭС и СВЭС) имеют количественное измерение, то есть, иными словами, являются градуированными. При этом для каждой градации признака частота встречаемости в группах в общем может различаться. В связи с данным фактом поставленная задача распадается на две подзадачи:
1) определить, можно ли с помощью данного признака прогнозировать трансформацию ВНАД в АГ, иными словами, является ли признак предиктором этой трансформации;
2) какую величину количественного признака следует считать оптимальным граничным значением, то есть при какой величине признака различие между частотой встречаемости признака в I и II группах имеет наибольшую статистическую значимость, а чувствительность и специфичность – максимальные значения.
Первая подзадача решается просто: сопоставляется частота встречаемости признака в I и II группах (νI и νII), при наличии статистически значимых различий в частоте делается вывод о том, что данный признак может быть предиктором трансформации ВНАД в АГ. При этом если νI > νII, мы говорим о положительной прогностической значимости признака, а если νI 0,05
Примечания: есть – количество лиц данной группы с количеством ЖЭС за сутки не ниже приведенного граничного значения (т.е. условие выполняется). Нет – количество лиц данной группы с количеством ЖЭС за сутки ниже приведенного граничного значения (т.е. условие не выполняется). Чувствительность в данном случае отражает способность теста прогнозировать трансформацию ВНАД в АГ и равна отношению количества лиц с развившейся АГ и выполненным условием (для каждого граничного значения) к количеству лиц с развившейся АГ (80). Специфичность в данном случае отражает способность теста прогнозировать отсутствие трансформации ВНАД в АГ и равна отношению количества лиц с неразвившейся АГ и невыполненным условием (для каждого граничного значения) к количеству лиц с неразвившейся АГ (20). ПЦПР – прогностическая ценность положительного результата, ПЦОР – прогностическая ценность отрицательного результата. ОППР – отношение правдоподобия положительного результата, ОПОР – отношение правдоподобия отрицательного результата. р отражает достоверность (точный критерий Фишера – ТКФ, двусторонний вариант) различий (для каждого граничного значения) между долями лиц с выполненным условием в группе с трансформацией ВНАД в АГ (νI) и группе с неразвившейся АГ (νII).
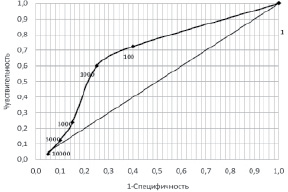
Рис. 1. ROC-кривая для количества желудочковых ЭС за сутки (по данным ХМ ЭКГ). Точки на кривой – граничные значения количества ЖЭС
При изучении суправентрикулярной эктопической активности были получены следующие данные. В I группе у 13 человек было зарегистрировано менее 100 СВЭС в сутки, у 35 человек – от 100 до 999, у 25 – от 1000 до 2999, у 4 – от 3000 до 4999, у 3 – от 5000 до 9999. Во II группе у 4 человек было зарегистрировано менее 100 СВЭС в сутки, у 7 человек – от 100 до 999, у 7 – от 1000 до 2999, у 1 – от 3000 до 4999, у 1 – от 5000 до 9999. Десять тысяч и более СВЭС за сутки ни у кого из испытуемых зарегистрировано не было. Для оценки возможности прогнозирования трансформации ВНАД в АГ при помощи признака «суправентрикулярная эктопическая активность с количеством СВЭС ≥ Х за сутки» и определения оптимального значения Х был проведен анализ, результаты которого представлены в табл. 2 и на рис. 2.
Распределение пациентов из групп АГ и ВНАД по количеству суправентрикулярных ЭС за сутки (данные ХМ ЭКГ)
Регистрируются патологические значения параметра начало турбулентности
Новости
Турбулентность ритма сердца – новый метод стратификации риска внезапной сердечной смерти
В.Н. Комолятова, Л.М. Макаров
Центр синкопальных и сердечных аритмий у детей и подростков Федерального Медико – Биологического Агентства на базе ФГУЗ ДКБ №38 – ЦЭП ФМБА России. Кафедра клинической физиологии и функциональной диагностики ИПК ФМБА России.
Согласно современным представлениям ТРС — это физиологическая, двухфазная реакция синусового узла на преждевременное желудочковое сокращение. Механизм ТРС заключается в барорефлекторном ответе ритма и АД на преждевременный желудочковый комплекс. В ответ на экстрасистолу происходит кратковременное изменение артериального давления в виде его снижения, а затем увеличение с соответствующими компенсаторными изменениями ЧСС, которые и тестируются при анализе ТРС. Если автономный контроль ритма сердца в норме, эти изменения регистрируются немедленно с мгновенным ответом в виде ТРС. При нарушенном автономном контроле эта реакция ослаблена или полностью отсутствует, что подтверждается результатами ряда целенаправленных исследований. Большинство исследований, проведенных в этой области, сосредоточены на определении прогностических показателей ТРС у взрослых пациентов, в основном с ишемиче ской болезнью сердца. Полученные результаты предполагают перспективность использования данных методов в педиатрии. Однако это возможно только при знании нормативных половозрастных лимитов новых маркеров ЭНМ, их адекватной физиологической и клинической интерпретации. Вышеизложенное послужило основанием для проведения настоящего исследования, определило его цель. Целью настоящего исследования явилось определение нормативных параметров ТРС у детей с идиопатическими аритмиями.
Пациенты и методы исследования
На основании существующих рекомендаций, использовались следующие ограничения для включения желудочковых экстрасистол в анализ ТРС: наличие не менее 20 синусовых интервалов RR перед и после желудочковой экстрасистолы. Исключались из анализа экстрасистолы, если им предшествовала выраженная тахи — или брадикардия с интервалами RR менее 300 мс или более 2000 мс. Минимальный индекс преждевременности экстрасистолического комплекса составлял 20% и постэкстрасистолическая пауза была длиннее по крайне мере на 20% нормального RR и интервала (критерий исключения вставочных ЖЭС).
Результаты и обсуждение
У 20 (91%) из 22 пациентов с патологическими значениями ТО отмечено неблагоприятное течение заболевания (синкопе, толерантность к антиаритмической терапии, аритмогенная дилятация полостей, летальный исход заболевания). Чувствительность выявления патологических значений ТО для определения плохого прогноза заболевания и/или аритмогенных осложнений у детей составила 54%, специфичность — 97%.
1. Турбулентность ритма сердца является новым высокоспецифичным критерием прогноза желудочковых тахиаритмий, доступным для использования в широкой клинической практике и характеризуется двумя независимыми показателями: «начала» турбулентности — ТО (норма TS (норма > 2,5 у пациентов старшего возраста и > 6 у молодых пациентов);
2. В анализе изменения турбулентности ритма сердца необходимо интерпретировать с учетом патофизиологических механизмов
3. Большая плотность желудочковой экстрасистолии (более 20% за сутки) ассоциирована с редукцией ранней фазы турбулентности ритма сердца (значение показателя «начала» турбулентности — ТО более 0%), которая является высокоспецифичным ( Sp — 94%) и чувствительным ( Se — 54%) маркером неблагоприятного течения желудочковых тахиаритмий у детей.
Журнал «Функциональная дигностика» №3, 2010 год
Регистрируются патологические значения параметра начало турбулентности

Поиск
Турбулентность ритма сердца как предиктор сердечно-сосудистой смерти
Турбулентность ритма сердца (ТСР) — барорефлекторно опосредованные краткосрочные колебания частоты сердечных сокращений (ЧСС) после спонтанных желудочковых экстрасистол, ускорение ЧСС с последующим постепенным замедлением. У пациентов группы высокого риска после перенесенного инфаркта миокарда (ИМ) ТСР менее выражена или вообще отсутствует. В обзоре рассматриваются эффективность и перспективы оценки ТСР как предиктора риска смерти после инфаркта миокарда.
Heart rate turbulence as a risk-predictor of cardiovascular death
Heart rate turbulence (HRT) — baroreflex-mediated short-term fluctuations in heart rate (HR) after a spontaneous ventricular extrasystoles, acceleration of heart rate with followed gradual slowing. In high-risk patients after myocardial infarction (MI) TCP is less pronounced or absent. The review examined the effectiveness and prospects for evaluation of TCP as a predictor of risk of death after myocardial infarction.
Несмотря на значительные достижения в области интервенционной и лекарственной терапии, смертность в долгосрочном периоде после инфаркта миокарда (ИМ) остается по-прежнему высокой. Значительное число этих смертей имеют внезапный характер и их можно предотвратить с помощью имплантируемых кардиовертер-дефибрилляторов (ИКВД). Рандомизированные многоцентровые исследования показали, что их имплантация у пациентов с высоким риском смерти в постинфарктном периоде может уменьшить смертность на 20-54% [1]. Современные рекомендации предлагают проводить имплантацию ИКВД у пациентов с низкой фракцией выброса левого желудочка (ФВ ЛЖ 30-35%), которая является золотым стандартом для прогнозирования риска внезапной смерти [2]. Однако клинические исследования показали, что такой маркер как снижение ФВ ЛЖ не является в достаточной степени чувствительным и/или специфичным из-за недостаточной чувствительности и специфичности [3, 4].
Тринадцать лет назад был описан электрокардиографический феномен, позже названный «турбулентность сердечного ритма (ТСР)» (heart rate turbulence) [5]. Было показано, что у здоровых людей желудочковая экстрасистолия (ЖЭ) сопровождаются характерными краткосрочными колебаниями ЧСС. Эти колебания выражаются в краткосрочном учащении ритма с последующим урежением ЧСС и его восстановлением до прежних величин. Дальнейшие исследования позволили установить, что у пациентов после ИМ определяется другой постэкстрасистолический паттерн, а у лиц с высоким риском смерти ТСР уменьшена или даже отсутствует. В течение последнего десятилетия было показано, что ТСР является одним из самых значимых предикторов смерти в постинфарктном периоде.
Измерение турбулентности сердечного ритма
Турбулентность сердечного ритма можно определить при стандартном 24-часовом Холтеровском мониторировании. Для этого в отличие от других методов, таких как анализ альтернации Т-волны, не требуется никаких специальных электродов или другого оборудования. RR интервалы до и после ЖЭ усредняются для получения так называемых тахограмм, отражающих паттерн синусовых интервалов RR до и после ЖЭ (рисунок 1).
Рис 1. Оценка турбулентности сердечного ритма при записи 24-часового ХМ: Сглаженная кривая ТСР после усреднения сигнала от одиночных тахограмм Стрелкой указана начало турбулентности (Turbulence Onset) и наклон кривой турбулентности (Turbulence slope) [8].
Для вычисления ТСР необходимо соблюсти определенные условия, касающиеся экстрасистол и компенсаторной паузы. ТСР описывается двумя параметрами: начало турбулентности (НТ) и наклон кривой турбулентности (НКТ). НТ рассчитывается по следующей формуле: НТ = (RR1 + RR2) — (RR-2 + RR-1) (RR-2 + RR-1) × 100 [%], где RR-2 и RR-1 — интервалы перед ЖЭ, RR1 и RR2 — два RR интервала, следующие сразу за компенсаторной паузой. НКТ определяется как максимальный положительный наклон кривой регрессии оценивающийся по 5 и более последовательным интервалам RR в течение первых 15 RR интервалов после ЖЭ. В норме происходит ускорение синусового ритма после ЖЭ, что находит свое отражение в отрицательном значении НТ с последующим замедлением сердечного ритма с положительным НКТ. НТ 2,5 мс/RR интервала считаются показателями нормы [6]. Для стратификации риска в различных группах пациентов ТСР, как правило, делится на три категории: категория 0 означает нормальные показатели НТ и НКТ; категория 1 — либо НТ, либо НКТ является патологическим; категория 2 характеризуется патологическим НТ и НКТ. Если у пациента имеется синусовый ритм и отсутствует достаточное число ЖЭ для измерения ТСР, то его относят к категории 0, так как было показано, что у пациентов в обоих группах одинаково хороший прогноз [7]. Для пациентов в постинфарктном периоде такой подход обоснован, если не определена другая кардиальная патология (например, сердечная недостаточность).
Патофизиология ТСР
Конкретные патофизиологические механизмы, лежащие в основе ТСР, были в значительной степени неизвестны [5]. В последующем было установлено, что механизм развития ТСР является достаточно сложным и включает в себя обе ветви вегетативной нервной системы. ЖЭ вызывают транзиторное падение артериального давления (АД), что приводит к активации барорецепторов. Активность блуждающего нерва резко снижается, что немедленно проявляется в виде укорочения длины RR интервалов (отражается на параметре НТ). Однако потом повышается симпатическая активность с постепенным увеличением сосудистого сопротивления и систолического АД [9]. В результате активность блуждающего нерва восстанавливается и длина цикла увеличивается, что приводит к изменениям НКТ. Важно отметить, что ТСР является результатом взаимодействия как вегетативной, так и симпатической нервной систем, и изменения в одной из них может вызвать патологическую ТСР [10].
В 2003 году были опубликованы результаты первого проспективного исследования ISAR-HRT (Innovative Stratification of Arrythmic Risk by HRT, n=1455), в котором изучено прогностическое значение ТСР на большой когорте больных после ИМ, получающих адекватное лечение [7]. В исследование REFINE (Risk Estimation Following Infarction, Noninvasive Evaluation, n=322) ставилась цель определить прогностическую ценность сочетания нескольких предикторов риска внезапной смерти, включая ТСР, а также оптимальное время ее оценки после острого ИМ [14]. В 2009 году были опубликованы результаты крупнейшего проспективного исследования по ТСР. В ISAR-RISK (Innovative Stratification of Risk Prediction in Post-Infarction Patients with Preserved Left Ventricular Function) изучена прогностическая значимость сочетания ТСР и снижение «мощности» сердца (deceleration capacity), являющегося интегральным показателем функционирования сердца, определенным по Холтер-ЭКГ, у больных, перенесших ИМ, с сохраненной ФВ ЛЖ [15]. Снижение мощности является комбинированным маркером изменения ритма сердца, в основном оценки тонуса вагуса и 24-часовом мониторировании ЭКГ. В ISAR-SWEET (Intracoronary Stentingand Antithrombotic Regimen: Is Abciximab a Superior Way to Eliminate Thrombotic Risk in Diabetics) также тестировались комбинация патологического ТСР и снижения мощности у пациентов с сахарным диабетом [16].
Оценка предсказательной силы ТСР у больных, перенесших ИМ
Точность и чувствительность патологической ТСР при прогнозированиириска сердечно-сосудистых событий сильно зависит от исследуемой популяции и конечных точек. В ISAR-RISK из 2343 обследованных пациентов с ТСР 2-й категории определена группа высокого риска из 193 пациентов (8%), из них 56 умерли; 2150 пациентов (92%) имели ТСР категорий 0 и 1, из которых умерли 125. Вероятность смерти в течение 5 лет наблюдения за пациентами с патологической ТСР (категория 2) составила 34%. В то же время 1652 пациента (71%) с «нормальной» ТСР (категория 0) имели 5-летнюю смертность 6%.
Комбинация с другими факторами риска
Во всех исследованиях прогностическая ценность ТСР не зависела от других предикторов риска: возраста, пола, наличия сахарного диабета, почечной недостаточности [16], маркеры электрической нестабильности (аритмии, альтернация Т-волны) [14], поздние потенциалы [18], длительность QRS [19], маркеры структурных повреждений миокарда (например, ФВ ЛЖ), а также другие показатели вегетативной дисфункции (частота сердечных сокращений, вариабельность сердечного ритма и также снижение мощности сердца [15, 20]). В целях повышения предсказательной силы ТСР может быть объединена с другими предикторами риска. В ISAR-RISK и ISAR-SWEET изучали сочетание аномальных ТСР (ТСР категории 2) с умеренно измененным снижением мощности при стандартном 24-часовом Холтеровском мониторировании (≤4,5 мсек), что в основном является показателем состояния вегетативного статуса и базируется на обработке интервалов RR математическими алгоритмами [21]. Для сочетания патологической ТСР и снижения мощности введен термин «тяжелая вегетативная недостаточность» (ТВН). В исследованиях ISAR-RISK и ISAR-SWEET, в которых были включены 2343 и 481 пациент, соответственно, ТВН оказался сильным предиктором смерти. Эти данные были также подтверждены результатами недавнего мета-анализа, в котором анализировались результаты исследований MPIP, EMIAT и MRFAT [n=2594, 22]. Стратификация риска по ТСР являлась дополнением к оценке риска по ФВ ЛЖ. Лишь небольшая доля пациентов с патологической ТСР (категория 2) имела ФВ ЛЖ ≤30%. Таким образом, сила ТСР заключается в идентификации пациентов с высоким риском смерти среди пациентов с сохраненной ФВ ЛЖ (>30%). Больные имели плохой прогноз либо с патологической ТСР (n=153; 6,5% исследуемой популяции), либо с нарушением ФВ ЛЖ (n=80;3,4% исследуемой популяции). Незначительная часть пациентов с патологической ТСР и сниженной ФВ ЛЖ (n=40; 1,7% исследуемой популяции) имела худший прогноз. Наоборот, пациенты с нормальной ТСР (категория 0 или 1) и ФВ ЛЖ>30% (n=2070; 88,3% исследуемой популяции) имели хороший прогноз выживаемости. Как уже упоминалось выше, стратификация риска внезапной смерти может быть улучшена путем комбинации патологической ТСР с показателем снижения мощности [15].
Ограничения использования оценки турбулентности сердечного ритма
Существуют некоторые ограничения использования ТСР как предиктора риска смерти. Во-первых, оценка ТСР требует наличия синусового ритма. Пациенты с отсутствием синусового ритма, например, при фибрилляция предсердий, были исключены из исследований, хотя известно, что ФП значительно увеличивает риск смерти. Кроме того, в большинстве исследований по ТСР пожилые пациенты (возрасте >75 лет) исключались. Как известно из исследования ATRAMI, вегетативная система теряет часть своей прогностической ценности с возрастом [23]. Аналогичные наблюдения были сделаны и для ТСР в исследовании ISAR-HRT [24]. ТСР оказалась значимым предиктором внезапной смерти у лиц в возрасте только ≥ 65 лет [25].Оценка ТСР также подразумевает наличие ЖЭ и в большинстве исследований, пациенты без ЖЭ были исключены из анализа (например, MPIP, EMIAT, ATRAMI).
Заключение
Д.Ф. Гареева, Б.И. Загидуллин, И.А. Нагаев, Р.Х. Зулькарнеев, Н.Ш. Загидуллин, Ш.З. Загидуллин
Башкирский государственный медицинский университет
Больница скорой медицинской помощи, г. Набережные Челны
Республиканский кардиологический диспансер, г. Уфа
Гареева Диана Фирдависовна — клинический ординатор кафедры пропедевтики внутренних болезней с курсом физиотерапии ИПО
2. Gregoratos G., Abrams J., Epstein, A. et al. (2002) ACC/AHA/NASPE 2002 guideline up date for implantation of cardiac pacemakers and antiarrhythmia devices summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee to update the 1998 pacemaker guide-lines). J. Am. Coll. Cardiol. 40, 1531-1540.
3. Myerburg R.J., Interian A.Jr., Mitrani R.M. et al. (1997). Frequency of sudden cardiac death and profiles of risk. Am. J. Cardiol. 80, 10F-19F.
4. Camm J., Klein H., and Nisam S. (2007). The cost of implantable defibrillators: perceptions and reality. Eur. Heart J. 28, 392-397.
5. Schmidt G., Malik M., Barthel P., et al. (1999). Heart-rate turbulence after ven-tricular premature beats as a predictor of mortality after acute myocardial infarction. Lancet 353, 1390-1396.
6. Bauer A., Malik M., Schmidt G. et al. (2008). Heart rate turbulence: standards of measurement, physiological interpretation, and clinical use: International Society for Holter and Noninvasive Electrophysiology Consensus. J. Am. Coll. Cardiol. 52, 1353-1365
7. Barthel P., Schneider R., Bauer A. et al. (2003). Risk stratification after acute my-ocardial infarction by heart rate turbulence. Circulation 108, 1221-1226.
8. S. Zuern C., Barthel P. and Bauer A. (2011). Heart rate turbulence as risk-predictor after myocardial infarction. Frontiers of Phys. 2, 99.
9. Segerson N.M., Wasmund S.L., Abedin M. et al. (2007). Heart rate turbulence pa-rameters correlate with post-premature ventricular contraction changes in muscle sympathetic activity. Heart Rhythm 4, 284-289.
10. Wichterle D., Melenovsky V., Simek, J. et al. (2006). Hemodynamics and auto-nomic control of heart rate turbulence. J. Cardiovasc. Electrophysiol. 17, 286-291.
11. Ghuran A., Reid F., La Rovere M.T. et al. (2002). Heart rate turbulence-based predictors of fatal and nonfatal cardiac arrest (the autonomic tone and reflexes after myocardial infarction substudy). Am. J. Cardiol. 89, 184-190.
12. Hallstrom A.P., Stein P.K., Schneider R. (2005). Characteristics of heart beat in-tervals and prediction of death. Int. J. Cardiol. 100, 37-45.
13. Makikallio T.H., Barthel P., Schneider R. et al. (2005). Prediction of sudden car-diac death after acute myocardial infarction: role of Holter monitoring in the modern treatment era. Eur. Heart J. 26, 762-769.
14. Exner D.V., Kavanagh K.M., Slawnych M.P. (2007). Noninvasive risk assessment early after a myocardial infarction the REFINE study. J. Am. Coll. Cardiol. 50, 2275-2284.
15. Bauer A., Barthel P., Schneider R. et al. (2009a). Improved stratification of auto-nomic regulation for risk prediction in post-infarction patients with preserved left ventricular function (ISAR-Risk). Eur. Heart J. 30, 576-583.
16. Barthel P., Bauer A., Muller A. (2011). Reflex and tonic autonomic markers for risk stratification in patients with type 2 diabetes surviving acute myocardial infarction. Diabetes Care 34, 1833-1837.
17. Huikuri H.V., Exner D.V., Kavanagh K.M. et al. (2010). Attenuated recovery of heart rate turbulence early after myocardial infarction identifies patients at high risk for fatal or near-fatal arrhythmic events. Heart Rhythm 7, 229-235.
18. Bauer A., Guzik P., Barthel P. et al. (2005). Reduced prognostic power of ventric-ular late potentials in post-infarction patients of the reperfusion era. Eur. Heart J. 26, 755-761.
19. Bauer A., Watanabe M., Barthel P. et al. (2006b). QRS duration and late mortality in unselected post-infarction patients of the revascularization era. Eur. Heart J. 27, 427-433.
20. Bauer A., Kantelhardt J.W., Barthel P. et al. (2006а). Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study. Lancet 367, 1674-1681.
21. Bauer A., Kantelhardt J.W., Bunde A. et al. (2006c). Phase-rectified signal aver-aging detects quasiperiodicities in non-stationary data. Physica A 364, 423-434.
22. Bauer A., Barthel P., Muller A., et al. (2009c). Risk prediction by heart rate tur-bulence and deceleration capacity in post infarction patients with preserved left ventricular func-tion retrospective analysis of 4 independent trials. J. Electrocardiol. 42, 597-601.
23. La Rovere M. T., Bigger J. T. Jr., Marcus F. I., et al. (1998). Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarc-tion.ATRAMI (autonomic tone and reflexes after myocardial infarction) investigators. Lancet 351, 478–484.
24. Barthel P., Bauer A., Schneider R. and Schmidt G. (2005). Impact of age on prog-nostic significance of heart rate turbulence (abstract). Circulation (Suppl.) 112, U456.