Что более электроотрицательно хлор или водород
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
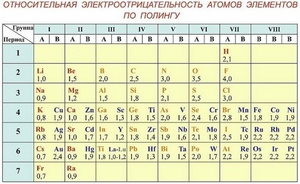
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
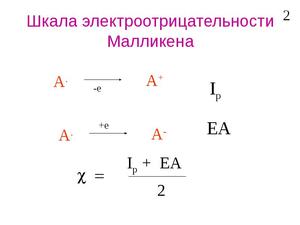
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
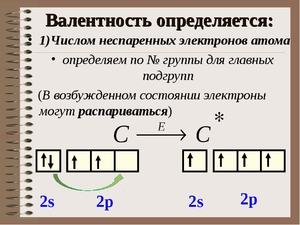
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Таблица электроотрицательности химических элементов

Всего получено оценок: 331.
Всего получено оценок: 331.
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента
Элемент
Символ
Электроотрицательность
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Что более электроотрицательно хлор или водород
§3.4. Электроотрицательность. Различие между полярной ковалентной и ионной связями.
Только о небольшой части всех химических связей можно сказать, что они являются чисто ковалентными. В таких соединениях поделенная пара электронов всегда находится на одинаковом расстоянии от ядер обоих атомов. Это возможно тогда, когда между собой связаны одинаковые атомы. Например, из рассмотренных нами в этой главе молекул чисто ковалентными окажутся двухатомные молекулы водорода, кислорода, хлора, азота:
Когда между собой связываются разные атомы, поделенная пара химической связи всегда смещена к одному из атомов. К какому? Разумеется, к тому атому, который проявляет более сильные акцепторные свойства.
Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Электроотрицательность зависит не только от расстояния между ядром и валентными электронами, но и от того, насколько валентная оболочка близка к завершенной. Атом с 7 электронами на внешней оболочке будет проявлять гораздо большую электроотрицательность, чем атом с 1 электроном.
Фтор является «чемпионом» электроотрицательности по двум причинам. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего одного электрона) и, во-вторых, эта валентная оболочка (. 2s 2 2p 5 ) расположена близко к ядру. Например, в соединении NaF поделенная электронная пара оттянута к атому фтора так сильно, что можно, почти не погрешив против истины, приписать фтору целый отрицательный, а натрию – целый положительный заряд:
Ионную связь можно рассматривать как предельный случай полярной ковалентной связи.
Внешне соединения с ионными и ковалентными связями могут довольно сильно отличаться друг от друга. Ионные соединения – обычно твердые и хрупкие вещества, плавящиеся при высоких температурах. Растворы ионных соединений проводят электрический ток, потому что при растворении они распадаются на заряженные ионы. Типичное ионное соединение – поваренная соль NaCl.
Соединения с ковалентными и полярными ковалентными связями в обычных условиях часто являются газами или жидкостями. Если это твердые вещества, то плавятся они достаточно легко, хотя есть и исключения, которые мы обсудим в §3.8. Растворы таких веществ далеко не всегда проводят электрический ток, потому что при растворении они могут и не распадаться на ионы. Типичные соединения с полярными ковалентными связями: хлороводород HCl, углекислый газ СО2, вода Н2О, песок SiO2, многочисленные органические соединения.
На примере родственных соединений HCl и NaCl можно видеть, как увеличение полярности связи может в итоге приводить к качественным изменениям в свойствах веществ при одинаковых условиях (рис. 3-4).
Рис. 3-4. Хлороводород HCl (содержит полярную ковалентную связь) при комнатной температуре – газообразное вещество. В этих же условиях поваренная соль NaCl (ионная связь между атомами) – твердое кристаллическое вещество.
Иногда встречается утверждение, что ионная связь – это химическая связь, возникающая в результате кулоновского притяжения противоположно заряженных ионов. Действительно, электростатическое притяжение противоположных зарядов в ионных соединениях вносит заметный вклад в энергию связи. Но в то же время ковалентная составляющая химической связи никогда не выключается полностью даже в наиболее ионных соединениях.
Можно ли измерить степень полярности ковалентной связи? Где кончается полярная ковалентная связь и начинается ионная?
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность ( X ) измеряется в относительных величинах (таблица 3-3).
Таблица 3-3. Электроотрицательности ( X ) некоторых элементов.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательнось по Полингу – это свойство атомов, связанных химическими связями, т.е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века.
Для фтора во многих книгах приводится значение X = 4,0 и в этом нет ошибки. Просто в таблице 3-3 приведены уточненные данные и, кроме того, значение 3,98 вполне может быть округлено до 4,0.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов Li, Na, Mg и т.д. И это понятно – ведь их внешние электронные оболочки далеки от завершения и для них выгоднее сдвинуть свои валентные электроны к чужому атому, чем «добирать» электроны у соседей.
Обратите внимание на необычно высокую электроотрицательность атома водорода ( X = 2,20) – она значительно выше значений для щелочных металлов. В этом нет ничего удивительного: атом водорода лишь формально является электронным аналогом атомов щелочных металлов – на самом деле ему не хватает только одного электрона для полного завершения своей валентной оболочки (как и атомам галогенов с их высокими значениями X ). Поэтому электроноакцепторные свойства атома водорода выражены сильнее, чем у щелочных металлов.
Допустим, между двумя какими-то элементами образовалась химическая связь. Теперь разность электроотрицательностей этих элементов (Δ X ) позволит нам судить о том, насколько эта связь отличается от чисто ковалентной.
Какие бы два атома не были связаны между собой, для вычисления Δ X нужно из большей электроотрицательности вычесть меньшую.
Таким образом, при возникновении химической связи происходит не только обобществление электронов, но и в ряде случаев передача электронов от одного атома другому. Эта передача может быть частичной или почти полной. Электроны всегда передаются от атома с меньшей электроотрицательностью атому с большей электроотрицательностью.
3.14. Определите характер связи в приведенных ниже соединениях и разделите их на три группы: а) соединения с ковалентными связями, б) с полярными ковалентными связями, в) с ионными связями. Решение обоснуйте.
3.15. В таблице 3-3 в тексте параграфа не приведены электроотрицательности для благородных газов. Попробуйте предсказать значение электроотрицательности ксенона в соединении XeF 6 (речь идет о качественной оценке: “больше чем у фтора”, “меньше чем у фтора”). Проверьте свое предположение по таблице электроотрицательностей элементов в приложении. Предложите свое объяснение экспериментальным фактам.
Что более электроотрицательно хлор или водород
Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
Запишите в поле ответа номера выбранных соединений.
Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (,
и
), одной молекулы и атомом эле-мента с высокой электроотрицательностью (
,
,
) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь.
Среди предложенных веществ кислород в составе группы −ОН присутствует только в молекулах спиртов и фенолов, поэтому среди предложенных веществ водородная связь возможна между молекулами спиртов и фенолов. Остальные вещества относятся к углеводородам и не способны к образованию водородных связей.
Из предложенного перечня выберите два вещества, в которых между молекулами образуется водородная связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Водородная связь — это особый вид связи между частично положительно заряженным водородом связанным с электроотрицательным атомом (,
или
) одной молекулы (или, для внутримолекулярной связи, одной части молекулы) и частично отрицательно заряженным атомом азота, кислорода или фтора другой молекулы (или другой части молекулы).
1. В молекуле метана электроотрицательности атомов водорода и углерода близки, поэтому практически нет перераспределения заряда.
2. В молекуле фтороводорода есть частично отрицательно заряженный фтор и частично положительно заряженный водород, что позволяет образовывать водородную связь.
3. Молекула водорода содержит ковалентную неполярную связь, поэтому нет перераспределения заряда
4. В молекуле ацетальдегида электроотрицательности атомов водорода и углерода близки, поэтому практически нет перераспределения заряда, а кислород имеет сильный отрицательный заряд.
5. В молекуле перекиси водорода есть частично отрицательно заряженный кислород и частично положительно заряженный водород, что позволяет образовывать водородную связь.