декстрокардия что это такое простыми словами
Декстрокардия что это такое простыми словами
Транспозиция внутренних органов (situs viscerus inversus) – редкая аномалия развития, являющаяся следствием нарушения дифференциации плодного яйца и проявляющаяся в зеркальном, по отношению к нормальному, расположении внутренних органов. Частота распространения находится в диапазоне от 1:5000 до 1:20 000. Такое расположение внутренних органов выявляют в одном наблюдении на 10 млн родов [1]. Специфическая генетическая причина декстрокардии с situs inversus не была идентифицирована, и закономерности наследования не были подтверждены в большинстве случаев, но состояние является результатом нарушения реализации лево-правосторонеей ассиметрии во внутриутробном периоде [2].
Данный процесс проходит в два этапа: 1 – потеря симметрии, 2 – реализация асимметрии, сопровождающаяся включением каскада генов с асимметричной экспрессией и последующей морфологической перестройкой организма. Было установлено, что основной регулирующий фактор этапа 2 у млекопитающих – экспрессия гена Nodal, продукт которого, в свою очередь, запускает экспрессию гена Ptx2 в левой части эмбриона. Была выдвинута гипотеза переноса морфогена: биение ресничек гензеновского узелка способствует левостороннему току жидкости в левой части узелка, увеличивается концентрация сигнальной молекулы, которая и запускает сигнальный каскад латеральности Nodal-Ptx2 и определяет, разовьются ли в левой части эмбриона морфологические признаки левой стороны тела [3].
Situs inversus totalis, то есть транспозиция внутренних органов с декстрокардией, биологически нормальна, и, как правило, не сопровождается патологией развития самих органов и нарушением их функций, но в 5–10 % может сопровождаться врожденными пороками сердца, чаще всего в виде транспозиции магистральных сосудов.
При situs inversus incompletus встречается аплазия селезенки и патология развития сердца (синдром Ивемарка), до 20 % пациентов имеют патологию дыхательных путей и легких (синдром Картагенера). Изолированная декстрокардия, характеризующаяся нормальным положением желудка, печени, селезенки, также сопровождается пороками сердца. Но при транспозиции внутренних органов с левокардией частота их приближается к 95 % случаев. Приблизительно 25 % людей с situs inversus имеют основной диагноз «первичная цилиарная дискинезия» [4].
В клинической практике при обследовании пациентов с зеркальным расположением внутренних органов имеется большая вероятность анатомической дезориентировки, так как большинство симптомов будут находиться на «неправильной» стороне, а это может повлечь постановку неверного диагноза и выбор некорректного метода лечения заболевания. Транспозиция также усложняет операции по трансплантации внутренних органов, поскольку донором с большой вероятностью является человек с обычным расположением внутренних органов (situs solitus). Поскольку сердце и печень не симметричны, возникают геометрические проблемы при помещении органа в полость, сформированную в зеркальном отображении [5]. Таким образом, знание и выявление данной аномалии развития позволяет предупредить диагностические ошибки, ускорить постановку верного диагноза и раньше начать соответствующее лечение.
Пациент А., 21 год, обследован в ГКБ №2 г. Перми по поводу уточнения анатомических, морфологических и функциональных особенностей внутренних органов.
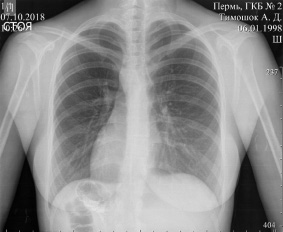
Рентгеноскопия органов грудной полости. Рентгенография органов грудной полости в прямой проекции
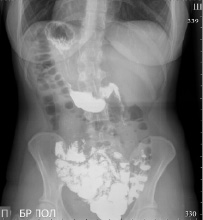
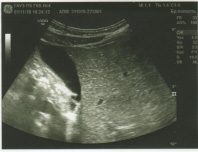
При рентгеноскопии органов грудной полости, на рентгенограмме органов грудной полости: легочная ткань удовлетворительной прозрачности. Корни структурные. Диафрагма ровная, подвижна. Синусы свободные. Сердце имеет правостороннее расположение, поперечник не увеличен. Аорта без изменений, расположена справа (рис. 1).
Рис. 1. Рентгеноскопия органов грудной полости
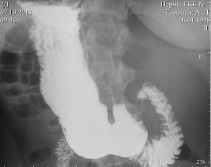
Рентгенисследование пищевода, желудка, 12-перстной кишки. Обзорный снимок брюшной полости. Рентгеноскопия брюшной полости. Рентгенконтроль пассажа бариевой взвеси по ЖКТ
При рентгеноскопии и на рентгенограмме брюшной полости патологических теней и уровней жидкости не выявлено. Газовый пузырь желудка расположен справа, левый изгиб толстой кишки под правым куполом диафрагмы, тень печени под левым куполом диафрагмы.
Исследование проведено в вертикальном и горизонтальном положении пациента. Пищевод не изменён, с ровными контурами, свободно проходим, складки слизистой ровные, четкие, продольные на всем протяжении, брюшной отдел поворачивает вправо. Диафрагмальный жом функционирует.
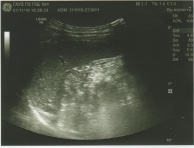
Газовый пузырь ровный, расположен справа. Свод не утолщен, несколько запрокинут кзади. Желудок расположен справа, гипотоничен, подвижен, не опущен, с ровными по кривизнам контурами. Складки слизистой среднего калибра, продольные, прослеживаются во всех отделах. Перистальтика глубокая, по обеим кривизнам, до привратника. Луковица ДПК расположена слева, треугольной формы, стенки её ровные, хорошо сокращается. ДПК расположена слева, развернулась обычно, не оттеснена. Дуодено-еюнальный переход расположен справа, плавный (рис. 2).
Рис. 2. Рентгеноскопия органов брюшной полости
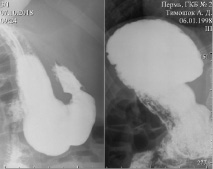
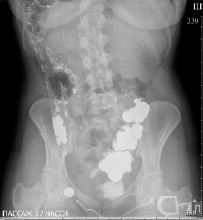
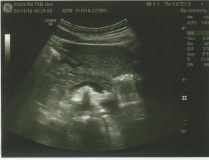
Через 1 час эвакуация из желудка не задержана, начальные отделы тощей кишки, расположенные справа, подвздошная кишка слева, заполнились равномерно. Выполняется купол слепой кишки, расположенный слева (рис. 3).
Рис. 3. Рентгенография органов брюшной полости
Рис. 4. Рентгенография органов брюшной полости
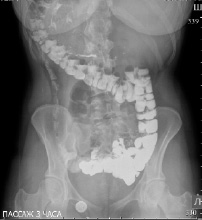
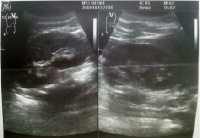
Через 3 часа контрастирована дистальная часть подвздошной кишки, толстая кишка до левого изгиба, расположенного под правым куполом диафрагмы. Следы контраста в нисходящей и сигмовидной кишке, расположенные справа (рис. 4).
Через 12 часов после приема бариевой взвеси: туго выполняется слепая кишка, восходящая, на остальном протяжении в толстой кишке следы контраста, сигмовидная кишка удлинена. Следы бария в прямой кишке (рис. 5).
Рис. 5. Рентгенография органов брюшной полости
Заключение: полная транспозиция органов грудной, брюшной полости (situs inversus viscerum). Дискинезия тонкой кишки по гипермоторному типу.
УЗИ органов брюшной полости
Печень: расположена слева. Контуры ровные, четкие Размеры не увеличены: правая доля (КВР) – 125 мм, левая доля – 42 мм, хвостатая доля- 17 мм. Углы печени острые. Эхогенность не изменена. Эхоструктура однородная. Очаговых образований нет. Сосудистый рисунок сохранен. Воротная вена – 9 мм. Внутрипеченочные протоки не расширены. Холедох – 3 мм (рис. 6).
Желчный пузырь: форма грушевидная, с перетяжкой в н/3. Размеры не увеличены: 28×78 мм. Стенки не утолщены – 2 мм, уплотнены. Конкрементов нет. Полость однородная (рис. 7).
Рис. 7. УЗИ желчного пузыря
Рис. 8. УЗИ селезёнки
Селезёнка: расположена справа. Контур ровный, четкий. Размеры не увеличены: 90×30 мм. Эхогенность нормальная. Эхоструктура однородная. Очаговых образований нет (рис. 8).
Поджелудочная железа: контур ровный, четкий. Размеры не увеличены: головка- 24 мм, тело- 10 мм, хвост- 26 мм. Эхогенность не изменена. Эхоструктура однородная. Очаговых образований нет. Вирсунгов проток не расширен (рис. 9).
Рис. 9. УЗИ поджелудочной железы
Свободная жидкость в брюшной полости не визуализируется.
Заключение: УЗ-признаки situs inversus без структурных изменений эхоанатомии органов.
Размеры правой 99×54 мм, левой 94×58 мм. Расположение типичное. Подвижность физиологическая. Контуры: умеренно опущена. Кортико-медуллярная дифференциация сохранена. Паренхима: нормальной эхогенности. Толщина паренхимы 19–24 мм. Чашечно-лоханочные системы: некоторые чашечки расширены до 8–9 мм. Очаговые образования не визуализируются. Сосудистая сеть прослеживается до капсулы почки (рис. 10).
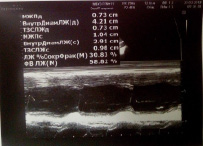
Легочная артерия: не расширена, СДЛА= 21 мм рт ст. V max 0,8 м/с, Pg max 2,6 mm Hg, регургитация – 1ст. Оценка региональной сократимости: зон асинергии не выявлено. Во время исследования ритм правильный. В полости ЛЖ лоцируется дополнительная хорда (рис. 11).
Рис. 11. УЗИ сердца. Дополнительная хорда
Заключение: декстрокардия, полости сердца не расширены, состоятельны, клапаны сформированы правильно, интактны. Общая сократимость в норме, зон ассинергии не выявлено, релаксация не нарушена (рис. 12).
В результате проведенного комплексного обследования у пациента установлено наличие декстрокардии и дополнительной хорды в полости левого желудочка, правостороннее расположение желудка, тощей кишки, нисходящей ободочной кишки, удлиненной сигмовидной кишки и селезенки, левостороннее расположение печени, двенадцатиперстной, подвздошной, слепой и восходящей ободочной кишки, дискинезия тонкой кишки по гипермоторному типу, каликоэктазия почек. Описанный клинический случай представляет интерес как редко встречающаяся врожденная аномалия развития, не сопровождающаяся грубым нарушением строения органов и их функций.
Декстрокардия что это такое простыми словами
Описаны отдельные наблюдения эктопии сердца на шее пли в брюшной полости, а также случаи частичного или полного расположения его вне грудной клетки. В последних случаях отсутствует грудина, иногда кожа и перикард, видна глазом и пальпируется пульсация сердца.
Закладка сердца появляется в шейной области у зародыша в конце 2-й недели развития. В дальнейшем сердечная трубка после 5-й недели перемещается каудально (С. С. Михайлов). В норме сердце останавливается над диафрагмой п располагается внутри грудной клетки.
Опасность грозит от сопутствующих пороков развития, от травматизации незащищенного грудной клеткой органа, от присоединения инфекции (эпикардит, перикардит).
Различают истинную декстрокардию и декстропозицию. При истинной декстрокардии выделяют три формы.
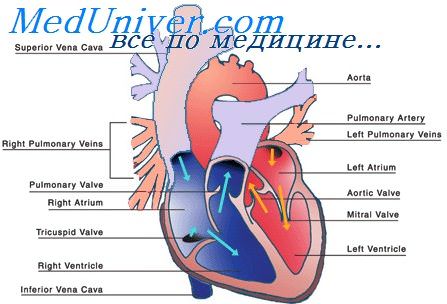
1. Декстрокардия с обратным расположением внутренностей (situs viscerum inversus). Расположение сердца и соотношение его полостей являются как бы зеркальным отражением нормального расположения. Верхушечный толчок сердца оказывается на правой стороне, перкуторно и при аускультации. При рентгенологическом исследовании справа находится все то, что в норме определяется слева от средней линии.
На ЭКГ I отведение соответствует зеркальному отражению обычного I отведения, положительные зубцы отрицательные, и наоборот, II отведение соответствует III отведению, а III отведение — IV отведению.
Аномалия не вызывает функциональных нарушений.
2) Декстрокардия без обратного расположения внутренностей. Расположение сердца обратное, как в зеркале, однако остальные органы занимают обычное расположение. Данные перкуссии, аускультации, рентгенологического исследования и ЭКГ такие же, как при предыдущей форме. Указанная аномалия развития сердца тоже не сопровождается нарушением функций в организме больного.
3) Поворот сердца без обратного расположения внутренностей: сердце как бы повернуто вперед и направо. Аорта при этом остается на месте, проходит слева от позвоночника. На правой стороне впереди оказывается левый желудочек, а за грудиной — левое предсердие. Обычно такая аномалия сопровождается другими аномалиями развития, от которых могут зависеть симптомы и течение. Диагноз уточняется ангиокардиографией и катетеризацией сердца(П. Кишш, Д. Сутрели).
Под декстропозицией сердца в собственном смысле слова подразумевают вторичное перемещение сердца вправо в результате патологических процессов: рубцов и сращений после воспалительных процессов (тянут сердце вправо), опухолей, выпота, диафрагмальных грыж, а также пневмоторакса (отодвигают сердце вправо). Симптомы и течение зависят от основных заболеваний.
Аномалии кровоснабжения сердца
Последние встречаются очень редко. В описанных наблюдениях венечные артерии отходили от легочного ствола, чаще левая, реже правая или обе. Направление венечных сосудов даже при тяжелых врожденных пороках сердца обычно остается постоянным, не меняется.
При аномальном отхождении от легочного ствола у плода никаких изменений нет, но после рождения в миокарде наступает гипоксия. Дальнейшее течение зависит от развития коллатералей. При недостаточном кровоснабжении от недостатка кислорода уже в ближайшие недели после рождения появляется быстро нарастающая недостаточность сердца и кровообращения. Дети погибают от декомпенсации.
В более легких случаях при хорошо развитых коллатералях ребенок может достичь подросткового и юношеского возраста, но обычно внезапно умирает (И. Литтманн, Р. Фоно).
Кровоснабжение сердца изменено также при аномалиях отхождения венечных артерий и впадения вен в сердце.
Декстрокардия
Декстрокардия — это аномалия внутриутробного развития, при которой большая часть сердца расположена с правой стороны грудной клетки. Изолированная форма патологии протекает бессимптомно и выявляется во время профосмотров. При сочетании декстрокардии с другими пороками отмечаются цианоз или бледность кожи, слабость, судороги. Диагностика включает физикальный осмотр, ЭКГ, эхокардиографию, рентгенографию грудной клетки. При необходимости проводят инвазивные исследования — ангиокардиографию, катетеризацию сердца. Лечение неосложненной декстрокардии не требуется. При наличии угрожающих жизни аномалий назначают их оперативную коррекцию с последующей реабилитацией больных.
МКБ-10
Общие сведения
Термин «декстрокардия» образован из двух слов: латинского «dexter» (правый) и греческого «kardia» (сердце). Относится к редким аномалиям: частота встречаемости в разных регионах колеблется от 1:8000 до 1:25000 новорожденных. В России распространенность декстрокардии составляет 3,3% от всех аномалий положения органа. Декстрокардию следует отличать от декстрапозиции сердца — приобретенного патологического состояния, которое возникает при смещении органа (вследствие левостороннего гидроторакса, опухоли, правостороннего ателектаза).
Причины декстрокардии
Развитие заболевания связывают с генетическим дефектом, проявляющимся на этапе внутриутробного формирования органов плода. У страдающих декстрокардией выявлены специфические мутации генов HAND, ZIC3Shh, ACVR2, Pitxz. Наибольшее признание получила теория аутосомно-рецессивного наследования порока: аномальное положение сердца носит семейный характер, повторяется через 1-2 поколения.
Помимо семейной предрасположенности, в процессе мутаций генетического материала доказано участие тератогенных факторов. Экзогенные тератогены подразделяются на 3 основных группы по характеру воздействия:
Эндогенные причины включают гинекологические и экстрагенитальные заболевания беременной, тяжелые токсикозы.
Патогенез
В основе декстрокардии лежит нарушение процессов эмбриогенеза на ранних стадиях внутриутробного развития. В норме на 1-2 месяце беременности формирующаяся сердечная трубка начинает изгибаться влево. При наличии типичных для декстрокардии мутаций происходит аномальное искривление этой трубки в правую сторону. При этом нарушается дальнейшее формирование эмбриона, может изменяться позиция других висцеральных органов, чаще всего печени и селезенки.
Классификация
С учетом особенностей закладки органа в эмбриональном периоде выделяют 3 варианта аномалии:
Врачи-кардиологи при изучении вопроса аномалии положения сердца используют классификацию, которая учитывает локализацию других органов. Варианты декстрокардии:
Симптомы декстрокардии
Изолированная форма, которая не сочетается с другими сердечными аномалиями, не имеет клинических проявлений. Специфические жалобы обычно отсутствуют. Состояние обнаруживается в детском или взрослом возрасте при проведении профилактических осмотров, обращении за врачебной помощью по другой причине. Люди с декстрокардией чаще других страдают болезнями нижних дыхательных путей: трахеитами, бронхитами.
Клинические симптомы возникают при наличии других аномалий висцеральных органов или возникновении на фоне декстрокардии кардиальной патологии. Пациенты ощущают постоянную слабость и повышенную утомляемость, не проходящую после сна. Их периодически беспокоят приступы учащенного сердцебиения, головокружения. Кожные покровы становятся бледными, иногда возникает синеватый оттенок кожи вокруг рта, на пальцах рук.
Сочетание декстрокардии и врожденных сердечных пороков проявляется яркой клинической картиной уже в раннем детском возрасте. Для «белых» пороков характерна постоянная бледность кожи, при «синих» формах наблюдаются акроцианоз или тотальный цианоз. Появляются одышечно-цианотические приступы: ребенок становится беспокойным, кожа холодная, дыхание хриплое и прерывистое.
Осложнения
Неосложненная сердечными пороками декстрокардия не представляет серьезной опасности для жизни и здоровья. При присоединении синдрома Картагенера развивается прогрессирующая дыхательная недостаточность, формируются обширные гнойно-воспалительные очаги в легочной паренхиме. Сложности возникают при оказании неотложной реанимационной или хирургической помощи больным, поскольку зеркальная анатомия затрудняет постановку диагноза.
Если декстрокардия комбинируется с аномалиями формирования сердечных структур или магистральных сосудов, возможны серьезные осложнения. Гемодинамические нарушения при «синих» пороках быстро прогрессируют в течение первых месяцев жизни ребенка. Хроническая гипоксия чревата необратимым повреждением мозга, снижением интеллекта, инвалидностью. При отсутствии квалифицированной кардиохирургической помощи высок риск летального исхода.
Диагностика
Опытный терапевт-кардиолог может заподозрить декстрокардию уже на первичном приеме при физикальном исследовании. В ходе пальпации предсердечной области верхушечный толчок обнаруживается справа от грудины. Перкуторно врач отмечает смещение границ сердечной тупости вправо, при аускультации выслушиваются изменения сердечных тонов. При подозрении на декстрокардию назначают полное обследование, в которое включены следующие методы:
Лечение
Консервативная терапия
Аномальное расположение сердца без дополнительных заболеваний не сопровождается расстройствами гемодинамики и не требует лечения. При развитии сердечно-сосудистых заболеваний терапию проводят так же, как и для больных с отсутствием декстрокардии. При сочетании аномалии с синдромом Картагенера назначается симптоматическая терапия, предполагающая прием ингаляционных и топических назальных кортикостероидов, бета-адреномиметиков.
Хирургическое лечение
Оперативное вмешательство показано при сочетанных пороках развития сердца, транспозиции магистральных сосудов. Срок выполнения операции устанавливают с учетом вида порока и тяжести нарушений гемодинамики. Если угрожающие жизни состояния отсутствуют, хирургическую коррекцию откладывают до 3-6-летнего возраста ребенка. Когда декстрокардия сочетается с тяжелыми пороками (например, тетрадой Фалло), вмешательство проводят в максимально ранние сроки.
Реабилитация
В современной кардиологии применяют трехэтапную реабилитационную программу для пациентов, которые перенесли операцию по коррекции аномалий сердечно-сосудистой системы. Медицинский этап занимает первые дни-недели после хирургического вмешательства. Затем приступают к физической и психофизиологической реабилитации, которая включает массаж, ЛФК, физиотерапию. Заключительный этап — социально-трудовая реабилитация взрослых больных.
Прогноз и профилактика
Изолированные формы декстрокардии не влияют на качество жизни, не повышают риск развития других заболеваний. Прогноз благоприятный. Комбинированные пороки протекают более тяжело, но при проведении своевременного и комплексного лечения удается добиться полной медицинской и социальной реабилитации пациентов. Профилактические мероприятия направлены на устранение тератогенных факторов, медико-генетическое консультирование беременных.
Декстрокардия что это такое простыми словами
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
Название порока сердца
Сочетание ВПС с патологией других органов
Сроки выявления ВПС (неделя беременности), исход
1. Перимембранозный дефект межжелудочковой перегородки