диагноз алд что такое
Диагноз алд что такое
Адренолейкодистрофия (АЛД) представляет собой группу дегенеративных заболеваний ЦНС, которые часто ассоциируются с надпочечниковой недостаточностью и передаются по Х-сцепленному рецессивному типу. Классическая адренолейкодистрофия (АЛД) дебютирует в возрасте 5-15 лет в виде снижения школьной успеваемости, поведенческих изменений и расстройства походки.
Адренолейкодистрофия (АЛД) вызвана мутацией в гене ABCD 1 на хромосоме Xq28, кодирующем синтез пероксисомного переносчика, который участвует в транспорте жирных кислот с очень длинной цепью внутрь пероксисомы. Заболеваемость адренолейкодистрофией (АЛД) составляет примерно 1:20 000 мальчиков. На ранних стадиях характерны генерализованные судороги.
Признаки поражения пирамидных путей включают спастический тетрапарез и контрактуры, появляется атаксия, выражены нарушения глотания вследствие псевдобульбарного паралича — эти симптомы преобладают в конечных стадиях заболевания.
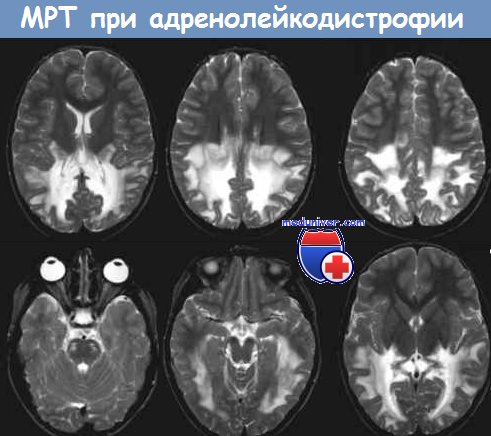
Снижение функции надпочечников наблюдается примерно в 50 % случаях; надпочечниковая недостаточность с патологической пигментацией кожи (смуглый, коричневатый оттенок кожи без воздействия солнца) может предшествовать дебюту неврологической симптоматики. На КТ и МРТ перивентрикулярная демиелинизация, начинаясь с задних отделов, постепенно распространяется в белом веществе в передние отделы больших полушарий.
Адреномиелоневропатия начинается с медленно прогрессирующего спастического парапареза, недержания мочи и импотенции на 3-4-м десятилетии жизни, хотя признаки надпочечниковой недостаточности возможны с детского возраста. Описаны случаи типичной адренолейкодистрофии (АЛД) в семьях, в которых у пробанда была диагностирована адреномиелоневропатия.
Одна из сложностей диагностики Х-адренолейкодистрофии (АЛД) состоит в том, что у пациентов из одной семьи нередко наблюдается различное клиническое течение заболевания. Например, у мальчика диагностирована адренолейкодистрофия (АЛД) с тяжелым течением и летальным исходом в возрасте 10 лет, у брата этого пациента отмечалась адреномиелоневропатия с поздним дебютом, у третьего брата симптомы болезни отсутствовали. Генетическое консультирование в семьях, в которых выявлены мальчики на пресимптомной стадии заболевания, затруднено, так как отсутствуют надежные методы прогнозирования клинического течения заболевания.
Неонатальная адренолейкодистрофия (АЛД) характеризуется выраженной гипотонией, тяжелой задержкой психомоторного развития и ранним дебютом судорог. Тип наследования — аутосомно-рецессивный. Отсутствие зрительной фиксации обусловлено атрофией зрительных нервов. Тесты, определяющие функцию надпочечников, без нарушений, однако при посмертном патоморфологическом исследовании находят атрофию надпочечников. Коррекция надпочечниковой недостаточности для предотвращения прогрессирования неврологических нарушений неэффективна.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «неврология»
Адренолейкодистрофия
Тип наследственного заболевания, при котором повреждается мембрана (миелиновая оболочка), изолирующая нервные клетки мозга. При АЛД организм не может расщеплять насыщенные жирные кислоты с очень длинной углеродной цепью (ОДЦЖК), накапливая их в мозге, органах нервной системы и надпочечниках.
Формы Х-сцепленной АЛД
Наиболее распространенным типом АЛД является Х-сцепленная АЛД, характеризующаяся генетическим дефектом Х-хромосомы. Чаще диагностируется у мужчин.
Причины
АДЛ наследственное заболевание, основной причиной которого является нарушение обмена жирных кислот, вследствие чего происходит генетическая мутация.
Факторы риска
Симптомы
Поскольку заболевание является наследственным, диагноз может быть предсказан задолго до начала проявления симптомов. При дебюте АМН различают следующие симптомы:
Осложнения
Зависят от формы заболевания. При церебральных формах прогноз обычно неблагоприятный; в случае развития АМН продолжительность жизни очень широко варьируется.
Диагностика
Проводится на основании клинической картины после осмотра врача и сбора анамнеза. Также при постановке диагноза бывают информативны следующие исследования:
Лечение
Возможные методы лечения:
Основные рекомендации
Недавние клинические исследования показали, что у мальчиков на ранней стадии церебральной формы АЛД положительный результат лечения дала генная терапия, как альтернатива трансплантации стволовых клеток. Ранние результаты генной терапии являются многообещающими.
Адренолейкодистрофия – это наследственная патология из группы пероксисомных болезней, связанная с накоплением в организме жирных кислот с очень длинной углеродной цепью. Заболеванию свойственен клинический полиморфизм – различные формы характеризуются поражением мозговой ткани и надпочечников, проявляясь сочетанием неврологических расстройств (сенсомоторных, эмоционально-когнитивных, поведенческих) и гипокортицизма. Диагностируют патологию по клиническим данным, подтверждая биохимическими, молекулярно-генетическими тестами, МРТ и КТ мозга. Комплексное лечение предполагает диету, фармакотерапию, трансплантацию гемопоэтических клеток.
МКБ-10
Общие сведения
Адренолейкодистофия (болезнь Зиммерлинга-Крейтцфельдта, Аддисона-Шильдера) была впервые описана немецкими невропатологами Эрнстом Зиммерлингом и Гансом-Герхардом Крейтцфельдтом в 1923 году. Является не настолько редким заболеванием, как считалось ранее – встречается повсеместно, превосходя по распространенности другие пероксисомные болезни. По данным различных исследований, частота данного варианта лейкодистрофии варьируется от 1:100000 до 1:15000, патология затрагивает представителей всех возрастных групп (детей, подростков, взрослых). Обычно болеют лица мужского пола, женщины являются носителями мутантного гена, но при гетерозиготном генотипе в 20% случаев симптомы обнаруживаются и у них.
Причины адренолейкодистофии
Возникновение патологии связано с мутациями гена ABCD1, занимающего терминальный участок длинного плеча X-хромосомы (локус Xq28). Он кодирует синтез трансмембранного белка-переносчика, называемого адренолейкодистофическим протеином (ALDP). Последний находится на специфических клеточных органеллах, участвующих в реакциях окисления – пероксисомах, отвечая за транспортировку и дальнейшее расщепление очень длинноцепочечных жирных кислот (ОДЦЖК).
Структурный дефект пероксисомного транспортного белка делает его функционально неспособным, что ведет к накоплению в тканях токсических соединений. Уже идентифицировано более 2600 мутаций ABCD1, связанных с заменой нуклеотидов ДНК, потерей локусов, и многие из них вызывают структурные изменения ALDP. Адренолейкодистофии развиваются при наличии в генотипе лишь одного рецессивного гена (у мужчин-гемизигот) или двух его разновидностей (у женщин-гетерозигот).
Патогенез
Из-за структурной аномалии белка-переносчика страдает транспорт ОДЦЖК внутрь пероксисом, где они должны подвергаться β-окислению. В норме насыщенные жирные кислоты с длинной цепью присутствуют в липидах нервной ткани (цереброзидах, сульфатидах), эритроцитах, но при адренолейкодистрофии их содержание может возрастать в тысячу раз. Обычные эфиры холестерина заменяются аномальными с длиной цепи в 24–30 и более атомов углерода. Когда их концентрация в оболочке нервных волокон достигает 10%, миелин дестабилизируется и разрушается.
Накопление ацил-КоА-производных жирных кислот нарушает физико-химические свойства клеточных мембран: повышается проницаемость митохондрий, возрастает концентрация цитозольного кальция. В свою очередь, это приводит к атрофии нейроэндокринной ткани надпочечников. Важным механизмом демиелинизации считают активацию нейроглиальных структур, стимуляцию воспалительных процессов с участием цитокинов (фактора некроза опухолей).
Гистологические изменения при церебральных вариантах адренолейкодистофии характеризуются резким снижением содержания миелина, периваскулярной лимфоцитарно-макрофагальной инфильтрацией. В основном демиелинизирующий процесс начинается с мозолистого тела, постепенно переходя на белое вещество затылочно-теменных областей. Реже наблюдается вовлечение лобных долей, пирамидного тракта.
Классификация
Адренолейкодистофия характеризуется выраженным фенотипическим полиморфизмом, обусловленным различиями пенетрантности и экспрессивности аномального гена. Учитывая время дебюта, основные проявления, скорость нарастания симптоматики, в современной неврологии различают несколько форм заболевания:
Симптомы адренолейкодистрофии
Клиническая картина патологии очень вариабельна, что определяется конкретным фенотипическим вариантом. Клиницистам чаще всего приходится сталкиваться с признаками церебральной формы, адреномиелонейропатией, изолированной надпочечниковой недостаточностью.
Церебральная форма
Для всех разновидностей церебральной адренолейкодистрофии характерно быстрое прогрессирование. Пик манифестации детской формы приходится на период между 5 и 10 годами жизни. У большинства пациентов нервно-психические расстройства предшествуют признакам надпочечниковой недостаточности. Характерны расстройства поведения, мышления, двигательной сферы. Дети становятся гиперактивными или аутистичными, эпизодически проявляют агрессию. Возникает дефицит внимания, прогрессирующая деменция, нарушается походка.
Ювенильная адренолейкодистрофия манифестирует в возрасте 10–21 года. По симптоматике она напоминает детскую форму. У взрослых 30–50 лет патология начинается шизофреноподобным синдромом, нарастающей деменцией. Среди церебральных симптомов присутствуют дисфагия, зрительные нарушения (скотомы). Патология может быстро прогрессировать, но описывают и так называемые хронические варианты, когда процесс на многие годы приостанавливается, а после ремиссии наблюдается внезапное ухудшение с нарастанием неврологического дефицита.
Адреномиелонейропатия
Начинается заболевание в широком возрастном диапазоне – от 12 до 50 лет (чаще между вторым и четвертым десятилетиями жизни). Во многих случаях симптомы хронического гипокортицизма предшествуют или сопутствуют неврологическим расстройствам. Иногда самым первым признаком, возникающим задолго до развертывания всей клинической картины (еще в раннем детстве), становится изолированная гиперпигментация кожи.
Начальные неврологические признаки представлены миелопатией со снижением глубокой чувствительности, нижним парапарезом. Дальнейшее развитие такой адренолейкодистрофии проявляется тетрапарезом с нарушением функции тазовых органов (мочеиспускания, дефекации, эрекции). Со временем присоединяются психические расстройства (депрессия), гипогонадизм, алопеция. Патологическое состояние характеризуется медленным течением, но неуклонно прогрессирует.
Изолированная недостаточность надпочечников
Поражение коры надпочечных желез проявляется сначала глюкокортикоидной, а затем и минералокортикоидной недостаточностью, дебютирует в различные сроки, начиная с двухлетнего возраста. Наиболее частые симптомы представлены потерей аппетита, мышечной слабостью, рвотой. Пациенты теряют в весе, страдают от абдоминальных болей, гипотонии. Кожная гиперпигментация возникает не всегда. Неврологическое исследование указывает на снижение вибрационной чувствительности, гиперрефлексию, интеллектуальные расстройства, возникающие спустя несколько лет.
Симптоматическая адренолейкодистрофия
У некоторых женщин-носителей отмечается возникновение неврологических симптомов без сопутствующих эндокринных сдвигов. Заболевание дебютирует позже, чем у мужчин со спинальным поражением – к 50–60 годам. В тяжелых случаях симптоматика схожа с церебральной формой, умеренные нарушения напоминают адреномиелонейропатию. Наиболее часто выявляют сенсорную атаксию, умеренный спастический парапарез и боли в нижних конечностях, дисфункцию органов малого таза. Недостаточность коры надпочечников возникает редко.
Осложнения
Прогрессирование церебральных форм и адреномиелонейропатии сопровождается выраженным неврологическим дефицитом с инвалидностью. Опасным осложнением гипокортицизма является острая декомпенсация с развитием аддисонического криза, проявляющегося дегидратацией, сердечно-сосудистой, почечной недостаточностью. Быстропрогрессирующие варианты без активной коррекции заканчиваются коматозным состоянием и смертью.
Диагностика
Предположить заболевание удается при внимательной оценке анамнестической информации (наличия семейных случаев, времени манифестации, характера течения), клинических данных. Но этиопатогенетические особенности адренолейкодистрофии устанавливаются при комплексном лабораторно-инструментальном исследовании. Диагностическая программа включает следующие методы:
Дифференцировать заболевание врачу-неврологу приходится со многими состояниями. Церебральные нарушения требуют исключения других лейкодистрофий, рассеянного склероза, подострого склерозирующего энцефалита. Адреномиелонейропатию следует отличать от бокового амиотрофического склероза, фуникулярного миелоза, спинальных опухолей. Дифференцировать изолированный гипокортицизм необходимо с болезнью Аддисона, синдромом Оллгрова.
Лечение адренолейкодистрофии
Консервативная терапия
Выбор обоснованной патогенетической терапии – наиболее острая проблема, стоящая перед клиницистом при лечении конкретного пациента. Поскольку диагностировать заболевание можно еще до развития клинических признаков, особое значение приобретает пресимптоматическая коррекция. При проведении терапии адренолейкодистрофии задействуют консервативные методы:
Экспериментальное лечение
Несмотря на некоторые успехи, заболевание плохо поддается лечению. Но возрастающая активность исследователей в сфере молекулярной генетики и лучшее понимание патогенеза адренолейкодистрофии поддерживают попытки разработать новые эффективные методы коррекции. Среди них особого внимания заслуживают следующие:
Прогноз и профилактика
Долгосрочный прогноз при Х-сцепленной адренолейкодистрофии зависит от конкретного фенотипа. У детей церебральная форма принимает особо тяжелое, быстропрогрессирующее течение с пятилетней выживаемостью на уровне 59%, многие умирают в течение нескольких лет после дебюта болезни. Другие формы могут не влиять на продолжительность жизни, но снижать ее качество за счет потери трудоспособности. Учитывая высокую степень полиморфизма, даже у членов одной семьи прогноз может существенно варьироваться.
Мероприятия первичной профилактики при адренолейкодистрофии предполагают медико-генетическое консультирование вероятных носителей, пренатальную диагностику (биопсию ворсин хориона, анализ амниотической жидкости). Раннее выявление биохимических изменений в крови важно для подтверждения диагноза на доклинических стадиях. В сочетании с активной патогенетической терапией, это поможет избежать прогрессирования, снижая риск дальнейшей инвалидизации.
Диагноз алд что такое
Надпочечниковая недостаточность (НН; недостаточность коры надпочечников, гипокортицизм) – клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечников в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы (ГГНС).
Согласно исходной локализации патологического процесса, НН подразделяют на первичную (поражение самой коры надпочечников; 1-НН) и центральные формы: вторичную, являющуюся результатом нарушения секреции адренокортикотропного гормона (АКТГ), и третичную, развивающуюся при дефиците кортикотропин-рилизинг гормона (КРГ). Вторичную и третичную НН объединяют в центральные формы в связи со сложностью их дифференциальной диагностики в клинической практике. Нередко и та, и другая обозначаются как вторичная НН (2-НН).
I. Первичная НН (1-НН)
1. Аутоиммунная деструкция коры надпочечников:
1.1 Изолированная 1-НН аутоиммунного генеза;
1.2 1-НН в рамках аутоиммунных полигландулярных синдромов (АПС).
2. Туберкулезное поражение надпочечников.
4. Метастатическое поражение коры надпочечников.
5. Поражение надпочечников при диссеминированных грибковых инфекциях.
6. ВИЧ-ассоциированный комплекс.
7. Ятрогенная 1-НН (двусторонняя адреналэктомия по поводу болезни Иценко-Кушинга, двустороннее кровоизлияние в надпочечники на фоне терапии антикоагулянтами).
II. Центральные формы НН (гипоталамо-гипофизарные заболевания: пангипопитуитаризм, опухоли гипофиза, оперативные вмешательства на гипофизе и проч.).
1-НН является относительно редким заболеванием – регистрируется от 40–60 до 100–110 новых случаев на 1 млн взрослых в год. Истинная частота центральных форм НН не известна, но ее наиболее частой причиной бывает подавление ГГНС на фоне хронической терапии глюкокортикоидами. В связи с тем, что в клинической практике наиболее часто встречается 1-НН (более 95 %), мы уделим основное внимание рассмотрению различных аспектов этого вида гипокортицизма. Клиническая картина заболевания, связанного с деструкцией надпочечников патологическим процессом, впервые и достаточно полно была описана в 1855 г. английским врачом Томасом Аддисоном (1793–1860). С тех пор 1-НН туберкулезной и аутоиммунной этиологии обозначается как болезнь Аддисона.
Этиология первичного гипокортицизма
Аутоиммунная деструкция коры надпочечников в настоящее время рассматривается в качестве основной причины 1-НН. В работах начала 1990 гг. было показано, что специфическими иммунологическими маркерами аутоиммунной деструкции коры надпочечников являются антитела к ферментам надпочечникового стероидогенеза: 21-гидроксилазе (P450c21), 17a-гидроксилазе (P450c17) и ферменту отщепления боковой цепи (P450scc).
Важным аспектом этиологии 1-НН считаются АПС. Под ними подразумевают первичное поражение аутоиммунным процессом двух и более периферических эндокринных желез, приводящее, как правило, к их недостаточности и зачастую сочетающееся с различными органоспецифическими неэндокринными заболеваниями аутоиммунного генеза. Аутоиммунный полигландулярный синдром 2 типа (АПС-2) – наиболее распространенный, но менее изученный вариант АПС. Его самым частым вариантом является синдром Шмидта, представляющий собой сочетание 1-НН и аутоиммунных тиреопатий (аутоиммуный тиреоидит или болезнь Грейвса). Реже встречается сочетание 1-НН с сахарным диабетом 1 типа (синдром Карпентера).
Аутоиммунный полигландулярный синдром 1 типа (АПС-1; APECED-Autoimmune polyendocrinopathy-candidiasis-ectodermal-dystrophy, MEDAC-Multiple Endocrine Deficiency Autoimmune Candidiasis, кандидо-полиэндокринный синдром) – редкое заболевание с аутосомно-рецессивным типом наследования или еще реже встречающееся спорадически, для которого характерна классическая триада, описанная Уайткером: слизисто-кожный кандидоз, гипопаратиреоз, 1-НН.
Деструкция коркового вещества надпочечников в результате туберкулезного процесса занимает второе место в ряду этиологических факторов 1-НН. Туберкулез надпочечников развивается вследствие гематогенного распространения микобактерий. Обычно в процесс вовлекается как корковое, так и мозговое вещество.
Адренолейкодистрофия (АЛД, болезнь Зимерлинга-Крейтцфельдта, меланодермическая лейкодистрофия) – наиболее распространенное врожденное пероксисомное заболевание с
Х-сцепленным рецессивным типом наследования, которое характеризуется избыточным накоплением предельных длинноцепочечных жирных кислот, в основном в миелине, и проявляется преимущественным поражением белого вещества ЦНС, коры надпочечников и яичек. Выделяется несколько клинических фенотипов АЛД – от тяжелой детской церебральной формы до бессимптомного течения. При адреномиелонейропатии (35 % случаев АЛД), которая, как правило, манифестирует в 3–4 десятилетии жизни, НН на фоне прогрессирующей неврологической симптоматики (спастический парапарез ног, нарушение вибрационной чувствительности, нарушение деятельности сфинктеров) развивается примерно у 2/3 пациентов. В 10–20 % случаев АЛД единственным проявлением заболевания оказывается НН без каких-либо признаков неврологической дисфункции.
Патогенез и клинические проявления надпочечниковой недостаточности
В основе 1-НН лежит абсолютный дефицит кортикостероидов. Недостаток альдостерона приводит к потере натрия и воды через почки и желудочно-кишечный тракт с развитием дегидратации, гиповолемии, гипотонии, а также прогрессирующей гиперкалиемии. Дефицит кортизола – основного адаптогенного гормона человеческого организма – становится причиной снижения сопротивляемости по отношению к различным эндо- и экзогенным стрессорам, на фоне которых (чаще всего на фоне инфекций) и происходит декомпенсация НН.
Клиническая картина 1-НН была достаточно полно описана Томасом Аддисоном. За последние 150 лет к этому описанию добавились лишь незначительные дополнения.
Заболевание обычно манифестирует в возрасте 20–50 лет. Гиперпигментация кожи и слизистых – наиболее известный и типичный симптом болезни Аддисона. Она патогенетически обусловлена тем, что при 1-НН происходит гиперсекреция не только АКТГ, но и его предшественника – пропиомеланокортина (ПОМК), из которого помимо АКТГ в избытке образуется меланоцитстимулирующий гормон.
Гиперпигментация наиболее заметна на открытых частях тела (лицо, руки, шея), местах трения (кожные складки, места соприкосновения с одеждой) и естественного скопления меланина, а также на слизистых (полость рта, десны, слизистая щек на уровне зубов, места трения зубных протезов).
Похудение – еще один типичный симптом НН, прогрессирующее увеличение массы тела пациента практически исключает этот диагноз. Потеря массы тела, как правило, бывает значительной, достигая 5–20 кг. Общая и мышечная слабость в начале заболевания может быть выражена умеренно (снижение работоспособности) и достигает значительной степени при декомпенсации заболевания (вплоть до адинамии).
Кардинальный симптом 1-НН – артериальная гипотензия. Выраженная систолическая и диастолическая гипертензия в большинстве случаев позволяет исключить диагноз. Диспепсические расстройства той или иной выраженности при 1-НН наблюдаются практически всегда. Чаще – это плохой аппетит и тошнота; периодически возникают разлитые боли в животе; реже – рвота, расстройство стула. Характерный симптом 1-НН, патогенетически связанный с выраженной потерей натрия, – пристрастие к соленой пище.
Ни один из перечисленных симптомов 1-НН, взятый отдельно, не является специфичным для этого заболевания — диагностическое значение имеет только их сочетание.
Особенности клинической картины вторичного гипокортицизма (2-НН)
Важнейшее патогенетическое отличие 2-НН – отсутствие дефицита альдостерона. Дефицит АКТГ приводит в данном случае к недостаточности кортизола и андрогенов, но не затрагивает практически независимую от аденогипофизарных влияний продукцию альдостерона, секреция которого регулируется системой ренин-ангиотензин-натрий-калий. В этой связи симптоматика 2-НН достаточно бедна. Не выражены такие симптомы, как артериальная гипотензия, диспепсические расстройства, пристрастие к соленой пище. Важным отличием 2-НН от 1-НН является отсутствие гиперпигментации кожи и слизистых оболочек. На первый план в клинической картине
2-НН выступают общая слабость, похудение, реже – гипогликемические эпизоды. Облегчает диагностику наличие анамнестических или клинических данных о гипофизарной патологии, операциях на гипофизе, длительном приеме кортикостероидов.
Наиболее частой причиной острого гипокортицизма является декомпенсация или острая манифестация хронических форм НН, этиология которой рассмотрена выше. Таким образом, при остром гипокортицизме практически всегда имеет место выраженная симптоматика, характерная для хронической НН. Реже речь идет о геморрагическом инфаркте надпочечников, в основе патогенеза которого лежит ДВС-синдром при септических состояниях (синдром Уотерхауса-Фридериксена) и различных коагулопатиях. В патогенезе острого гипокортицизма основную роль играют циркуляторная недостаточность и дегидратация. Выделяют три основные формы острой НН.
Такие исследования, как определение экскреции 17-оксикортикостреоидов (17-ОКС), 11-оксикортикостероидов (11-ОКС) и 17-кетостероидов (17-КС), считаются малоинформативными и не должны использоваться ни для диагностики НН, ни в клинической медицине в целом. Определение уровня кортизола крови имеет ограниченное диагностическое значение, поскольку у многих больных НН он оказывается на нижней границе нормы. Тем не менее выраженное снижение этого показателя – уровень кортизола Заместительная терапия минералокортикоидами. Надпочечники имеют две жизненно важные функции – поддержание водно-солевого баланса и адаптация организма к стрессорным воздействиям внешней среды. При нарушении первой из них, которую обеспечивают минералокортикоиды, организм погибает в результате обезвоживания (потеря натрия и воды) и нарастающей гиперкалиемии. В то же время, дефицит глюкокортикоидов без стрессорных воздействий в принципе может и не сказаться. Тем не менее, типичной ошибкой при проведении заместительной терапии хронической 1-НН является назначение монотерапии глюкортикоидами, в лучшем случае кортизоном, но чаще всего преднизолоном. В этой ситуации, несмотря на возрастающую дозу препарата, состояние больных не нормализуется, а доза препарата продолжает увеличиваться, что приводит в ряде случаев к развитию экзогенного синдрома Кушинга.
Современная заместительная терапия 1-НН минералокортикоидами подразумевает использование только одного препарата – 9альфа-фторкортизола (флудрокортизон, Кортинефф). Кортинефф назначается один раз в сутки в дозе 0,05–0,1 мг (как правило, ежедневно утром). В клинической практике рекомендуется использовать следующие критерии адекватности терапии 9альфа-фторкортизолом:
Основные преимущества Кортинеффа по сравнению с другими препаратами, обладающими минералокортикоидными эффектами, заключаются в эффективности при пероральном применении, а также в мощном сользадерживающем эффекте, сопоставимом с таковым альдостерона. Период полувыведения Кортинеффа составляет 18–36 часов, что позволяет имитировать практически не имеющую циркадного ритма секрецию альдостерона ежедневным однократным приемом 0,05–0,2 мг препарата. Глюкокортикоидными эффектами Кортинеффа на практике можно пренебречь, поскольку заметными они становятся, если доза препарата превышает 0,5 мг/сут.
После начала терапии Кортинеффом у некоторых пациентов развиваются легкая преходящая отечность и склонность к задержке жидкости. Эти явления не следует воспринимать как основания для отмены препарата. Спустя несколько дней (максимум неделю) они обычно саморазрешаются. Дозу Кортинеффа иногда приходится повышать летом (особенно в условиях жаркого климата) в связи с увеличением потерь натрия и воды с потом.
Следует иметь в виду некоторые особенности заместительной терапии Кортинеффом во время беременности, при которой происходит постепенное и значительное увеличение уровня прогестерона, являющегося, подобно спиронолактону, антагонистом минералокортикоидов. Поэтому во время беременности доза Кортинеффа может значительно возрастать. Подбор дозы должен осуществляться по уровню калия плазмы и артериальному давлению. Описаны случаи, когда в соответствии с перечисленными критериями дозу Кортинеффа приходилось увеличивать до 0,3 и даже до 0,6 мг в день.
Наряду с НН Кортинефф, благодаря мощным минералокортикоидным и сользадерживающим свойствам, используется в лечении идиопатической гипотонической болезни и ортостатической артериальной гипотонии.
Заместительная терапия глюкокортикоидами. В арсенале врача имеется большое число глюкокортикоидных препаратов, которые можно использовать для заместительной терапии НН. Последнюю можно проводить, используя следующие схемы:
Во всем мире для заместительной терапии НН наиболее часто используется таблетированный гидрокортизон. Отрицательным свойством синтетических препаратов является их относительно узкий терапевтический диапазон. Препаратом выбора у детей и подростков считается именно гидрокортизон, поскольку на фоне терапии синтетическими препаратами в ряде исследований была отмечена задержка роста детей с НН. В этой связи при использовании синтетических глюкокортикоидов можно предполагать большую частоту развития синдрома остеопении, чем при терапии гидрокортизоном.
С другой стороны, при терапии гидрокортизоном и кортизона ацетатом определенные сложности создает относительно короткий период их действия. При классическом двухразовом приеме указанных препаратов достаточно типичны жалобы пациентов на слабость в вечерние часы и рано утром до их приема. Можно выделить следующие критерии адекватности глюкокортикоидного компонента заместительной терапии НН:
Надежные объективные (лабораторные) критерии адекватности заместительной терапии НН глюкокортикодиами на сегодняшний день отсутствуют, и подбор терапии базируется практически исключительно на данных клинической картины и опыте врача.