диаграммы состояния двухкомпонентных систем строят в таких координатах
Двухкомпонентные диаграммы состояния жидкость-твердое
Краткие теоретические сведения
Общая информация

где S – число степеней свободы; K – число компонентов; F – количество фаз.
Диаграммы состояния конденсированных систем обычно изображаются в изобарических координатах. По оси абсцисс указан состав системы в мольных или массовых долях (процентах) по компоненту В. По осям ординат указана шкала температур. По линиям А и В показаны температурные точки, характерные для чистых веществ: температуры плавления и полиморфных превращений.
Порядок рассмотрения диаграммы
1. Перечертить диаграмму, соблюдая топологию, в заданном масштабе.
2. Дать общую характеристику диаграммы. При наличии химических соединений вывести их формулу.
3. Отметить линию ликвидуса, линию солидуса, линии растворимости компонентов; написать равновесия на линиях. Составить равновесия на линиях эвтектики и перитектики.
4. Обозначить поля диаграммы греческими или римскими цифрами.
5. Указать фазовый состав полей диаграммы. Начинать следует с определения полей, содержащих одну фазу. Поля, содержащие две фазы находятся обычно между однофазными элементами диаграммы.
6. Описать значимые точки диаграммы (точки плавления компонентов, точки эвтектик, точки перитектик, точки полиморфных превращений и др.): указать температуру, состав, уравнение равновесия.
7. Рассмотреть свойства систем, заданных соответствующими фигуративными точками и заполнить таблицу
Исходный состав, % В
Состав каждой фазы, % В
Относительное кол-во фаз, %
Число степеней свободы
Типовые диаграммы состояния
Рис. 16. Диаграмма состояния двухкомпонентной системы с одной точкой эвтектики.
Общая характеристика диаграммы. Есть: неограниченная растворимость компонентов в жидкой фазе. Нет: химических соединений, твердых растворов, полиморфных превращений.
Рис. 17. Диаграмма с полиморфным превращением компонента В
Наличие полиморфного превращения обозначается горизонтальной линией (V-Ttr,B). Начало линии идет от того вещества, которое меняет кристаллическую решетку (от вещества В). Выше линии превращения – одна кристаллическая модификация, ниже – другая.
Рис. 18. Диаграмма с ограниченной растворимостью жидкостей
Наличие области ограниченной растворимости жидкостей и их расслаивания на две фазы обозначают пунктирной линией, расположенной выше ликвидуса. Изотерма (WN) показывает начало расслаивания при нагревании системы. Точка Алекссева (С) показывает условия, при которых существует одна жидкая фаза.
Рис. 19. Диаграммы состояния с твердыми растворами замещения.
Диаграммы просты. Состоят из линий ликвидуса и солидуса. Могут иметь экстремальные точки, а могут и не иметь.
Рис. 20. Диаграммы с твердыми растворами внедрения.
Рис. 21. Диаграмма с химическим соединением постоянного состава, которое плавится без разложения (конгруэнтно).
Рис. 22. Диаграмма с дальтонидом, который плавится без разложения
Рис. 23. Химическое соединение постоянного состава, которое плавится с разложением.
Рис. 24. Химическое соединение переменного состава, которое плавится с разложением. Обозначается на диаграммах как область состава δ, ограниченная линией перитектики.
Примеры решения задач
Пример 11. Прочесть диаграмму состояния системы «медь – магний».
Рис. 16. Диаграмма состояния медь-магний.
Решение. 1. Дать общую характеристику диаграммы состояния.
Температура плавления (кристаллизации) чистой меди ТСu = 1083°С, а магния TMg = 650°С. В расплавленном состоянии эти металлы неограниченно растворимы и образуют одну жидкую фазу. Магний кристаллизуется из двухкомпонентного расплава в чистом виде, а медь – в виде твердого раствора α, область существования которого ограничена пределами от 0 до 5 % Mg и в котором «хозяином» кристаллической решетки является медь. Кристаллические модификации компонентов не меняются.
Медь и магний образуют два химических соединения, плавящиеся без разложения (конгруэнтно). Первое из них содержит от 30 до 37 % магния, плавится при температуре 819°С. Второе химическое соединение S2 плавится при 568°С, имеет постоянный стехиометрический состав, содержит 65 % Mg.
Вывод формул химических соединений. Точке плавления соединения S1 (δ) отвечает мольная доля магния 34 %. Допускают, что количество вещества химического соединения один моль, тогда 
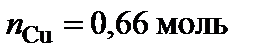

Точке плавления соединения S2 отвечает мольная доля магния 66 %. Допускают, что 



Рис. 17. Решение примера 1.
2. Пронумеровать поля диаграммы и дать их наименование.
I – расплав (Ж); II – Ж + α; III – твердый раствор внедрения магния в меди (α); IV – α + δ; V – δ + Ж; VI – δ; VII – δ + Ж; VIII – δ + S2; IX – Ж + S2; X – Ж + S2; XI – Ж + Mg; XII – Mg + S2.
Фазовые диаграммы состояния двухкомпонентных систем
Димитровградский инженерно-технологический институт – филиал НИЯУ МИФИ
Диаграммы состояния двухкомпонентных систем
к лабораторной работе по курсу физической химии
Составитель: доц., к.т.н. Цимбалюк Е.П.
1. Цель работы:освоить термический анализ: снять кривые охлаждения чистых компонентов и бинарных смесей различного состава; на основании кривых охлаждения построить диаграмму плавкости и анализировать ее.
Теоретическая часть
Основные понятия и определения
Анализ диаграмм плавкости осуществляется с помощью правила фаз Гиббса, которое опирается на понятия “фаза, компонент, степень свободы”.
Правило фаз основано на втором законе термодинамики и относится к системам, находящимся в состоянии термодинамического равновесия.
Фазой называется гомогенная часть гетерогенной системы, отделенная от других частей поверхностью раздела, на которой скачком изменяются какие-либо свойства.
Число степеней свободы–число независимых переменных (температура, давление, концентрация), которые можно изменять в некоторых пределах так, чтобы число и природа фаз оставались прежними. Если число степеней свободы равно нулю (инвариантная система), то нельзя изменять внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызывало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных параметров, и это не вызовет уменьшения или увеличения числа фаз.
Правило фаз Гиббса
Является законом фазового равновесия. Оно представляет собой математическое выражение условий равновесия системы, то есть показывает количественную зависимость между числом степеней свободы системы (С), числом независимых компонентов (К) и числом фаз (Ф). Если на равновесие в системе влияет n внешних факторов, то правило фаз Гиббса запишется следующим образом:
Из уравнения (1) следует, что число степеней свободы (С) возрастает с увеличением числа независимых компонентов (К) и уменьшается при росте числа фаз (Ф). Для однокомпонентной (К = 1) системы при изменении двух внешних факторов температуры и давления (n = 2), максимальное количество фаз равно трем (твердая, жидкая и газообразная).
Правило фаз Гиббса для однокомпонентной системы: в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только температура и давление, число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два.
Фазовые диаграммы состояния двухкомпонентных систем
К основным типам диаграмм состояния двухкомпонентных конденсированных систем относятся:
· диаграмма с простой эвтектикой;
· диаграмма с образованием устойчивого химического соединения (конгруэнтно плавящегося);
· диаграмма с образованием неустойчивого химического соединения (инконгруэнтно плавящегося);
· диаграмма с неограниченной взаимной растворимостью компонентов в твердом состоянии;
· диаграмма с ограниченной растворимостью компонентов в твердом состоянии (I и II вида);
· диаграмма с ограниченной взаимной растворимостью компонентов в жидком состоянии.
Для таких систем при р = const, правило фаз Гиббса имеет вид:
2.3.1. Диаграмма состояния системы с эвтектикой
Является наиболее простой диаграммой состояния, в которой компоненты неограниченного смешиваются друг с другом в жидком состоянии. Однако совершенно не смешиваются в твердом состоянии, химически не взаимодействуют друг с другом и не образуют твердых растворов.
Диаграмма состояния системы с простой эвтектикой для компонентов А и В схематически представлена на рис.1.
Рис.1. Диаграмма состояния с эвтектикой
ТАЕ – линия ликвидуса (каждая точка на линии показывает состав расплава, который находится в равновесии с кристаллами А);
ТВЕ – линия ликвидуса (в равновесии с кристаллами В);
FEG – линия солидуса (линия эвтектики);
Рассмотрим процесс охлаждения расплава, заданного точкой М.
| Точка | Что происходит | Ф | С | Что означает число степеней свободы |
| М | Охлаждение расплава | Можно менять температуру и состав расплава | ||
| а | Появляются первые кристаллы компонента А | Можно менять только температуру | ||
| b | Продолжают выпадать кристаллы компонента А, состав расплава b1, состав твердой фазы b2 | Можно менять или температуру или состав расплава | ||
| d | Одновременно кристаллизуются компоненты А и В, на кривой охлаждения участок d—d’ | Система инвариантна | ||
| e | Охлаждение механической смеси компонента А состава е2 и компонента В состава е1 | Можно менять только температуру |
Соотношение между количеством твердой и жидкой фаз определяется по правилу рычага. Например, смесь в точке b соответствует начальному составу 40% А и 60% В, то при температуре Та она представляет собой гетерогенную систему из кристаллов вещества А и жидкой фазы. Для определения состава этих фаз проводят горизонталь b2b1 через точку b до пересечения с границами области (длина рычага). Определить количество кристаллической фазы и жидкого расплава можно по соотношению:
2.3.2. Фазовая диаграмма с конгруэнтно плавящимся химическим соединением
Если компоненты А и В образуют одно устойчивое химическое соединение состава АхВy, плавящееся без разложения, то на диаграмме состояния кривая ликвидуса образует максимум в точке Д (рис.2). В этой точке состав кристаллической фазы совпадает с составом жидкой фазы. В случае, если максимум на диаграмме имеет острую форму, химическое соединение АхВy устойчиво при плавлении; если максимум «пологий», то химическое соединение частично диссоциирует при плавлении.
Как видно из рис.2, фазовая диаграмма представляет собой как бы две диаграммы с простой эвтектикой: А-АВ и В-ВА. Можно разделить такую диаграмму на две части по вертикали, соответствующей химическому соединению, и рассматривать каждую часть диаграммы отдельно.
Рис.2. Диаграмма состояния системы с образованием химического соединения, плавящимся без разложения (конгруэнтно)
Состав химического соединения АхВy в точке Д можно определить, зная состав соединения в молекулярных или массовых процентах.
А).Состав компонентов А и В выражен в мольных процентах:

Б).Состав компонентов А и В выражен в массовых процентах:
| Точка | Что происходит | Ф | С | Что означает число степеней свободы |
| М1 | Охлаждение расплава | Можно менять только температуру | ||
| Д | Появляются первые кристаллы компонента АхВy | Система инвариантна | ||
| F | Охлаждается твердая фаза химического соединения АхВy | Можно менять только температуру |
Рассмотрим процесс охлаждения расплава, заданного точкой М2.
| М2 | Охлаждение расплава | Можно менять температуру и состав расплава |
| а | Появляются первые кристаллы компонента АхВy | Можно менять только температуру |
| b | Кристаллизуются компонент А и химическое соединение АхВy | Система инвариантна |
| с | Охлаждение механической смеси А и АхВy | Можно менять только температуру |
2.3.3. Фазовая диаграмма с инконгруэнтно плавящимся химическим соединением
Диаграмма, когда компоненты А и В могут образовывать химическое соединение АхВy, плавящееся с разложением, т.е. инконгруэнтно, приведена на рис.3.
Рис.3. Диаграмма состояния системы с образованием химического соединения, плавящимся с разложением (инконгруэнтно)
Инконгруэнтно плавящееся химическое соединение АхВy устойчиво только ниже температуры Тc. При повышении температуры выше Тc химическое соединение распадается на две фазы: кристаллы компонента В и расплав состава y (точка С). На перитектической прямой СДТc в равновесии находятся три фазы:
— расплав состава точки С ( CL );
— кристаллы АхВy состава точки Д;
— кристаллы компонента В.
Точка С называется точкой перитектики, температура Тс — температурой перитектики. В точке перитектики, так же как и в точке эвтектики, в равновесии находятся расплав и две твердые фазы. Однако процессы при охлаждении существенно различаются: в точке эвтектики одновременно кристаллизуются две твердые фазы, а в точке перитектики – одна твердая фаза кристаллизуется, а другая растворяется. На кривой охлаждения при Тс наблюдается горизонтальный участок b—b’.
Рассмотрим процесс охлаждения расплава, заданного точкой М.
18 Диаграммы состояния двухкомпонентных сплавов
1.1. Диаграммы состояния двухкомпонентных сплавов
Диаграмма состояния представляет собой графическое изображение фазового состояния сплавов и критических точек в зависимости от температуры и концентрации в условиях равновесия.
Для того чтобы обеспечить равновесное состояние системы, охлаждение сплава из жидкого состояния осуществляют очень медленно. Равновесными считаются такие условия, при которых процессы, протекающие в системе, являются обратимыми. В данном случае – процессы, происходящие при охлаждении сплава, должны в точности совпадать с процессами, протекающими при его нагреве.
Диаграмму состояния строят в координатах температура – концентрация (рис. 3.4). Для сплавов, состоящих из двух компонентов А и В, состав характеризуется отрезком прямой, принятым за 100 %. Крайние точки А и В соответствуют 100 % чистых компонентов. Любая точка на этом отрезке характеризует состав двойного сплава. Так, например, точка С соответствует сплаву, состоящему из 20 % В и 80 % А; точка D – 60 % В и 40 % А.
Для построения диаграммы состояния из компонентов изготовляют серию сплавов различного состава и для каждого из них строят кривую охлаждения по результатам термического анализа в координатах температура – время (так же, как для металлов). Особенности поликристаллического строения сплавов в твердом состоянии изучаются с помощью оптического микроскопа обычно при 100–1000-кратном увеличении. Атомная структура сплавов и параметры кристаллических решеток определяются методом рентгеноструктурного анализа.
Рис. 3.4. Координаты для изображения диаграммы состояния двухкомпонентной системы
В зависимости от характера строения двухкомпонентных сплавов (в жидком состоянии оба компонента неограниченно растворяются друг в друге, образуя однородный жидкий раствор) различают следующие основные типы диаграмм состояния:
1) при образовании компонентами механической смеси;
Рекомендуемые файлы
2) при неограниченной растворимости компонентов в твердом состоянии;
3) при ограниченной растворимости компонентов в твердом состоянии;
4) при образовании компонентами химического соединения.
Диаграмма состояния сплавов из компонентов,
образующих в твердом состоянии механическую смесь
Экспериментально установлено, что при совместной кристаллизации сплавов, компоненты которых не растворяются друг в друге в твердом состоянии, температура начала кристаллизации всегда ниже, чем у исходных компонентов. Температура же окончания процесса перехода в твердое состояние одинакова для сплавов любого состава двухкомпонентной системы.
На рис. 3.5 приведена диаграмма состояния сплава с компонентами А и В. Выше линии КСN все сплавы двухкомпонентной системы представляют собой однофазный жидкий сплав (ж. с.). Эта линия называется линией ликвидуса (с греч. – жидкий), линия DСЕ – линией солидуса (с греч. – твердый). Ниже линии DСЕ все сплавы находятся в твердом состоянии. Сплав, соответствующий точке С, называется эвтектическим (эвтектикой).
Эвтектикой, таким образом, называется механическая смесь кристаллов двух (или более) твердых веществ, одновременно закристаллизовавшихся из жидкого сплава при температуре ниже температуры плавления отдельных компонентов или любых других их смесей. Это определение относится к твердой эвтектике. Жидкой эвтектикой называется жидкий расплав (раствор), из которого возможна такая кристаллизация.
В отличие от эвтектики, эвтектоид – аналогичная ей составляющая металлических сплавов, – образуется не из жидкой, а из твердой фазы. Эвтектоид, по сравнению с эвтектикой, имеет более тонкое дисперсное строение из двух или более фаз.
Рис. 3.5. Диаграмма состояния сплавов, образующих в твердом состоянии механическую смесь компонентов А и В
Эвтектический сплав данной системы имеет строго определенное процентное соотношение компонентов А и В. Сплавы, расположенные слева от эвтектики, называются доэвтектическими, а справа – заэвтектическими.
В доэвтектических сплавах сначала при охлаждении ниже линии ликвидуса КС выделяются кристаллы компонента А, а в заэвтектических – ниже линии СN – кристаллы компонента В.
После затвердевания, т.е. ниже линии солидуса DСЕ, доэвтектические сплавы состоят из кристаллов А и эвтектики, а заэвтектические – из кристаллов В и эвтектики.
Диаграмма состояния сплавов с неограниченной
растворимостью компонентов в твердом состоянии
Рассмотрим построение диаграммы состояния для сплавов с неограниченной растворимостью в твердом состоянии. Например, экспериментально получены кривые охлаждения компонентов А и В и сплавов I (70 % А и 30 % В), II (50 % А и 50 % В) и III (20 % А и 80 % В) (рис. 3.6, а).Кристаллизация компонента А начинается и заканчивается при постоянной температуре tA. Аналогично происходит кристаллизация компонента В при температуре tB. Кристаллизация сплавов I, II и III происходит в интервале температур. Кристаллизация сплава I начинается при температуре t1 и заканчивается при температуре t2 с образованием твердого раствора a. Аналогично происходит кристаллизация и двух других сплавов – при температуре t3 начинается и при температуре t4 заканчивается затвердевание сплава II, а сплава III – при температурах t5 и t6. Разница только в интервале температур начала и конца кристаллизации.
Если на оси абсцисс сетки в координатах температура – концентрация (рис. 3.6, б) отметить точками исследованные сплавы и в каждой из этих точек восстановить перпендикуляры, т.е. провести линии сплавов, затем на эти линии, а также на левую и правую ординаты температур, соответствующие компонентам А (левая) и В (правая), перенести найденные критические точки от tA до tB и одноименные (имеющие одинаковый физический смысл) критические точки соединить плавными кривыми, то получится диаграмма состояния сплавов А и В с неограниченной растворимостью в твердом состоянии (рис. 3.6, б).
Рис. 3.6. Построение диаграммы состояния сплавов для случая неограниченной растворимости компонентов А и В в твердом состоянии [7]:
а – кривые охлаждения; б – диаграмма состояния
На этой диаграмме кривая tAt1t3t5tB – кривая начала затвердевания сплавов – линия ликвидуса, а кривая tAt2t4t6tB – кривая конца затвердевания – линия солидуса.
Рассмотрим процесс кристаллизации какого-либо сплава, например сплава I состава 50 % компонента А и 50 % компонента В по этой диаграмме при очень медленном охлаждении, т.е. полностью в равновесных условиях (рис. 3.7). При температуре tл начинается кристаллизация и образуются первые кристаллы. На любой диаграмме состояния состав твердой части сплава (состав кристаллов, которые могут находиться в равновесии с жидкостью) при данной температуре показывает линия солидуса. Следовательно, первые образовавшиеся кристаллы имеют состав точки М. При дальнейшем охлаждении, когда сплав достигает, например, температуры t1, в равновесии с жидкостью уже находятся только кристаллы состава точки Л.
Рис. 3.7. Диаграмма состояния сплавов для случая неограниченной растворимости компонентов А и В в твердом состоянии
Рассмотрим, каким образом ранее образовавшиеся кристаллы состава точки М превращаются в кристаллы состава точки Л. В кристаллах состава М больше компонента В, чем в кристаллах состава Л; следовательно, кристаллы состава М обогащаются компонентом А. Этот процесс происходит за счет диффузии атомов компонента А в уже имеющиеся, т.е. возникшие до этой температуры, кристаллы. При достаточной выдержке или медленном охлаждении при t1 устанавливается равновесие кристаллов точки Л и жидкого сплава. Но в кристаллах состава точки Л компонента В больше, чем в сплаве; следовательно, жидкая часть сплава беднее компонентом В. При этой температуре состав жидкой части сплава определяется линией ликвидуса, т.е. точкой N. При дальнейшем охлаждении, когда сплав достигает температуры t2 и устанавливается равновесие, сплав состоит из кристаллов состава точки К и жидкой части сплава состава точки Р. При достижении температуры tc сплав полностью затвердевает и состоит из однородных кристаллов твердого раствора (состава 50 % А и 50 % В).
В реальных условиях ускоренного охлаждения состав кристаллов не получается однородным в связи с тем, что скорость кристаллизации больше скорости диффузии.
Диаграмма состояния сплавов с ограниченной растворимостью
компонентов в твердом состоянии
Один из видов такой диаграммы состояния показан на рис. 3.8. Число фаз в данной системе три – жидкий раствор, твердый раствор компонента В в компоненте А (обозначим его a) и твердый раствор компонента А в компоненте В (обозначим его b) [7].
Рис. 3.8. Диаграмма состояния сплавов для случая ограниченной
растворимости компонентов А и В в твердом состоянии
На этой диаграмме линия КСD – линия ликвидуса, линия KECFD – линия солидуса. По линии ликвидуса КС из жидкого сплава выделяются кристаллы a, а по линии CD – кристаллы b. На линии солидуса КЕ сплавы затвердевают с образованием кристаллов a, на линии DF – кристаллов b. На линии солидуса ECF происходит одновременная кристаллизация a- и b-фаз с образованием эвтектики.
Сплав состава точки С после затвердевания состоит только из одной эвтектики a+b. Аналогично ранее рассмотренному случаю сплавы, по своему составу находящиеся левее эвтектической точки С (на линии ЕС), после затвердевания имеют структуру a+эвтектика (a+b) и являются доэвтектическими. Сплавы, по своему составу лежащие правее точки С (на линии СF), после затвердевания имеют структуру b+эвтектика (a+b) и являются заэвтектическими.
Линия ЕS показывает ограниченную растворимость в твердом состоянии компонента В в компоненте А, уменьшающуюся с понижением температуры, а линия FM – растворимость компонента А в В, не изменяющуюся с понижением температуры.
Точка Е характеризует предельную растворимость компонента В в компоненте А, а точка F – A в В. Если кристаллизуются сплавы, состав которых находится левее точки S (или правее точки М), то при любой температуре в твердом состоянии все количество компонентов В (или А) находится в твердом растворе и структура таких сплавов состоит из зерен a (или b). В сплавах, состав которых находится между точками S и Е’, т.е. за пределом растворимости В в А, образовавшиеся при затвердевании кристаллы a при понижении температуры ниже линии ES пересыщены компонентом В, и поэтому происходит выделение из них избыточных кристаллов, которыми являются кристаллы b концентрации точки М, называемые вторичными (b11). После полного охлаждения эти сплавы имеют структуру, состоящую из кристаллов a состава точки S и кристаллов b11 – a + b11. В сплавах состава линии EC, имеющих после затвердевания структуру a + эвтектика (a+b), из кристаллов a тоже выделяются кристаллы b, и после полного охлаждения будет структура a + эвтектика (a+b)+b11.
Процесс выделения вторичных кристаллов из твердого раствора называется вторичной кристаллизацией, в отличие от образования кристаллов в жидком сплаве (первичная кристаллизация).
Диаграмма состояния сплавов с образованием компонентами
химического соединения
Химическое соединение обозначают АmBn. Это означает, что в данном соединении на m атомов компонента А приходится n атомов компонента В. Диаграмма состояния сплавов для случая образования между компонентами химического соединения, состав которого при нагреве и охлаждении не изменяется, приведена на рис. 3.9.
Рис. 3.9. Диаграмма состояния сплавов для случая образования компонентами А и В химического соединения
Данная диаграмма как бы составлена из двух диаграмм: компонент А – химическое соединение AmBn и компонент В – химическое соединение AmBn. В сплавах левее точки С (соответствующей по составу химическому соединению AmBn) компонента А имеется больше, чем входит в химическое соединение. Следовательно, в этих сплавах левее точки С образуется эвтектика a+ AmBn. В сплавах правее точки С компонента В больше, чем может входить в химическое соединение. Следовательно, в этих сплавах образуется эвтектика AmBn+b.
Связь между свойствами сплавов и типом диаграммы состояния
Основоположником учения о связи диаграмм состояния со свойствами сплавов является академик Н.С. Курнаков.
Вам также может быть полезна лекция «7 Международное налоговое право».
Рис. 3.10. Свойства сплавов и вид их диаграммы состояния
(по Н.С. Курнакову)
На рис. 3.10 схематически показана зависимость свойств сплавов от типа диаграммы состояния, откуда можно вывести следующее: при образовании твердых растворов с неограниченной растворимостью свойства изменяются по плавным кривым (рис. 3.10, б); при образовании твердых растворов с ограниченной растворимостью или механической смеси свойства изменяются прямолинейно (рис. 3.10, а, в); при образовании химического соединения свойства изменяются резко – скачком (рис. 3.10, г).
























