дисахариды в кале у ребенка что это значит
Исследование кала на дисахариды
Дисахариды — органические соединения, одна из основных групп углеводов. Молекулы дисахаридов состоят из двух остатков моносахаридов, соединённых друг с другом гликозидными связями. Для организма человека пищевую ценность имеют три дисахарида: сахароза, лактоза и мальтоза.
Переваривание дисахаридов происходит в тонком кишечнике на поверхности эпителиальных клеток (ворсинок) (пристеночное пищеварение) под действием специфических ферментов. Сахароза расщепляется сахаразой, лактоза переваривается под влиянием фермента лактазы, мальтозу расщепляет фермент мальтаза. Эти ферменты продуцируются клетками слизистой и не поступают в просвет, а действуют на поверхности оболочки кишечника. Под влиянием ферментов дисахариды расщепляются до моносахаридов: глюкозы, фруктозы и галактозы, которые затем всасываются в стенки кишечника и поступают в кровь. Таким образом, в норме дисахариды в кале отсутствуют.
Определение дисахаридов в кале используется для исследования и оценки переваривающей способности кишечника.
Подготовка к исследованию
Кал собирается в стерильный контейнер с завинчивающейся крышкой и ложечкой в количестве не более 1/3 объёма контейнера.
Материал должен быть доставлен в лабораторию в день сбора. Во время сбора избегать примесей мочи, отделяемого половых органов. До отправки материал должен храниться в холодильнике при температуре +4-+8°С.
Показания
Результаты
В норме дисахариды в кале отсутствуют.
Результаты исследования представляются в качественном выражении: при наличии дисахаридов в пробе выдается ответ «обнаружено»; при отсутствии дисахаридов в кале выдается ответ «не обнаружено».
Положительный результат: подозрение на лактазную недостаточность. Не исключено изменение толерантности к другим сахарам (в особенности, для пациентов иных групп, кроме детей на грудном вскармливании).
Лактазная недостаточность
Ю.А. КОПАНЕВ, детский гастроэнтеролог-инфекционист, ФГУН «Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского» Роспотребнадзора, канд. мед. наук
Лактоза (молочный сахар) в больших количествах содержится в грудном молоке, молочных смесях, коровьем молоке и существенно меньше ее в кисломолочных продуктах, где лактоза частично ферментируется микроорганизмами в процессе приготовления. Непереносимость лактозы – одна из важнейших педиатрических проблем.
Лактазная недостаточность бывает первичной (наследственной) и вторичной (на фоне общей ферментативной незрелости).
Исследованиями доказано, что значительную долю лактазы (до 80%) вырабатывают бактерии нормальной кишечной микрофлоры (бифидо- и лактобактерии, кишечная палочка с нормальной ферментативной активностью). Известно также, что микробная пленка, покрывающая кишечную стенку изнутри, формируется в первые 2 месяца жизни ребенка, а затем еще 8–10 месяцев идет процесс ее стабилизации. Поэтому дети первого года жизни склонны к развитию дисбактериоза кишечника и вторичной лактазной недостаточности.
Первичная лактазная недостаточность – врожденный дефицит фермента лактазы, расщепляющий лактозу. Встречается у 6–10% населения Земли. Обычно при первичной лактазной недостаточности отмечается непереносимость молочных продуктов у кого-то из взрослых родственников ребенка (родителей, бабушки, дедушки, старших братьев или сестер).
Вторичная лактазная недостаточность особенно распространена среди детей первого года жизни и часто является следствием дисбактериоза кишечника и незрелости поджелудочной железы. Вторичная лактазная недостаточность проходит после коррекции дисбактериоза или по мере развития ребенка, и в более старшем возрасте молочные продукты нормально усваиваются. Терапевтические мероприятия при первичной и вторичной лактазной недостаточности совпадают.
Признаки лактазной недостаточности известны: жидкий (часто пенистый) стул, который может быть как частым (более 8–10 раз в сутки), так и редким или отсутствовать без стимуляции; беспокойство ребенка во время или после кормления (грудным молоком или молочными смесями), вздутие живота. В тяжелых случаях лактазной недостаточности ребенок плохо набирает вес или теряет его, отстает в развитии.
Подтвердить лактазную недостаточность можно, проведя анализ фекалий ребенка на углеводы. Норма содержания углеводов в кале у ребенка до года – 0–0,25%. Отклонения от нормы могут быть незначительными – 0,3–0,5%; средними – 0,6–1,0%; существенными – более 1%. Многие педиатры из практики знают, что часто встречаются здоровые дети (либо малыши без явных признаков непереносимости углеводов), у которых показатель наличия углеводов в кале значительно превышает принятые нормы. В катамнезе у таких детей уровень углеводов в фекалиях приходит в норму к 6–8 месяцам, зачастую без каких-либо корригирующих мероприятий. Это связано с созреванием ферментативных систем. Некоторые специалисты в настоящее время ставят вопрос о пересмотре норм уровня углеводов в кале. Цифры могут быть примерно такими: до 1 месяца – 1%; в 1–2 месяца – 0,8%; в 2–4 месяца – 0,6%; в 4–6 месяцев – 0,45%, старше 6 месяцев – ныне принятые 0,25%.
Тактика лечения
Поскольку лактазная недостаточность чаще всего является прямым следствием наличия у ребенка дисбактериоза, основным терапевтическим мероприятием является коррекция микробиологических нарушений. Зачастую после микробиологической коррекции уровень углеводов в кале нормализуется и не требуются изменения характера питания ребенка.
Главные вопросы, которые возникают при выявлении у ребенка лактазной недостаточности: можно ли продолжать кормить малыша молочными продуктами (грудное молоко или молочные смеси) и что еще предпринять? Эти вопросы решаются в зависимости от тяжести проявлений лактазной недостаточности:
Таким образом, при выявлении у ребенка лактазной недостаточности совсем не обязательно отказываться от естественного вскармливания, а зачастую и вовсе не нужно менять питание. Основным мероприятием при вторичной лактазной недостаточности является лечение дисбактериоза и сопутствующих функциональных нарушений. Если по показаниям была введена лактаза, то ее дозировка и продолжительность применения определяются уровнем углеводов в фекалиях, а также состоянием ребенка. Препарат Лактаза энзим назначается в дозе по 1/2 капсулы на прием, Лактаза беби – по 1 капсуле на прием. Обычно лактаза принимается непосредственно перед грудным кормлением или кормлением молочной смесью. Продолжительность лечения – 3–4 недели. Отменять лактазу нужно постепенно, убирая один прием каждые 4 дня, при этом необходимо оценивать изменения состояния ребенка. Если в процессе отмены лактазы у ребенка возобновляются симптомы лактазной недостаточности (появляются боли в животе, жидкий пенистый стул), то рекомендуется вернуться к эффективной дозе, продлив прием лактазы еще на 2 недели; затем можно снова предпринять попытку снизить кратность приемов. В некоторых, тяжелых, случаях лактаза принимается в течение нескольких месяцев.
Если была введена специальная лечебная смесь, то со временем ее можно постепенно заменить на обычную молочную смесь. Замена должна осуществляться постепенно: в первый день заменяется одна мерная ложка в каждое кормление, на второй день – 2 мерные ложки; и так до полной замены. Так же как в случае с отменой лактазы, нужно следить за состоянием ребенка и с учетом этого решать вопрос о целесообразности замены питания.
Наконец, нет необходимости необоснованно ограничивать рацион питания кормящих матерей: исключить нужно цельное коровье молоко, уменьшить потребление сладостей. Следует помнить, что при лактазной недостаточности у малыша должны нормально усваиваться кисломолочные продукты, поэтому их не стоит исключать из рациона кормящих матерей.
При вторичной лактазной недостаточности молочные продукты со временем будут усваиваться без всяких проблем. После 6–7 месяцев и в более старшем возрасте у ребенка лактозная непереносимость проходит без последствий.
При первичной лактазной недостаточности непереносимость молока и молочных продуктов может сохраняться в той или иной мере пожизненно. Но при этом редко бывает абсолютная лактозная непереносимость, поскольку врожденный дефицит лактазы компенсируется той лактазой, которая вырабатывается бактериями нормальной кишечной флоры. Обычно люди с первичной лактазной недостаточностью могут употреблять какое-то количество молока без проблем, а признаки непереносимости появляются, когда это количество превышено. Это количество определяется путем индивидуального подбора. Кроме того, не должно возникать проблем с кисломолочными продуктами, которые вполне могут заменить молоко. Первичная лактазная недостаточность может сочетаться с вторичной, поэтому нужно контролировать состояние кишечной флоры (с помощью анализа на дисбактериоз).
Терапия лактазной недостаточности у детей первых месяцев жизни
Состояния, связанные с нарушенным кишечным пищеварением и всасыванием, объединенные термином «мальабсорбция», относятся к числу частых нарушений здоровья у детей раннего возраста.
Состояния, связанные с нарушенным кишечным пищеварением и всасыванием, объединенные термином «мальабсорбция», относятся к числу частых нарушений здоровья у детей раннего возраста. Наиболее частой формой синдрома мальабсорбции у детей раннего возраста является непереносимость дисахаридов (лактозы, реже — других углеводов) [1, 2].
Особое значение для детей первых месяцев жизни имеет лактазная недостаточность (ЛН), так как лактоза содержится в грудном молоке, которое является основным питанием ребенка этого возраста. Дисахарид лактоза расщепляется в тонкой кишке ферментом, известным под названием лактаза. Снижение активности этого фермента приводит к развитию симптомокомплекса ЛН, проявляющейся у детей раннего возраста диареей, а также другими диспептическими нарушениями, беспокойством и др. Основным методом лечения ЛН является диетотерапия, направленная на уменьшение или полное исключение лактозы из рациона питания [3, 4]. Особую сложность представляет лечение ЛН у детей грудного возраста, так как в грудном молоке или в современных адаптированных детских молочных смесях углеводный компонент представлен преимущественно лактозой. При искусственном вскармливании детей с лактазной недостаточностью используются низколактозные смеси. Безлактозные смеси в качестве монотерапии используют только при первичной алактазии и при тяжелом течении вторичной гиполактазии [2, 5].
Учитывая, что поддержка естественного вскармливания детей первого года жизни является приоритетной задачей педиатрии, проблема профилактики и лечения ЛН у детей, находящихся на естественном вскармливании, представляется чрезвычайно важной и актуальной. При этом наиболее целесообразным в лечении ЛН является не исключение женского молока, а проведение заместительной терапии в виде назначения детям фермента лактазы. Использование ферментных препаратов лактазы в терапии ЛН позволяет довольно быстро купировать симптомы заболевания, сохранив при этом грудное вскармливание [1, 6, 7].
Учитывая значительные колебания в активности и свойствах препаратов лактазы, выпускаемых различными производителями и выделенных из различных источников, представляется необходимой обязательная клиническая оценка препарата лактазы, впервые выпускаемого в РФ или поступающего из-за рубежа в виде фармацевтического средства или биологически активной добавки (БАД).
Одним из таких БАД, содержащих лактазу, является БАД «Лактазар для детей», выпускаемый ОАО «Фармстандарт — Лексредства» (Россия). Целью настоящей работы явилось изучение эффективности использования в терапии детей первых трех месяцев жизни с ЛН, находящихся на грудном вскармливании, БАД «Лактазар для детей». Исследование проведено ГУ НИИ питания РАМН на базе детской поликлиники г. Химки Московской области.
Краткая характеристика. «Лактазар для детей» предназначен для использования в качестве дополнительного источника фермента лактазы при ЛН у детей с периода новорожденности до 7 лет. БАД «Лактазар для детей» представляет собой твердые желатиновые капсулы с белым порошком со специфическим запахом. Средняя масса содержимого капсул «Лактазар для детей» от 0,135 до 0,165 г. Активность лактазы в БАД «Лактазар для детей» — 700 ЕД на капсулу. Для производства БАД «Лактазар для детей» в качестве сырья используется фермент лактаза (Lactase DS) производства Amano Enzyme Inc. (Япония).
Дизайн исследования. Исследование носило характер открытого проспективного медицинского наблюдения.
Клинические наблюдения проведены у 25 детей в возрасте от 2 недель до 3 месяцев жизни, длительность наблюдения составила 6 недель. Клинико-лабораторные исследования проведены до назначения БАД «Лактазар для детей» и после приема ферментного препарата в течение 1 месяца.
Материалы и методы
Критерии отбора детей для исследования:
Критерии исключения детей из исследования:
Критерии оценки эффективности проводимой терапии:
— изменение кратности и консистенции стула, наличие или отсутствие патологических примесей в кале;
— динамика других диспептических нарушений (срыгиваний, колик, запоров и пр.);
— кожные или иные аллергические проявления при приеме БАД «Лактазар для детей»;
— содержание общих углеводов в кале*;
— копрологические исследования*;
— клинические анализы крови и мочи;
— измерение массы тела 1 раз в 2 недели с использованием стандартизированных весов;
— измерение роста — до и после проведения исследования с использованием стандартного ростомера.
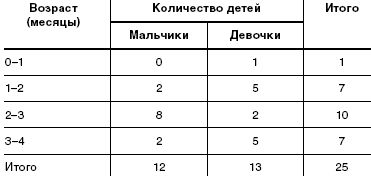
Под наблюдением находилось 25 детей (12 мальчиков и 13 девочек) в возрасте от 2 недель до 3 месяцев жизни. Все дети находились на естественном вскармливании. Под наблюдение дети поступали по обращению матерей к участковому педиатру в детской поликлинике. Дети наблюдались в амбулаторных условиях, еженедельно осматривались врачом-педиатром. Дома матери заполняли специально предложенную им анкету, в которой содержались вопросы о показателях эффективности исследуемого БАД (частота и характер стула, частота и объем срыгиваний и пр.). Дополнительные сведения получали путем телефонного интервью.
Данные о наблюдавшихся детях и их возрастно-половая характеристика представлены в табл.1 и табл.2
Все дети были доношенными, от первых (20), вторых (4) и третьих (1) родов; у 84% матерей имело место патологическое течение беременности (гестозы, анемия, наличие хронических заболеваний, хроническая фетоплацентарная недостаточность и пр.). Все кормящие матери соблюдали предложенную им диету [8]. Из рационов кормящих матерей исключали цельное коровье молоко с целью профилактики развития у детей аллергии к белкам коровьего молока и снижения тем самым возможности формирования вторичной ЛН.
При изучении анамнеза жизни было установлено, что более чем у половины обследованных детей кто-либо из членов семьи не переносит или не любит молоко и молочные продукты. Так, у 60% детей не переносит молоко один из родителей, у 20% — один из членов семьи (сестры, братья, дедушки, бабушки и др.); у остальных детей непереносимости молочных продуктов в семье, со слов матерей, не отмечено.
Диагноз ЛН устанавливали на основании характерных клинических симптомов (типичные изменения частоты и консистенции стула, усиленный метеоризм, болевой синдром и др.) и результатов клинико-лабораторных исследований (повышенного содержания общих углеводов в кале).
Результаты исследования и обсуждение
Дозу БАД «Лактазар для детей» назначали в зависимости от степени выраженности клинических проявлений ЛН (табл. 3), учитывая количество молока, употребляемого ребенком за одно кормление. Большинство детей получали по одной капсуле в каждое кормление, т. е. по 5–7 капсул БАД в сутки. Продолжительность приема БАД «Лактазар для детей» составила 1 месяц. Следует отметить, что ни в одном случае не было рекомендовано прекращение грудного вскармливания и к концу наблюдения все женщины продолжали кормить детей грудью.
Результаты исходного обследования детей
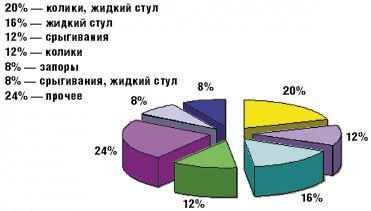
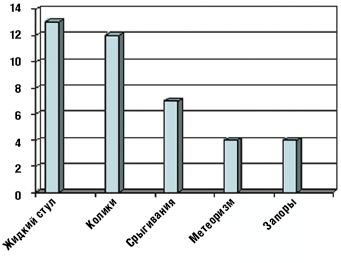
Как видно из табл. 3 и рис. 1 и 2, клинические проявления ЛН у обследованных детей были весьма вариабельны.
Такой наиболее характерный симптом ЛН, как жидкий стул, был обнаружен у 13 детей (52%), причем у 5 из них жидкий стул сочетался с коликами (табл. 3). У остальных детей имели место другие проявления функциональных нарушений пищеварения (срыгивания, метеоризм, запор). Срыгивания разной степени выраженности наблюдались у 7 детей (28%), причем у 2 детей (8%) срыгивания были единственной жалобой. У 4 детей (16%) отмечались запоры, причем как единственная жалоба запоры наблюдались у 2 детей. У 8 детей на момент взятия под наблюдение нарушений частоты и консистенции стула не было, стул у этих детей наблюдался 2–3 раза в день, кашицеобразной консистенции.
У 2 детей отмечалась недостаточная прибавка массы тела (300–400 г в месяц) и снижение аппетита (дети употребляли не весь объем порции молока, необходимый ему из расчета на массу тела и возраст); именно это послужило причиной обращения к педиатру.
Как видно из рис. 1 и 2, у наблюдавшихся детей одинаково часто (в 12% случаев) встречались колики и срыгивания как единственно предъявляемая жалоба; в 8% случаев основной и единственной жалобой были запоры. В группу под названием «прочее» мы объединили 6 детей, которые имели характерное только для них сочетание клинических проявлений ЛН (табл. 3).
Таким образом, полученные нами данные свидетельствуют о том, что клиническая картина ЛН весьма многообразна и часто не совпадает с общепринятым представлением о диарее как ведущем симптоме этого заболевания.
Результаты изучения эффективности БАД «Лактазар для детей»
Проведенные исследования показали хорошую переносимость БАД у всех наблюдавшихся детей (из исследования не был выведен ни один ребенок) и ее эффективность в устранении симптомов ЛН.
Нормализация частоты стула и его консистенции была отмечена уже к концу первой недели, причем положительная динамика имела место в среднем на 5-й день терапии. При этом кратность и консистенция стула изменялись у детей неодинаково. Нормализация консистенции стула у детей с частым жидким стулом отмечалась на 3–5 день применения БАД; а у детей с запорами восстановление регулярного стула с кратностью 3–4 раза в день, имевшего цвет и консистенцию, обычные для детей данной возрастной группы, находящихся на естественном вскармливании, — на 6–8 день. Частота стула у детей с диареей до начала терапии составляла в среднем 5,7 ± 1,2 раза в сутки, а после ее завершения — 3,8 ± 0,9 раза в сутки. У детей с запорами частота стула была равна соответственно 0,8 ± 0,6 и 2,5 ± 1,7.
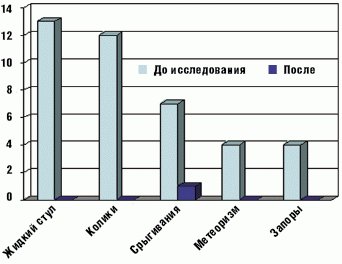
Применение БАД «Лактазар для детей» оказалось эффективным и в устранении других симптомов функциональных нарушений пищеварения, характерных для ЛН у детей раннего возраста (табл. 4 и рис. 3).
Болевой синдром, проявлявшийся кишечными коликами, и метеоризм купировались у всех 25 детей на 3–5 день применения БАД. Частота и объем срыгиваний значительно уменьшились в конце первой недели терапии и полностью исчезли после двух недель приема препарата у большинства детей. Только у одного ребенка к концу исследования изредка отмечались срыгивания.
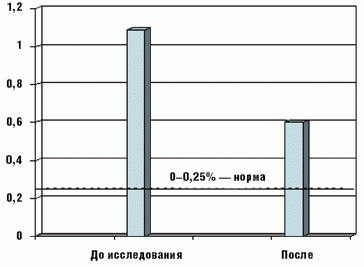
Экскреция углеводов с калом достоверно снизилась у большинства детей с 1,1 ± 0,3% до начала терапии до 0,6 ± 0,1% после ее завершения, разброс значений составил 0,4–1,8% и 0,25–0,6% соответственно (рис. 4).
Однако у 6 детей достоверного снижения уровня экскреции углеводов с калом не отмечено (0,7–0,8% до исследования и 0,5–0,6% — после); хотя клинические симптомы нарушений пищеварения были купированы на первой неделе приема БАД. Полученные нами данные согласуются с литературными данными, указывающими на отсутствие четкой корреляции между выраженностью клинических проявлений ЛН и уровнем экскреции углеводов с калом [1, 3, 4]. В связи с этим необходимо отметить, что в соответствии с современными научными представлениями основным критерием эффективности терапии является устранение клинических симптомов заболевания, а не снижение до нормы экскреции углеводов.
При копрологическом исследовании у большинства наблюдавшихся детей не было выявлено существенных патологических изменений. До проведения терапии у большинства детей каловые массы были жидковатой или кашицеобразной консистенции, светло-желтого или салатового цвета, слегка кисловатого запаха, с pH 5–7, и содержали в умеренном или единичном количестве нейтральный жир, жирные кислоты, лейкоциты (не более 2–3 в поле зрения), небольшие количества прозрачной слизи. Прием БАД «Лактазар для детей» не оказывал влияния на эти минорные изменения в копрологических анализах.
Показатели клинических анализов крови и мочи у обследованных детей до и после проведения терапии были в пределах возрастной нормы. Содержание гемоглобина в крови у детей до и после исследования составило 135,3 ± 1,5 г/л и 132,3 ± 1,2 г/л соответственно.
Наблюдавшаяся динамика массоростовых показателей была в пределах возрастной нормы: средняя прибавка массы тела в сутки составила в среднем 29,7 ± 2,7 г, а прибавка длины тела за месяц — 2,8 ± 0,5 см (средние показатели увеличения массы и длины тела у детей первых трех месяцев жизни составляют 26–30 г/сутки и 2,5–3 см/месяц соответственно). У 2 детей с исходно недостаточной прибавкой массы тела (300–400 г в месяц) прием БАД «Лактазар для детей» привел к значительному увеличению данного показателя (900 и 1000 г в месяц).
Как показали полученные результаты, использование содержащего лактазу БАД «Лактазар для детей» позволило купировать клинические симптомы ЛН и сохранить естественное вскармливание у всех наблюдавшихся детей. Терапия хорошо переносилась, случаев аллергических реакций и непереносимости исследуемого БАД не наблюдалось.
Таким образом, проведенное изучение эффективности использования в терапии детей первых месяцев жизни с ЛН, находящихся на естественном вскармливании, БАД «Лактазар для детей», выпускаемой ОАО «Фармстандарт — Лексредства» (Россия), позволили сделать следующие выводы:
Ферментная недостаточность у детей
Синдром мальабсорбции
— это синдром нарушения всасывания компонентов пищи в тонком кишечнике. Абсорбции или всасыванию мономеров (жирных кислот, аминокислот, моносахаров и др.) предшествует гидролиз — расщепление пищевых полимеров (белков, жиров и углеводов) под воздействием пищеварительных ферментов. Нарушение гидролиза полимеров при недостаточности пищеварительных ферментов (дигестивных энзимов) называется синдромом мальдигестии или синдромом недостаточности пищеварения. Часто встречающееся в клинической практике сочетание обоих видов расстройств — мальабсорбции и мальдигестии — предлагалось обозначать как синдром мальассимиляции. Однако в медицинской литературе традиционно называют мальабсорбцией все нарушения кишечного всасывания, вызванные как собственно патологией процесса абсорбции, так и недостаточностью пищеварительных ферментов. Синдромом мальабсорбции сопровождается целая группа заболеваний, в основе развития которых лежит наследственно обусловленная или вторичная (при патологии поджелудочной железы или других органов системы пищеварения) недостаточность ферментов.
На первом году жизни чаще всего синдром малъабсорбции является генетической наследственной патологией, наиболее известными наследственными ферментопатиями являются дисахаридазная недостаточность, целиакия и муковисцидоз.
Дисахаридазная недостаточность.
Дисахариды — компоненты большинства углеводов. Процессы их переваривания обеспечиваются специальными ферментами кишечника — дисахаридазами. После распада дисахаридов образуются моносахара, которые могут затем всасываться при помощи транспортных систем кишечника. Непереносимость дисахаридов у детей обусловлена наследственным отсутствием или снижением активности одной или нескольких дисахаридаз кишечника, в результате чего происходит неполное расщепление дисахаридов в тонкой кишке. Перистальтическими движениями кишечника не полностью расщепленные дисахариды перемещаются в нижние отделы пищеварительного тракта, где под действием естественной микрофлоры переходят в органические кислоты, сахара и водород. Эти вещества снижают абсорбцию воды и солей из полости кишечника, т. е. пищевая кашица (химус) разжижается, и это приводит к развитию поноса у ребенка. Симптомы первичной дисахаридазной недостаточности появляются у ребенка обычно сразу же после рождения. Для этой группы болезней характерно то, что с возрастом происходит некоторая компенсация нарушенных ферментативных функций, и симптомы болезни смягчаются или вообще проходят. Среди наследственных дефектов дисахаридаз наиболее известными являются недостаточность лактозы, сахарозы, изомальтазы, трегалазы. Недостаточность лактазы объясняется мутацией гена, который отвечает за синтез лактозы, в результате чего этот фермент или не синтезируется совсем (алактазия), или синтезируется его малоактивная форма (гиполактазия). Поэтому при поступлении лактозы в кишечник она полностью не расщепляется неполноценной лактозой, и развиваются характерный симптом мальабсорбции — диарея.
Родителям необходимо знать о том, что лактоза содержится не только в цельном женском, коровьем и козьем молоке, но и во всех видах сухого молока, во многих кисломолочных продуктах (сметане), сгущенном молоке, а также в некоторых медикаментах в качестве наполнителя. Поэтому при назначении лекарства следует информировать врача об имеющемся дефиците лактозы и внимательно ознакомиться с аннотацией препарата. В легких случаях непереносимости лактозы вместо молока дают молочные продукты и молоко, обработанное препаратами B-галактозидазы. Детям с лактозной недостаточностью показаны продукты, содержащие фруктозу (овощные и фруктовые пюре), которая хорошо всасывается и не подвергается бактериальному брожению. Кроме лечебного питания, в первые дни болезни коротким курсом (5—7 дней) назначают ферментативные препараты. В течение 30—45 дней применяют пробиотики для нормализации кишечной. Недостаточность сахарозы и изомальтазы чаще встречается вместе. У детей, находящихся на искусственном вскармливании, признаки дефицита этих ферментов отсутствуют. Симптомы заболевания появляются после употребления ребенком пищи, содержащей сахарозу и крахмал (сахар, картофель, манная крупа, мучные изделия) при переводе его на искусственное вскармливание или после введения прикормов. У ребенка после приема такой пищи возникают пенистый водянистый стул, рвота. При тяжелой форме и нахождении ребенка на искусственном вскармливании смесями, содержащими сахарозу, рвота становится упорной, ребенок теряет в весе. Диагноз непереносимости сахарозы подтверждают проведением пробы с нагрузкой сахарозой. Лечение состоит в соблюдении диеты с исключением продуктов, содержащих сахарозу и крахмал. Можно употреблять фрукты и овощи, в которых количество сахарозы невелико (морковь, яблоки). Прогноз благоприятный. С возрастом недостаточность ферментов компенсируется, и диету можно расширить.
Глютеновая болезнь (целиакия)
— это хроническое наследственное заболевание, развивающееся вследствие недостаточности ферментов, участвующих в переваривании глютена. В последние годы в связи с повышением качества диагностики глютеновая болезнь обнаруживается все чаще. Глютен — это компонент клейковины ряда злаковых культур — пшеницы, ржи, ячменя, овса. При распаде глютена образуется токсичный продукт — глиадин, который оказывает повреждающее действие на слизистую оболочку тонкого кишечника. Однако в норме у здоровых детей глиадин не повреждает слизистой, так как специфические ферменты расщепляют его до нетоксичных субстанций. При глютеновой болезни наблюдается выраженный в различной степени дефицит этих ферментов (вплоть до их полного отсутствия). В результате глютен не гидролизуется в кишечнике, а накапливается вместе с продуктами своего неполного расщепления, оказывая токсическое воздействие на слизистую оболочку тонкого кишечника, клетки слизистой тонкого кишечника погибают, и нарушается переваривающая и всасывательная функции. В типичных случаях глютеновой болезни заболевание имеет хроническое течение с периодами обострения и ремиссии.
Первые признаки целиакии появляются у ребенка во втором полугодии жизни после введения прикормов, в состав которых входит глютен злаков (манной, пшеничной, овсяной каш).
Если ребенок находится на искусственном вскармливании смесями, содержащими пшеничную, муку, то симптомы болезни проявляются раньше. От момента введения в питание ребенка глютенсодержащих продуктов до появления симптоматики проходит обычно 4—8 недель. Основными признаками глютеновой болезни являются дистрофия потеря в весе и отставание в росте, диарея, стеаторея (наличие нерасщепленных жиров в кале) и поражение центральной нервной системы. Клиника целиакии развивается постепенно. Сначала у ребенка снижается аппетит, появляются вялость, слабость, частые срыгивания. В дальнейшем срыгивания переходят в рвоту, развивается диарея. Кал при целиакии резко зловонный, обильный, пенистый, бледный с сероватым оттенком, блестящий. Ребенок перестает прибавлять в весе, а затем масса тела у него снижается. Дети сильно отстают в росте. Живот увеличен, что в сочетании с тонкими конечностями придает ребенку характерный внешний вид — «рюкзак на ножках». Выражение лица ребенка грустное, мимика скудная («несчастный вид»). Со временем поражаются и другие органы системы пищеварения — печень, поджелудочная железа, двенадцатиперстная кишка. Может развиваться цирроз печени. Отмечается умеренное увеличение в размерах печени и селезенки. Нарушение ферментообразующей функции поджелудочной железы приводит к еще большему угнетению процесса пищеварения. Возможно развитие вторичной недостаточности инсулина, чем объясняются симптомы сахарного диабета (повышенное выделение мочи и жажда) в период обострения болезни. Страдают все виды обмена веществ, особенно белкового. Развивается дефицит аминокислот, снижается концентрация общих липидов, холестерина и увеличивается количество кетоновых тел в сыворотке крови. Обменные нарушения проявляются рахитом, полигиповитаминозами, анемией. У детей может возникать облысение волосистой части головы (алопеция), часты переломы трубчатых костей. Развивается вторичное иммунодефицитное состояние, дети подвержены частым простудным заболеваниям, которые протекают более тяжело и длительно. У всех детей наблюдаются расстройства центральной нервной системы (обменно-токсическая энцефалопатия), дети раздражительны, капризны, отстают в психомоторном развитии. Для подтверждения диагноза целиакии применяют провокационный тест с глютеном и исследование биоптата слизистой оболочки двенадцатиперстной или тощей кишки.
Основным методом лечения глютеновой болезни является диетотерапия — исключение из питания больного ребенка всех продуктов, содержащих глютен (хлеба, хлебобулочных, кондитерских и макаронных изделий, манной, овсяной, перловой, пшеничной и ячневой круп и каш промышленного производства из этих круп). Так как мука и другие продукты переработки глютенсодержащих злаковых культур нередко добавляются в состав колбас, сосисок, сарделек, мясных и рыбных консервов (в том числе и предназначенных для детского питания), их тоже исключают из рациона ребенка. В острый период заболевания используют также ферменты, витамины, пробиотики.
При крайне тяжелых формах целиакии и низкой эффективности диетотерапии применяют глюкокортикоиды (гормоны) коротким курсом с постепенной отменой в последующем. Родители должны помнить о том, что безглютеновую диету соблюдать следует пожизненно, даже при полном исчезновении признаков заболевания. Несоблюдение диеты может привести к более тяжелому рецидиву заболевания, и возникшие нарушения тяжело будет компенсировать.
Кишечная форма муковисцидоза.
Генетический дефект при этом наследственном заболевании нарушает обратное всасывание хлорида натрия всеми экзокринными железами, в результате чего их секрет становится вязким, густым, отток его затруднен. Секрет застаивается в выводных протоках желез, они расширяются, и образуются кисты. Происходит гибель железистых клеток. Чаще всего встречаются кишечная и легочная форма муковисцидоза, при которых преимущественно поражаются соответственно железы кишечника или бронхов. Могут встречаться комбинированные формы. Поражение желез кишечника при муковисцидозе приводит к тому, что значительно нарушаются процессы переваривания и всасывания компонентов пищи (синдромы мальдигестии и мальабсорбции). В большей степени страдает переваривание жиров, что связано с угнетением ферментативной активности поджелудочной железы, которая тоже страдает при муковисцидозе.
У новорожденных кишечная форма муковисцидоза может проявиться мекониальным илеусом — кишечной непроходимостью в результате закупорки просвета кишечника густым и вязкиммеконием. В норме у новорожденных меконий должен отходить в первые сутки жизни. Если этого не происходит, должна возникать настороженность в отношении муковисцидоза, тем более, если у родителей или близких родственников ребенка имеются признаки этого заболевания. Осложнениями мекониального илеуса являются перфорация (образование отверстия) стенки кишечника и развитие тяжелого состояния — мекониального перитонита (воспаление брюшины).
На первом году жизни у ребенка с муковисцидозом, несмотря на хороший уход, рациональное вскармливание и хороший аппетит, плохо нарастает масса тела. Особенно ярко признаки муковисцидоза проявляются при переходе от грудного на смешанное или искусственное вскармливание. Характерен внешний вид детей, больных муковисцидозом: «кукольное» лицо, деформированная грудная клетка, большой вздутый живот, часто — пупочная грыжа. Конечности худые, отмечается деформация (утолщение) концевых фаланг пальцев в виде барабанных палочек. Кожа сухая, ее цвет серовато-землистый. Стул ребенка обильный, жидкий, сероватого цвета, со зловонным специфическим запахом прогорклого жира («мышиный запах»), жирный и блестящий, плохо смывается с горшка и пеленок. Часто встречается симптом «проскальзывания», когда стул у ребенка возникает сразу же после кормления. В некоторых случаях могут быть запоры, замазкообразная консистенция стула или выходу разжиженного кала предшествует выход каловой пробки. На фоне запоров часто возникает выпадение слизистой оболочки прямой кишки (как правило, хирургической коррекции в этом случае не требуется). Иногда не переваренный жир вытекает из заднего прохода ребенка в виде маслянистой жидкости, оставляя на пеленках жирный след. Если дефекация и мочеиспускание происходят одновременно, на поверхности мочи плавает жир в виде маслянистых пленок. Вследствие постоянного длительного нарушения процессов пищеварения ребенок на фоне обычно хорошего или повышенного аппетита худеет (вплоть до развития тяжелых форм истощения), появляются признаки недостаточности различных витаминов (полигиповитаминоз) страдают обменные процессы. Дети отстают в физическом развитии. Диагностика муковисцидоза проводится при помощи исследования кала (определение непереваренных остатков пищи), определения трипсина в кале, потовых проб (в потовой жидкости определяют содержание натрия и хлора) и при помощи специфического генетического исследования с идентификацией мутантного гена. Лечение при кишечной форме муковисцидоза направлено на улучшение процессов пищеварения. При тяжелом и средне-тяжелом состоянии ребёнка, когда синдром мальабсорбции сочетается с обезвоживанием и выраженным токсикозом, диету начинают с водно-чайной паузы. Ребенка отпаивают из расчета 100—150 мл/кг массы в сутки 5%-ным раствором глюкозы, регидроном, зеленым чаем и т. д. При тяжелом состоянии глюкозо-солевые растворы вводят также внутривенно капельно. В стационаре в острый период назначают гормональную терапию коротким курсом, витамины. После снятия обострения ребенок переводится на диету с частотой кормления 8—10 раз в сутки. Дети первого года жизни продолжают получать грудное молоко, которое является для них оптимальным видом пищи. При искусственном вскармливании предпочтение должно отдаваться смесям, которые содержат жиры в виде среднецепочечных триглицеридов. Эти компоненты жиров не требуют для своего переваривания участия ферментов поджелудочной железы и поэтому легко всасываются. После введения прикормов и в последующей жизни диета ребенка должна включать минимальные количества жиров и большие количества белка. Больные муковисцидозом нуждаются в повышенном количестве белка, так как он теряется в значительном объеме из-за синдрома мальабсорбции. Поэтому в питание ребенка с 7-месячного возраста необходимо включать такие высокобелковые продукты, как мясо, рыбу, яйцо и творог. Кроме диеты назначаются индивидуально подобранные дозировки ферментных препаратов. Для нормализации кишечного биоценоза применяют препараты нормальной кишечной флоры курсами по 2—3 месяца и более. Проводятся курсы витаминотерапии. Родителям следует внимательно следить за состоянием ребенка, а если в семье имеются указания на возможное наличие заболевания у родственников (сами родители могут быть и здоровы) — информировать об этом педиатра.