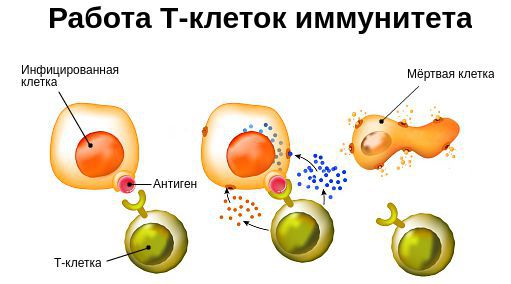
дисиммуноглобулинемия что это такое
Дефицит иммуноглобулина А
Дефицит иммуноглобулина А – группа первичных иммунодефицитных состояний, которые обусловлены нарушением синтеза или ускоренным разрушением молекул иммуноглобулинов данного класса. Симптомами заболевания являются частые бактериальные инфекции (особенно респираторной системы и ЛОР-органов), нарушения со стороны желудочно-кишечного тракта, аллергии и аутоиммунные поражения. Диагностика дефицита иммуноглобулина А производится путем определения его количества в сыворотке крови, также применяют молекулярно-генетические техники. Лечение симптоматическое, сводится к профилактике и своевременной терапии бактериальных инфекций и других нарушений. В некоторых случаях осуществляют заместительную иммуноглобулиновую терапию.
Общие сведения
Дефицит иммуноглобулина А – полиэтиологическая форма первичного иммунодефицита, при которой наблюдается недостаток этого класса иммуноглобулинов при нормальном содержании остальных классов (G, M). Дефицит может быть полным, с резким снижением всех фракций глобулина А, и селективным, с недостатком только определенных подклассов этих молекул. Селективный дефицит иммуноглобулина А является очень распространенным состоянием, по некоторым данным его встречаемость составляет 1:400-600. Явления иммунодефицита при селективном недостатке соединения достаточно стертые, почти у двух третей больных заболевание не диагностируется, поскольку они не обращаются за медицинской помощью. Врачи-иммунологи установили, что дефицит иммуноглобулина А может проявляться не только инфекционными симптомами, у пациентов также нередко наблюдаются обменные и аутоиммунные расстройства. С учетом этого обстоятельства можно предположить, что встречаемость данного состояния еще выше, чем предполагалось ранее. Современные генетики считают, что заболевание возникает спорадически или является наследственной патологией, причем в качестве механизма передачи может выступать как аутосомно-доминантный, так и аутосомно-рецессивный путь наследования.
Причины дефицита иммуноглобулина А
Этиология и патогенез как полного, так и селективного дефицитов иммуноглобулина А на сегодняшний момент до конца не определены. Пока удалось установить лишь генетически-молекулярные механизмы отдельных форм заболевания. Например, селективный дефицит иммуноглобулина А типа 2 обусловлен мутациями гена NFRSF13B, локализованного на 17-й хромосоме и кодирующего одноименный белок. Данный протеин представляет собой трансмембранный рецептор на поверхности В-лимфоцитов, отвечает за распознавание фактора некроза опухолей и некоторых других иммунокомпетентных молекул. Соединение принимает активное участие в регуляции интенсивности иммунного ответа и секреции различных классов иммуноглобулинов. По данным молекулярных исследований, генетический дефект гена TNFRSF13B, приводящий к развитию аномального рецептора, делает определенные фракции В-лимфоцитов функционально незрелыми. Такие клетки вместо продукции оптимальных количеств иммуноглобулинов А выделяют смесь из классов А и D, что приводит к уменьшению концентрации класса А.
Мутации гена TNFRSF13B представляют собой распространенную, но далеко не единственную причину развития дефицита иммуноглобулина А. При отсутствии поражения этого гена и при имеющихся клинических проявлениях иммунодефицита данного типа предполагается наличие мутаций в 6-й хромосоме, где располагаются гены главного комплекса гистосовместимости (ГКГС). Кроме того, у ряда больных с дефицитом иммуноглобулина А наблюдаются делеции короткого плеча 18-й хромосомы, но однозначно связать эти два обстоятельства между собой пока не удается. Иногда недостаток молекул класса А сочетается с дефицитом иммуноглобулинов иных классов и нарушением активности Т-лимфоцитов, что формирует клиническую картину общего вариабельного иммунодефицита (ОВИД). Некоторые врачи-генетики предполагают, что дефицит иммуноглобулина А и ОВИД провоцируются очень похожими или одинаковыми генетическими дефектами.
Иммуноглобулин А отличается от других родственных молекул тем, что обуславливает самый первый этап неспецифической иммунологической защиты организма, поскольку выделяется в составе секрета желез слизистых оболочек. При его недостатке патогенным микроорганизмам становится легче внедряться в слабо защищенные нежные ткани слизистых дыхательных путей, желудочно-кишечного тракта и ЛОР-органов. Механизмы аутоиммунных, обменных и аллергических нарушений при дефиците иммуноглобулина А до сих пор неизвестны. Существует предположение, что его низкая концентрация вносит дисбаланс во всю иммунную систему.
Симптомы дефицита иммуноглобулина А
Все проявления дефицита иммуноглобулина А в иммунологии разделяют на инфекционные, обменные (или желудочно-кишечные), аутоиммунные и аллергические. Инфекционные симптомы заключаются в повышенной частоте бактериальных инфекций дыхательных путей – у больных часто возникают ларингиты, трахеиты, бронхиты и пневмонии, которые могут принимать тяжелое течение и сопровождаться развитием осложнений. Кроме того, для дефицита иммуноглобулина А характерен быстрый переход острых воспалительных процессов в хронические формы, что особенно показательно в отношении поражений ЛОР-органов – у пациентов нередко диагностируются отиты, гаймориты и фронтиты. Достаточно часто встречающийся сочетанный дефицит иммуноглобулинов А и G2 приводит к тяжелым обструктивным поражениям легких.
В меньшей степени инфекционные поражения затрагивают желудочно-кишечный тракт. При дефиците иммуноглобулина А наблюдается некоторое учащение лямблиоза, могут регистрироваться гастриты и энтериты. Наиболее характерными для этого иммунодефицита симптомами со стороны ЖКТ являются непереносимость лактозы и целиакия (невосприимчивость белка злаковых глютена), которые при отсутствии коррекции питания могут привести к атрофии кишечных ворсин и синдрому мальабсорбции. Среди больных дефицитом иммуноглобулина А также часто регистрируются язвенный колит, билиарный цирроз печени и хронические гепатиты аутоиммунного генеза. Перечисленные заболевания сопровождаются болями в животе, частыми эпизодами диареи, похуданием и гиповитаминозами (по причине нарушения всасывания нутриентов из-за мальабсорбции).
Помимо вышеописанных заболеваний желудочно-кишечного тракта, аутоиммунные и аллергические поражения при дефиците иммуноглобулина А проявляются повышенной частотой развития системной красной волчанки и ревматоидного артрита. Возможны также тромбоцитопеническая пурпура и аутоиммунная гемолитическая анемия, нередко – с тяжелым течением. Более чем у половины больных в крови определяются аутоантитела против собственного иммуноглобулина А, что еще более усугубляет явления недостатка данного соединения. У пациентов с дефицитом иммуноглобулина А часто выявляют крапивницу, атопические дерматиты, бронхиальную астму и другие заболевания аллергического происхождения.
Диагностика дефицита иммуноглобулина А
Диагностика дефицита иммуноглобулина А производится на основании данных истории болезни пациента (частые инфекции дыхательных путей и ЛОР-органов, поражения ЖКТ), но наиболее точным способом подтверждения диагноза является определение количества сывороточных иммуноглобулинов разных классов. При этом может обнаруживаться изолированное уменьшение уровня этого компонента гуморального иммунитета ниже 0,05 г/л, что свидетельствует о его дефиците. На этом фоне уровень иммуноглобулинов G и M остается в пределах нормы, иногда выявляется снижение фракции G2. При частичном дефиците иммуноглобулина А его концентрация остается в пределах 0,05-0,2 г/л. При оценке результатов анализа важно помнить о возрастных особенностях количества глобулинов в плазме крови – например, концентрация фракции А 0,05-0,3 г/л у детей до 5-ти лет носит название транзиторного дефицита и может исчезать в дальнейшем.
Иногда обнаруживается парциальный дефицит иммуноглобулина А, при котором его количество в плазме снижено, но концентрация соединения в выделениях слизистых оболочек достаточно высока. Никаких клинических симптомов заболевания у пациентов с парциальным дефицитом не выявляется. В иммунограмме следует обратить внимание на количество и функциональную активность иммунокомпетентных клеток. При дефиците иммуноглобулина А количество Т- и В-лимфоцитов обычно сохранено на нормальном уровне, снижение количества Т-лимфоцитов свидетельствует о возможном наличии общего вариабельного иммунодефицита. Среди других методов диагностики вспомогательную роль играют определение в плазме антинуклеарных и других аутоантител, автоматическое секвенирование гена TNFRSF13B и аллергологические пробы.
Лечение, прогноз и профилактика дефицита иммуноглобулина А
Специфическое лечение данного иммунодефицита отсутствует, в некоторых случаях производят заместительную иммуноглобулиновую терапию. В основном используют антибиотики для лечения бактериальных инфекций, иногда назначают профилактические курсы антибактериальных средств. Необходима коррекция рациона питания (исключение опасных продуктов) при развитии пищевой аллергии и целиакии. В последнем случае исключают блюда на основе злаков. Бронхиальную астму и другие аллергические патологии лечат общепринятыми препаратами – антигистаминными и бронхолитическими средствами. При выраженных аутоиммунных нарушениях назначают иммуносупрессивные препараты – кортикостероиды и цитостатики.
Прогноз при дефиците иммуноглобулина А в целом благоприятный. У многих больных патология протекает абсолютно бессимптомно и не требует специального лечения. При повышении частоты бактериальных инфекций, аутоиммунных поражениях и нарушениях всасывания (синдроме мальабсорбции) прогноз может ухудшаться соответственно тяжести симптомов. Для профилактики развития перечисленных проявлений необходимо использование антибиотиков при первых признаках инфекционного процесса, соблюдение правил относительно режима питания и состава рациона, регулярное наблюдение у иммунолога и врачей других специальностей (в зависимости от сопутствующих нарушений). Следует соблюдать осторожность при переливании цельной крови или ее компонентов – в редких случаях у больных наблюдается анафилактическая реакция из-за наличия в крови аутоантител к иммуноглобулину А.
Дисиммуноглобулинемия что это такое
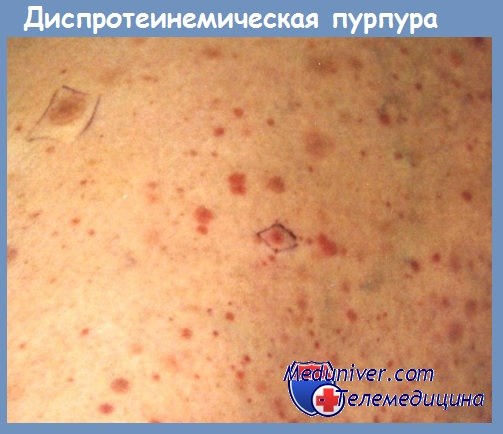
Дисгаммаглобулинемические или гипергаммаглобулинемические пурпуры, известные уже давно, обособились с точки зрения их механизма и клинической сущности когда Вальденштрем дал описание макроглобулинемической пурпуры. Ее следует отличать от гипергаммаглобулинемических пурпур в течение злокачественных пролиферации, имеющих моноклинальный характер, с гиперсекрецией IgM, и от гипергаммаглобулинемических пурпур при реактивных пролиферациях, поликлонального характера на почве роста нескольких классов Ig, а также и на почве расстройств последних, разделенных на 7 типов дисгаммаглобулинемий, описанных за последние несколько лет (Berceanu). При последних в капиллярной стенке преципитируют макроагрегаты иммунных комплексов антиген-антитело, которые часто встречаются при автоиммунных заболеваниях, таких как красная волчанка или хронические селфпродолжающиеся васкулиты, как это описано в связи с хронической пурпурой Шенлейн-Геноха с эволюцией к висцерализации.
Особая форма пурпурового васкулита появляется и при первичных или вторичных амилоидозах, иногда в рамках лимфом, в том числе болезни Ходжкина, и миэлом с длительной эволюцией, но и при красной волчанке и дисгаммаглобулинемии после вялотекущего эндокардита.
При всех этих васкулопатиях существуют некоторые общие механизмы образования пурпуровых сосудистых поражений, а также и других геморрагических явлений. В основном, моноклональные глобулиновые агрегаты, как IgM и реже IgG или IgA при миеломах, или поликлональные, по поводу иммунных комплексов или агрегатов IgG — IgM (ревматоидный фактор) при красной волчанке, детерминируют изменения сосудистой пермеабильности благодаря поражениям эндотелия, сопровождающихся или не сопровождающихся воспалительными реакциями.
Кроме этого, глобулиновые комплексы в избытке, наряду с физико-плазматическими изменениями с повышением вязкости, с модификациями циркуляторной динамики депонируются и обволакивают оболочки эритроцитов, лейкоцитов и тромбоцитов и ингибируют их аггрегацию в первичной фазе коагуляции. Взаимосвязь тромбоциты — сосуд глубоко альтерирована, так как оба компонента оказываются модифицированными благодаря отложению глобулиновых аггрегатов. К этому следует добавить, что в особенности при моноклональных формах происходят альтерации факторов коагуляции, особенно факторов V, VII, X, XI, XII.
Происходят ингибиции во время реакции выведения тромбоцитарных факторов с пониженными высвобождениями F3, а также и физические изменения фибриногена,, который порочно полимеризуется в фибрин. Вместе с криоглобулинами, которые могут появляться в этих условиях, может появляться и криофибриноген, который глубоко альтерирует последнюю фазу коагуляции. Комплексное участие нескольких патогенетических факторов объясняет, почему при некоторых геморрагических синдромах по поводу дисглобулинемий преобладают пурпуровые синдромы, в то время как при других появляются геморрагии типа коагулопатии. Первые происходят по поводу альтерации сосудистых стенок и тромбоцитов. В остальных преобладает интерференция факторов коагуляции.
Существуют также и случаи моноклональных и поликлональных гипергаммаглобулинемий при хронических гепатических заболеваниях, которые усугубляют геморрагические расстройства другого рода в этих условиях.
Среди различных форм васкулопатий по поводу гаммапатий недавно были выделены две специальные группы, сами по себе весьма гетероморфные: криоглобулинемии, обычно с тяжелой эволюцией, и доброкачественные гипергаммаглобулинемические пурпуры, причем последние известны уже давно (Schwartz и Frei, Kyle и сотр., Goltz и Good). Как упоминалось выше, говоря о разнообразных условиях возникновения дисгаммаглобулинемии, существует возможность появления макроаггератов благодаря криофибриногену.
Сосудистые пурпуры при доброкачественных моноклональных гаммапатиях происходят посредством того же механизма — преципитации гаммаглобулиновых аггрегатов; следует отметить возможность возникновения лимфоидной или плазмоцитарной злокачественной пролиферации, как это указывалось еще в первые наблюдения (Kyle и сотр.). Из наших собственных наблюдений вытекает, что пурпуровые синдромы при доброкачественных моноклональных гаммапатиях встречаются редко (Sighetea и сотр.).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое вторичный иммунодефицит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бычковой Е.Ю., остеопата со стажем в 22 года.
Определение болезни. Причины заболевания
Вторичный иммунодефицит формируется у людей старше 6 лет с исходно нормальным иммунитетом. До этого возраста происходит созревание иммунной системы, особенно полноценных механизмов противоинфекционной защиты, поэтому частое развитие инфекционных заболеваний у детей младше 6 лет не является признаком патологии.
Появление вторичного иммунодефицита обычно связано с воздействием окружающей среды или каких-либо других факторов, но у многих из пациентов можно выявить генетическую предрасположенность к нарушению иммунитета.
Иммунологически здоровый организм способен контролировать и предотвращать развитие инфекций и опухолевых процессов, то есть осуществлять иммунологический контроль внутренней среды.
Когда можно заподозрить вторичный иммунодефицит
Причины развития вторичных иммунодефицитных состояний:
Иммунодефицитные состояния у детей
Развитию иммунодефицита у детей, как и у взрослых, способствуют:
Дисбактериоз у матери является причиной дисбактериоза у ребёнка с последующим замедлением и неполноценным созреванием иммунной системы. Каждый курс антибиотикотерапии может усугубить это состояние.
Проявления иммунодефицита зависят от степени его выраженности, они сопровождаются частыми ОРВИ с инфекционными осложнениями, эпизодами лихорадки, болезненностью, увеличением лимфоузлов, болью в животе, рвотой и нарушением стула.
Симптомы вторичного иммунодефицита
Как проявляется вторичный иммунодефицит
Клинические проявления вторичного иммунодефицита разнообразны. Очень часто на первый план выходят симптомы основного заболевания, которое привело к развитию иммунодефицита. Но основные проявления проблем с иммунитетом, которые указывают на необходимость иммунологического обследования, всё же присутствуют. К ним относятся:
Все хронические инфекции и воспаления протекают на фоне ослабленной иммунной защиты. Поэтому любая хронизация инфекции будет указывать на несостоятельность иммунитета, который не может справиться с болезнью в ходе острого воспалительного процесса.
Патогенез вторичного иммунодефицита
В течение жизни организм подвергается воздействию различных повреждающих факторов, вызывающих вторичный иммунодефицит. Они приводят к угнетению реакций клеточного иммунитета, снижению лейкоцитов и интерферонов — белков иммунной системы, которые вырабатываются лейкоцитами и иммунными клетками и блокируют распространение вируса. Вследствие этого появляются хронические инфекционно-воспалительные процессы, часто рецидивирующие.
Опухоли, возникающие в организме с ослабленной иммунной защитой, истощают иммунитет по мере своего роста, а проводимое лечение (операция, лучевая и химиотерапия) усугубляют возникший иммунодефицит. В этом случае страдает клеточное звено иммунитета:
Классификация и стадии развития вторичного иммунодефицита
По причине возникновения выделяют:
По форме вторичный иммунодефицит может быть:
По продолжительности выделяют два типа вторичного иммунодефицита:
По локализации основного дефекта различают:
Установить локализацию повреждения иммунной системы, основываясь только на симптомах, без лабораторного исследования иммунного статуса, практически невозможно: сходная клиническая картина может наблюдаться при разных типах вторичного дефицита. Например, склонность к вирусным инфекциям может встречаться как при Т-клеточном дефиците, так и при дефиците системы интерферонов.
Осложнения вторичного иммунодефицита
Вторичный иммунодефицит, развивающийся на фоне инфекции и/или воспаления, становится причиной тяжёлых жизнеугрожающих состояний. Без своевременной коррекции иммунитета патологический круг замыкается: течение основной болезни ухудшается.
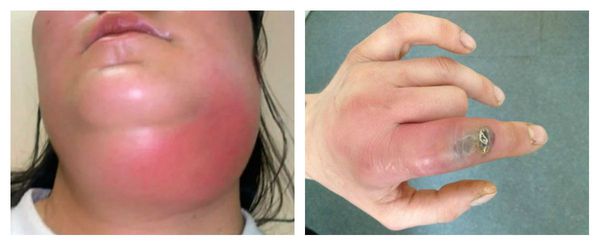
Наиболее частыми осложнениями вторичного иммунодефицита являются тяжёлые инфекционные заболевания: пневмония, сепсис, абсцесс и флегмона. Их основные проявления: высокая температура и признаки воспаления. При пневмонии наблюдается одышка, кашель и боль в грудной клетке. Сепсис является жизнеугрожающим состоянием, он развивается при попадании в кровь инфекции, сопровождается системной воспалительной реакцией и полиорганной недостаточностью. При абсцессах и флегмоне в организме присутствует очаг гнойного воспаления с выраженной болью, отёком и гиперемией (покраснением).
Диагностика вторичного иммунодефицита
Диагноз «вторичный иммунодефицит» ставится на основании истории болезни, физикального обследования и оценки статуса иммунной системы.
Чтобы назначить эффективных мер по коррекции иммунитета, важно выявить факторы, которые поспособствовали развитию иммунодефицита. Поэтому на консультацию к врачу-иммунологу стоит принести все имеющиеся обследования, а врач будет очень подробно расспрашивать о перенесённых заболеваниях, проведённом лечении, операциях и образе жизни пациента.
Как распознать вторичный иммунодефицит
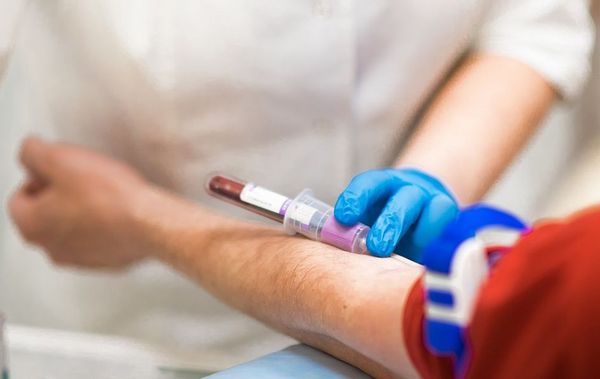
При подозрении на вторичный иммунодефицит врач назначает анализ крови и иммунограмму — иммунологические тесты, которые оценивают компоненты иммунной системы с точки зрения количества и качества.
Схема обследования различных звеньев иммунной системы (иммунограмма):
На вторичный иммунодефицит могут указывать как пониженные, так и повышенные показатели иммунограммы.
При подозрении на дисбаланс ключевых нутриентов (витаминов, микроэлементов и т. д.) врач-иммунолог может назначить исследования:
В своём заключении врач-иммунолог может указать «вторичный иммунодефицит» как основной или сопутствующий диагноз. Всё зависит от клинической картины.
Лечение вторичного иммунодефицита
Лечение пациента с вторичным иммунодефицитом проводится совместно с врачом, который курирует пациента по поводу основного заболевания. Задача врача-иммунолога заключается в подборе иммунокорригирующей терапии.
«Коррекция иммунитета» в данном случае подразумевает восстановление ослабленной иммунной защиты, исправление дисбаланса её компонентов и иммунных реакций, ослабление патологических иммунных процессов и подавление аутоиммунных реакций.
Лечение вторичного иммунодефицита начинают с определения и устранения его причины. Например, при нарушении иммунитета, вызванном инфекционно-воспалительным процессом, устраняются очаги хронического воспаления.
Если вторичный иммунодефицит возник в результате витаминно-минеральной недостаточности, то назначаются комплексы, содержащие дефицитные компоненты. Например, при истощении лимфоузлов и старении вилочковой железы назначают витамины В6. При обострении или начале аутоиммунных и лимфопролиферативных заболеваний показаны витамины Е.
Важными минералами для иммунной системы являются цинк, йод, литий, медь, кобальт, хром, молибден, селен, марганец и железо. Эти микроэлементы помогают активировать ферменты, которые участвуют в иммунных реакциях. К примеру, цинк предотвращает гибель клеток иммунной системы.
Заместительное лечение вторичного иммунодефицита
Заместительная терапия помогает предотвратить инфекции. Для этого применяют:
Иммунотропное лечение вторичного иммунодефицита
При остром инфекционном воспалении иммуностимуляторы позволяют:
При хроническом инфекционном воспалении иммуномодуляторы:
На степень эффективности иммунокоррекции влияет кратность приёма и стадия заболевания. Срок действия иммуномодуляторов зависит от характера препарата, показателей иммунного статуса и вида заболевания, вызвавшего вторичный иммунодефицит.
Устранение дефицита одного звена иммунитета может привести к компенсации другого звена, так как иммунная система работает по принципу взаимосвязанных модулей.
Может быть назначен как один иммуномодулятор, так и несколько, то есть их комбинация. При комбинированной иммунокоррекцией последовательно или одновременно принимают несколько модуляторов, обладающих разными механизмами действия. Таких иммуномодулирующих препаратов сейчас довольно много.
Показаниями для комбинированной иммунотерапии являются:
ВАЖНО: Самостоятельно назначать себе иммунокорректоры нельзя, так как их бесконтрольное применение может спровоцировать развитие вторичного иммунодефицита.
Прогноз. Профилактика
При вторичном иммунодефиците работа иммунной системы нарушена слабее, чем при первичном. В большинстве случаев выявляется несколько факторов, подавляющих иммунный ответ.
Прогноз определяется тяжестью основного заболевания. Например, если иммунодефицит возник из-за нехватки витаминов или нарушения режима труда и отдыха, он намного легче компенсируется, чем иммунодефицит, спровоцированный опухолевым процессом, сахарным диабетом или ВИЧ-инфекцией.
У детского организма отдельные звенья иммунной системы ещё незрелы: Т-лимфоциты только начинают «знакомиться» с различными инфекциями, поэтому ребёнок часто болеет ОРВИ. Со временем нарабатываются «клетки памяти». По мере взросления формируется широкий «репертуар» Т-лимфоцитов, способных распознавать и быстро запустить иммунный ответ, в связи с чем заболеваемость снижается.
С возрастом иммунная система стареет: в ответ на новые антигены участвует меньше Т-клеток, ухудшается кооперация между клетками иммунной системы, фагоциты хуже поглощают вирусы и мёртвые клетки. Поэтому многие инфекционно-воспалительные заболевания у пожилых людей протекают значительно тяжелее и чаще дают осложнения.
Первичная профилактика вторичного иммунодефицита заключается в ведении здорового образа жизни, сбалансированном питании, отказе от курения. Всё это позволяет предупредить развитие различных заболеваний.
Вторичная профилактика направлена на своевременное лечение инфекционных и общесоматических заболеваний.
Людям с вторичным иммунодефицитом нужны «особые условия», которые не позволят усугубить нарушение иммунитета. Пациентам следует:
Вакцинотерапия
Вакцинация проводится в соответствии с национальным календарем прививок. Перед введением вакцины нужно скомпенсировать иммунодефицит: пропить курс витаминов, минералов и иммуномодуляторов по назначению врача. Это позволит сформировать иммунный ответ на прививку и снизить риск осложнений.