днк вакцина что это такое
Новые технологии производства вакцин: генетическая иммунизация и «обратная вакцинология»
Создавать вакцины против новых инфекций, используя старые испытанные технологии, удается не всегда. Некоторые микроорганизмы, например, вирус гепатита B, практически невозможно вырастить в культуре клеток, чтобы получить инактивированную вакцину. Во многих случаях вакцины на основе убитых микробов оказываются неэффективными, а живые вакцины — слишком опасными. Большие надежды возлагались на вакцины, полученные на основе рекомбинантных белков-антигенов (именно таким способом в 1980-е годы создали вакцину, защищающую от гепатита B). Но сейчас стало очевидным, что многие рекомбинантные вакцины вызывают слабый иммунный ответ. Вероятно, причина в том, что в таких препаратах содержится «голый» белок и отсутствуют другие молекулярные структуры, часто необходимые для запуска иммунного ответа. Чтобы рекомбинантные вакцины вошли в практику, нужны вещества-усилители (адъюванты), стимулирующие антигенную активность.
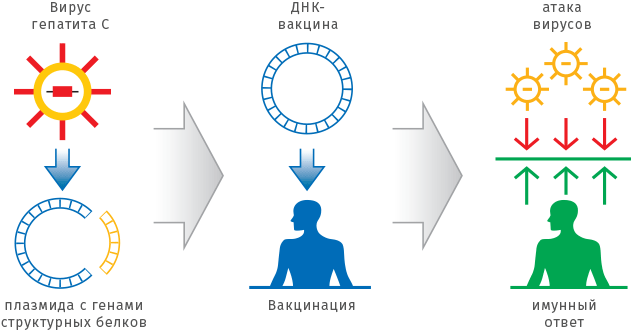
За последние 10 лет сформировалось новое направление — генетическая иммунизация. Его называют также ДНК-вакцинацией, поскольку в организм вводят не белок-антиген, а нуклеиновую кислоту (ДНК или РНК), в которой закодирована информация о белке. Реальная возможность использовать эту технологию в медицине и ветеринарии появилась в середине 90-х годов прошлого века. Новый подход достаточно прост, дешев и, самое главное, универсален. Сейчас уже разработаны относительно безопасные системы, которые обеспечивают эффективную доставку нуклеиновых кислот в ткани. Нужный ген вставляют в плазмиду (кольцо из ДНК) или в безопасный вирус. Такой носитель-вектор проникает в клетку и синтезирует нужные белки. Трансформированная клетка превращается в «фабрику» по производству вакцины прямо внутри организма. Вакцинная «фабрика» способна работать длительный период — до года. ДНК-вакцинация приводит к полноценному иммунному ответу и обеспечивает высокий уровень защиты от вирусной инфекции.
ДНК-вакцинация заключается в том, чтобы ввести фрагмент ДНК, кодирующий защитные антигены и цитокины, непосредственно в мышечную ткань. «Заразность» большинства вирусов во многом определяется их структурными белками. Плазмида (кольцевая молекула ДНК) с генами таких белков, введенная в мышцу, стимулирует иммунный ответ, который препятствует развитию заболевания.
Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Вакцины «по расчету»: «обратная вакцинология»
Бурное развитие в последнее десятилетие геномики, биоинформатики и протеомики привело к совершенно новому подходу в создании вакцин, получившему название «обратная вакцинология» (reverse vaccinology). Этот термин четко выражает суть нового технологического приема. Если раньше при создании вакцин ученые шли по нисходящей линии, от целого микроорганизма к его составляющим, то теперь предлагается противоположный путь: от генома – к его продуктам. Такой подход основан на том, что большинство защитных антигенов — белковые молекулы. Обладая полными знаниями обо всех белковых компонентах любого возбудителя заболевания, можно определить, какие из них годятся в качестве потенциальных кандидатов на включение в состав вакцинного препарата, а какие — нет.
Чтобы определить нуклеотидную последовательность полного генома инфекционного микроорганизма, достаточно если не нескольких дней, то нескольких недель. Причем предварительная работа по получению «библиотек» клонов ДНК возбудителя уже давно выполняется с помощью стандартных наборов ферментов. Современные приборы для автоматического определения нуклеотидной последовательности в молекулах ДНК позволяют проводить в год до 14 млн реакций. Полная расшифровка генома и его описание со списком кодируемых белков занимают несколько месяцев.
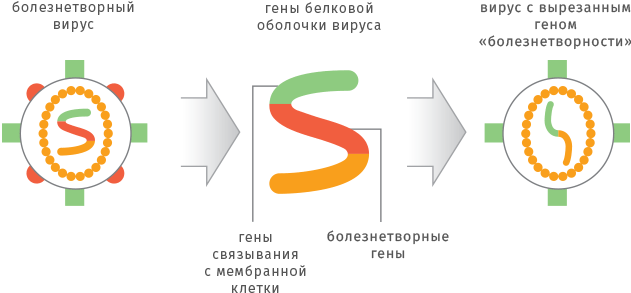
Рекомбинантные технологии позволяют получить ослабленный вирус за более короткое время. Для этого из генома вируса «вырезают» ген, который отвечает за вирулентность (болезнетворные свойства), но не влияет на размножение и иммуногенность. Получившийся безобидный вирусный штамм используют для изготовления вакцины.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Другой подход к отбору кандидатов в вакцины — определение активности отдельных генов микроорганизмов. Для этого одновременно измеряют уровень синтеза матричной РНК всех продуктов генов, производимых в клетке. Такая технология позволяет «вычислить» гены, вовлеченные в процесс распространения инфекции.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Впервые принцип «обратной вакцинологии» использовали для получения вакцины против менингококков группы B. За последние годы таким способом разработаны вакцинные препараты против стрептококков Streptococcus agalactiae и S. pneumoniae, золотистого стафилококка, бактерии Porphyromonas gingivalis, вызывающей воспаление десен, провоцирующего астму микроорганизма Chlamydia pneumoniae и возбудителя тяжелой формы малярии Plasmodium falciparum.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Обычные вакцины предназначены для предупреждения болезни: прививку делают здоровому человеку, чтобы заранее «вооружить» организм средствами борьбы с инфекцией (исключение — разработанная Пастером вакцина против бешенства, которую применяют после укуса бешеным животным; ее эффективность объясняется длительным инкубационным периодом этого вирусного заболевания). Но в последнее время отношение к вакцинам исключительно как к профилактическому средству изменилось. Появились терапевтические вакцины — препараты, которые индуцируют иммунный ответ у больных и тем самым способствуют выздоровлению или улучшению состояния. Такие вакцины нацелены на хронические заболевания, вызванные бактериями или вирусами (в частности, вирусами гепатитов B и C, вирусом папилломы, ВИЧ), опухоли (прежде всего, меланому, рак молочной железы или прямой кишки), аллергические или аутоиммунные болезни (рассеянный склероз, диабет I типа, ревматоидный артрит).
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.
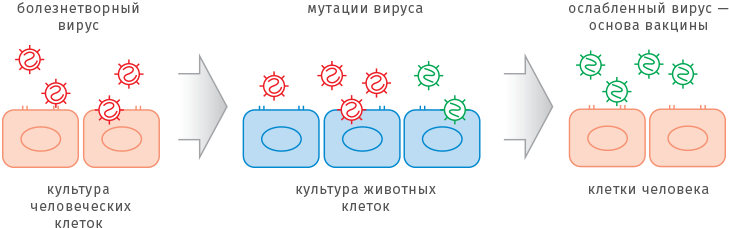
Один из традиционных методов ослабления вирусов — выращивание в животных клетках. Сначала болезнетворный вирус выделяют из культуры человеческих клеток. Выращивание вне человеческого организма само по себе ослабляет «заразность» вируса. Для некоторых заболеваний, например, краснухи, такой подготовки бывает достаточно, чтобы получить вакцинный штамм. Однако в общем случае для того, чтобы получить ослабленный штамм, вирус пересаживают в среду, приготовленную из клеток животных. Благодаря мутациям вирус приспособится к новой среде обитания. Для создания вакцины ученые отбирают те разновидности вирусов-мутантов, которые плохо растут на человеческих клетках, а значит, не могут вызвать болезнь.
Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Большие надежды в лечении нарушений иммунитета при раковых заболеваниях связаны с дендритными вакцинами. Их делают на основе дендритных клеток — особой разновидности лейкоцитов, которые занимаются поиском потенциально опасных микроорганизмов. Дендритные клетки «патрулируют», прежде всего, слизистые оболочки и кожу, то есть органы, контактирующие с внешней средой. Встретив патогенную бактерию или вирус, дендритные клетки поглощают «чужака» и используют его белки-антигены для того, чтобы активизировать иммунную систему на борьбу с врагом.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
Дендритные вакцины можно использовать для лечения как спонтанных опухолей, так и новообразований, ассоциированных с вирусами. Первые результаты испытания дендритных противораковых вакцин на людях (в небольших группах пациентов IV стадии заболевания) показали безвредность таких вакцин, а в ряде случаев зарегистрирован положительный клинический эффект.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.
В XX веке успехи вакцинологии определялись, прежде всего, победами над очередной опасной инфекцией. С развитием наших представлений о работе иммунной системы сфера применения вакцин постоянно расширяется. Есть надежда, что в XXI веке вакцины помогут снизить заболеваемость диабетом, миокардитом, атеросклерозом и другими «неинфекционными» болезнями. Полным ходом идет разработка препаратов для иммунопрофилактики и иммунотерапии онкологических заболеваний.
Национальный Фармацевтический журнал
Войти на сайт
ВАКЦИНЫ ПРОТИВ COVID-19 И АДЪЮВАНТЫ, УЛУЧШАЮЩИЕ ИХ СВОЙСТВА.

Новый адъювант для профилактических вакцин компании SEPPIC

• вакцины на основе цельного (полногеномного) ослабленного вируса;
• инактивированные вакцины на основе полностью нежизнеспособного вируса;
• векторные вакцины;
• генетические вакцины (ДНК и РНК вакцины);
• субъединичные вакцины на основе отдельных компонентов патогена, таких как белки, пептиды или генетический материал (например, белковые или рекомбинантные вакцины). Разработчики из различных стран на основании накопленных знаний и имеющихся у них результатов и методов исследований выбирают для разработки тот тип вакцины, который считают наиболее действенным для обеспечения эффективной защиты людей от вируса SARS-CoV-2 (Рис.1).
На настоящий момент среди вакцин-кандидатов против COVID-19, зарегистрированных в списке ВОЗ, можно найти практически все из вышеназванных типов вакцин. Коротко напомним, что представляет собой каждый из них и чем они отличаются друг от друга.

Векторные вакцины – это также вакцины на основе живых вирусов, однако здесь есть небольшой, но очень важный нюанс: это вакцины на основе хорошо изученных и достаточно безобидных для человека вирусов («векторов» или вспомогательных транспортных вирусов) с встроенными в них фрагментами генома «злого вируса» (Рис. 3). В случае векторных вакцин в геном хорошо изученного и, в целом, безобидного вируса, например, аденовируса («вектора»), путём генетических модификаций встраивается небольшой ген – участок генома SARS-CoV-2. При вводе в организм такой векторной вакцины генетически модифицированные вспомогательные вирусы провоцируют такой же сильный иммунный ответ на белки-антигены SARS-CoV-2, как в случае «живой» полногеномной вирусной вакцины.
Преимущество указанных вакцин, по замыслу разработчиков, в той же высокой эффективности, что и у вакцин на основе живых ослабленных вирусов, но в большей управляемости в связи с достаточной изученностью и предсказуемостью «вектора»-носителя. Векторные вакцины начали разрабатываться и изучаться относительно недавно, поэтому к массовому применению вакцин этого типа ученые также подходят с должной и необходимой осторожностью.

Еще два перспективных типа вакцин против COVID-19, разрабатываемые мировым сообществом, – вакцины на основе нуклеиновых кислот, а именно, ДНК- и РНК-вакцины. В случае ДНК-вакцины нуклеотидная последовательность, кодирующая антиген SARS-CoV-2, встраивается в вектор – бактериальную плазмиду – небольшую стабильную кольцевую молекулу ДНК, способную к автономной репликации. Сама по себе плазмида не вызывает нужного специфического иммунного ответа, для этого, собственно, в неё и вшивают гены иммуногенных белков. Указанный модифицированный геном направляется в клетку, встраивается в ее ядро и образует вирусный белок (антиген), индуцирующий иммунный ответ.
Согласно замыслу разработчиков, ДНК-вакцины не могут вызвать заражение SARS-Cov-2, однако иммунитет, который они обусловливают, должен оказаться таким же сильным, как в случае «живых» вакцин. Тем не менее, влияние ДНК-вакцин на живые организмы изучено еще в меньшей степени, чем влияние векторных вакцин, поэтому вряд ли в ближайшее время ДНК-вакцины будут допущены к массовому применению на людях. 
В случае применения РНК-вакцины получается двойной иммунный ответ: с одной стороны, выработку антител вызывают вирусные белки, с другой стороны, сами липидные частицы с мРНК могут стимулировать иммунный ответ, так как «похожи на вирус» и воспринимаются организмом соответственно. Разработчики предполагают, что при вакцинации РНК-вакцинами из-за их «двойного действия» в организме быстро возникнет сильный и стойкий иммунитет.
В случае генетических вакцин преимуществом является их относительно быстрое и экономически выгодное производство: небольшую молекулу мРНК можно довольно быстро воссоздать, наработка нужного антигена обойдется недорого. Это делает вакцину доступной широким массам. Тем не менее иммунологи очень осторожно относятся к РНК-вакцинам, так как из-за малого периода их изучения никто не знает наверняка, как именно мРНК будет вести себя в живом, особенно в репродуктивном, организме.

Одним из самых безопасных типов вакцин в настоящее время считаются субъединичные вакцины, то есть вакцины на основе белков или фрагментов вируса (Рис. 6), не имеющих в своем составе ни ДНК, ни РНК как, например, белковые вакцины.
Попадая в организм при вакцинации, смесь фрагментов вирусных белков-антигенов также способна вызывать иммунный ответ. При этом такая вакцина абсолютно безопасна, здесь невозможны мутации вируса, поэтому вызвать у человека заболевание COVID-19 такая вакцина не может. Недостатком субъединичных вакцин является довольно длительный и сложный процесс наработки и очистки – получить достаточное для вакцинации очищенное количество вирусного белка не так легко. Кроме того, в чистом виде белковые вакцины не вызывают сильный иммунный ответ, поэтому недостаточно эффективны. В связи с этим при разработке белковых вакцин очень важно:
а) усилить иммунный ответ, вводя в состав белковых вакцин соединения, усиливающие их эффективность (эти вещества называют адъюванты),
б) увеличить количество нарабатываемой вакцины также за счет добавления к наработанному вирусному белку существенного количества того же адъюванта.

Наконец, мы подошли к еще одному безопасному и перспективному типу вакцин – инактивированным вакцинам. Здесь так же, как и в случае «живых» вакцин на основе ослабленного вируса используется цельный геном SARS-Cov-2, но в случае инактивированных вакцин вирус полностью деактивирован либо высокой температурой, либо дезинфицирующими составами, либо определенным видом излучения, что делает его совершенно нежизнеспособным. Этот инактивированный вирус никогда не сможет инфицировать клетку. Тем не менее по структуре «неживой» инактивированный вирус остается полным аналогом «живого» вируса и поэтому вызывает в организме иммунный ответ. Проблема в том, что в чистом виде инактивированные вирусы индуцируют существенно более низкий иммунный ответ, нежели живые, пусть даже и ослабленные вирусы. В связи с этим в составах инактивированных вакцин так же, как и в случае субъединичных вакцин используют адъюванты – вещества, которые значительно усиливают иммунный ответ, делая эти вакцины схожими по эффективности с живыми.
Основываясь на вышесказанном, мы склоняемся к выводу, что наиболее безопасными для человека являются субъединичные и инактивированные вакцины. Для повышения эффективности указанных безопасных вакцин до уровня более иммуногенных «живых», векторных или генетических вакцин необходимо применение в их составах современных адъювантов. Что же такое адъюванты и какова их роль в вакцинах?

Адъювант (от лат. adjuvans – «помогающий, поддерживающий») – соединение или комплекс веществ, используемых для усиления иммунного ответа при введении одновременно с антигеном.
Адъюванты на протяжении десятилетий применяются для улучшения иммунного ответа на вакцинные антигены. Включение адъювантов в состав вакцин направлено на усиление, ускорение и продление специфического иммунного ответа до желаемого уровня. Таким образом, адъюванты играют ключевую роль в получении эффективного и длительного иммунитета.
Использование адъювантов в вакцинах позволяет:
• Усилить краткосрочный иммунный ответ;
• Увеличить продолжительность иммунитета, то есть сократить частоту требуемых бустерных иммунизаций;
• Направить иммунный ответ (гуморальный или клеточный иммунитет);
• Уменьшить антигенную нагрузку при сохранении эффективности вакцины;
• Улучшить иммунный ответ у ослабленных или иммунокомпроментированных вакцинируемых лиц;
• Снизить себестоимость вакцины;
• Повысить стабильность вакцины.
Интерес к адъювантам для вакцин резко возрос в 2000-е годы. Ведущие фармацевтические компании-производители путем применения адъювантов разработали более эффективные и безопасные вакцины против гриппа.
В последние годы появляется все больше и больше новых вакцин-кандидатов как для профилактики инфекционных заболеваний, так и для терапии самых тяжелых заболеваний человечества. В связи с низкой иммуногенностью таких вакцин во многих случаях требуется введение в их состав адъювантов. Новые достижения в области аналитической биохимии, очистке макромолекул, технологии рекомбинантной ДНК, улучшенное понимание иммунологических механизмов и патогенеза заболевания позволили улучшить техническую основу разработки и применения адъювантов.
В настоящее время известно довольно много эффективных адъювантов, которые классифицируются по природе происхождения, механизму действия и физическим или химическим свойствам.
Так, в современных вакцинах широко применяются гели гидроксида алюминия, фосфаты алюминия или кальция, препараты на основе масляных эмульсий и ПАВ, дисперсные адъюванты, например, виросомы, структурные комплексы сапонинов и липидов и многие другие типы адъювантов.
Как уже упоминалось выше, наиболее эффективно и поэтому чаще всего адъюванты используются в следующих категориях вакцин:
• вакцины на основе белков (рекомбинантные субъединичные);
• инактивированные;
• векторные вакцины (для уменьшения дозы).
Для каждой вакцины адъювант подбирается таким образом, чтобы получить оптимальное соотношение эффективности указанной вакцины (получение сильного и продолжительного иммунного ответа) и ее безопасности для человека (минимальная реактогенность и отсутствие побочных эффектов).
К сожалению, немаловажным аспектом уже зарегистрированных в настоящее время адъювантов является их недоступность широкому кругу разработчиков. Практически все имеющиеся на настоящий момент современные адъюванты, применяемые в профилактических вакцинах, за исключением соединений алюминия, являются собственностью крупнейших фармацевтических компаний (см. табл. 2). В первую очередь, к ним относятся адъюванты для приготовления эмульсионных вакцин. Эти адъюванты на настоящий момент считаются наиболее перспективными в профилактических вакцинах, но остаются при этом и наименее доступными, так как были специально разработаны крупными биофармацевтическими компаниями исключительно для вакцин собственного производства.
Эти недоступные широкому кругу разработчиков адъюванты ведущих фармацевтических компаний отлично зарекомендовали себя в составах готовых вакцин указанных производителей. К примеру, эмульсионные адъюванты масло-в-воде MF59, AS03 и AF03 продемонстрировали высокую эффективность в вакцинах против гриппа. Сегодня вакцинами на их основе провакцинировано >120 миллионов человек, их профиль безопасности и иммуногенности тщательно и глубоко изучен и подтвержден на значительном количестве клинических испытаний (см. табл. 3).

Франсуа Бертран, руководитель направления разработки и производства адъювантов компании Seppic, в своем выступлении по поводу выпуска адъюванта SEPIVAC TM SWE на мировой рынок сказал: «Указанная разработка иллюстрирует наше общее стремление привнести готовый эффективный и общедоступный адъювант в мировое сообщество разработчиков вакцин. Мы твердо верим, что SEPIVAC TM SWE ускорит разработку новых профилактических вакцин для людей и будет способствовать более здоровому будущему человечества во всем мире».