Глюкозиды что это такое список препаратов
Глюкозиды что это такое список препаратов
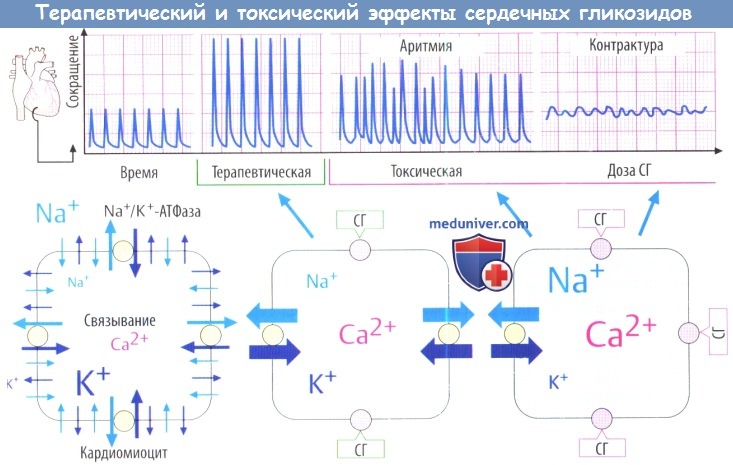
В некоторых растениях находятся сахаросодержащие вещества (гликозиды), повышающие сократительную способность сердечной мышцы: кардиотонические гликозиды, кардиостероиды, наперстянка. Кардиостероиды обладают небольшим терапевтическим диапазоном, при интоксикации развивается аритмия и контрактура (В).
Показания к применению сердечных гликозидов (СГ):
1) хроническая застойная сердечная недостаточность;
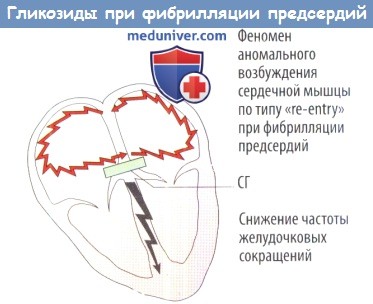
2) фибрилляция или трепетание предсердий, при этом угнетение АВ-проводимости защищает желудочки от чрезмерной импульсной активности предсердий и тем самым улучшает работу сердца (D).
Признаки интоксикации:
1) нарушения сердечного ритма, которые при определенных обстоятельствах представляют опасность для жизни, например: синусовая брадикардия, АВ-блокада, желудочковая экстрасистолия. фибрилляция желудочков (ЭКГ);
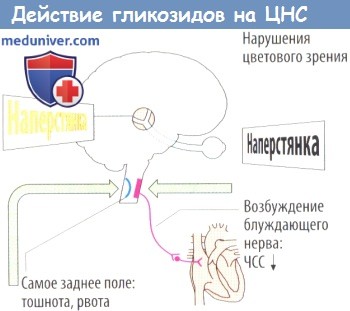
2) нарушения со стороны ЦНС: характерно нарушение цветового зрения (ксантопсия), также появляются усталость, дезориентация, галлюцинации;
3) анорексия, тошнота, рвота, диарея;
4) нарушения со стороны почек: потеря электролитов и воды; этот эффект следует отличать от выведения излишков жидкости, аккумулированной во время застойной сердечной недостаточности (этот эффект ожидается при достижении терапевтической дозы).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сердечные гликозиды
К сердечным гликозидам (могут быть растительного, полусинтетического или синтетического происхождения) относятся соединения специфической химической структуры, которые при гидролизе расщепляются на сахара (гликоны) и бессахаристую часть (агликоны или генины). Сердечные гликозиды содержатся во многих растениях (наперстянка, горицвет, желтушник, строфант, олеандр, морозник, ландыш, обвойник), хотя большинство из них в настоящее время исключено из номенклатуры лекарственных средств. В клинической практике применяются в основном гликозиды наперстянки, строфанта и ландыша
Фармакологическое действие
Кардиотоническое действие сердечных гликозидов обусловлено свойствами входящих в состав молекулы агликонов. Остатки сахаров кардиотонической активностью не обладают, но влияют на степень растворимости гликозидов, способность проникать через клеточные мембраны, связываться с белками плазмы крови и тканей и, соответственно, на токсичность.
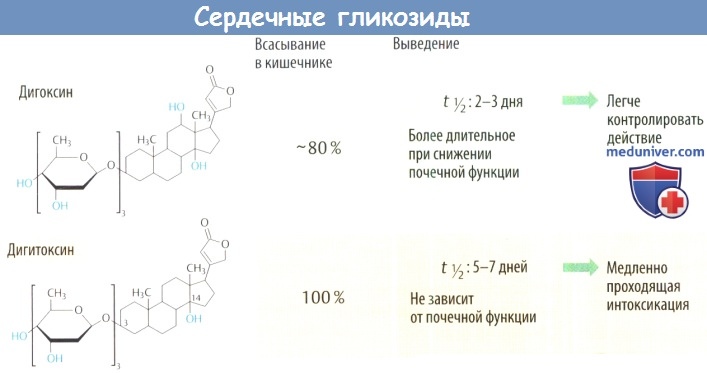
По физико-химическим свойствам сердечные гликозиды подразделяют на полярные и неполярные. Полярные (основной представитель — строфантин) плохо всасываются в пищеварительном тракте, поэтому их применяют внутривенно. В основном выделяются почками, поэтому при нарушении выделительной функции дозу снижают. Оказывают относительно кратковременное действие.
Неполярные (липофильные) гликозиды (основной представитель — дигитоксин) хорошо всасываются в кишечнике и выводятся с желчью. Применяются перорально или ректально (в форме суппозиториев).
Промежуточные гликозиды (основной представитель — дигоксин) хорошо всасываются в пищеварительном тракте, в основном мере выделяются почками. Можно применять как перорально, так и внутривенно.
Таким образом, сердечные гликозиды:
Показания к применению и способ введения
Выбор препарата и способа введения зависит от показаний. При острой сердечно-сосудистой недостаточности, внезапно возникшей декомпенсации и в других случаях, когда необходима немедленная помощь, сердечные гликозиды вводят внутривенно.
При хронической сердечной недостаточности, а также для поддерживающей терапии после устранения явлений острой сердечно-сосудистой недостаточности применяют пероральные препараты (дигитоксин, дигоксин).
Обычно при хронической сердечной недостаточности лечение проводят в 2 фазы:
I фаза («насыщающая») — достижение компенсации сердечной деятельности; назначают парентеральные или пероральные препараты;
II фаза («поддерживающая») — поддержание достигнутой компенсации; назначают пероральные средства; эта фаза может быть длительной, иногда пожизненной.
Побочное действие
Применяемые в высоких дозах сердечные гликозиды могут вызвать тошноту и рвоту, что обусловлено их непосредственным влиянием на рвотный центр и хемочувствительные рецепторные зоны, а также раздражающим действием на слизистую оболочку желудка. Рвотный эффект может быть обусловлен рефлексами, возникающими при возбуждении рецепторов сердца. Возможны потеря аппетита, понос, нарушения со стороны ЦНС (головная боль, беспокойство, бессонница, депрессивные явления, нарушения зрения).
При введении в подкожную жировую клетчатку растворы сердечных гликозидов оказывают раздражающее действие.
Общие противопоказания к применению сердечных гликозидов
Выраженная брадикардия, атриовентрикулярная блокада различной степени, синдром Адамса — Стокса — Морганьи, стенокардия (относительное противопоказание). С осторожностью назначают при инфаркте миокарда (применение возможно только при выраженной сердечной недостаточности с дилатацией миокарда).
При шоке или отсутствии признаков сердечной недостаточности сердечные гликозиды противопоказаны.
NB! Препараты сердечных гликозидов относятся к категории сильнодействующих, поэтому при их применении необходима осторожность! В связи со способностью к кумуляции токсическое действие может проявляться при длительном применении в обычных дозах
Токсичность сердечных гликозидов
Передозировка сердечных гликозидов может привести к резкой брадикардии, политопной экстрасистолии, бигеминии или тригеминии, замедлению предсердно-желудочковой проводимости. Токсические дозы могут вызвать трепетание желудочков и остановку сердца.
Применение препаратов кальция повышает токсичность сердечных гликозидов, а препаратов калия — снижает. Соответственно, одновременное длительное применение калий-истощающих диуретиков повышает риск токсичности сердечных гликозидов, применение калийсберегающих диуретиков — снижает.
NB! Препараты сердечных гликозидов обладают высоким потенциалом межмедикаментозных взаимодействий с серьезными, иногда опасными для жизни последствиями.
Перед применением внимательно ознакомьтесь с инструкцией!
Метаболические лекарственные средства в кардиологической практике
Основным патологическим состоянием, возникающим при многих заболеваниях сердечно-сосудистой системы, в частности при ишемической болезни сердца (ИБС), является гипоксия. Клинические данные свидетельствуют о том, что перспективным направлением в борьбе с г
Основным патологическим состоянием, возникающим при многих заболеваниях сердечно-сосудистой системы, в частности при ишемической болезни сердца (ИБС), является гипоксия. Клинические данные свидетельствуют о том, что перспективным направлением в борьбе с гипоксией является использование фармакологических средств, уменьшающих гипоксию и повышающих устойчивость организма к кислородной недостаточности.
Особый интерес представляют лекарственные средства метаболического действия, целенаправленно влияющие на обменные процессы при гипоксии. Это препараты различных химических классов, их действие опосредуется различными механизмами: улучшением кислород-транспортной функции крови, поддержанием энергетического баланса клеток, коррекцией функции дыхательной цепи и метаболических нарушений клеток тканей и органов [5, 8, 11]. Подобными свойствами обладают антигипоксанты (Актовегин, Гипоксен, Цитохром С), антиоксиданты (Убихинон композитум, Эмоксипин, Мексидол) и цитопротекторы (триметазидин), которые широко используются в клинической практике [3, 9, 12–15].
Антигипоксанты
Антигипоксанты — препараты, способствующие улучшению утилизации организмом кислорода и снижению потребности в нем органов и тканей, суммарно повышающие устойчивость к гипоксии.
Актовегин — мощный антигипоксант, активирующий метаболизм глюкозы и кислорода. Антиоксидантное действие Актовегина обусловлено высоко супероксиддисмутазной активностью, подтвержденной атомно-эмиссионной спектрометрией [1, 4]. Суммарный эффект всех этих процессов заключается в усилении энергетического состояния клетки, особенно в условиях исходной ее недостаточности.
Накопленный клинический опыт отделений интенсивной терапии позволяет рекомендовать введение высоких доз Актовегина: от 800–1200 мг до 2–4 г для профилактики синдрома реперфузии при остром инфаркте миокарда, после проведения тромболитической терапии или балонной ангиопластики, при тяжелой хронической сердечной недостаточности (ХСН) [4, 6].
Гипоксен — антигипоксант, улучшающий переносимость гипоксии за счет увеличения скорости потребления кислорода митохондриями и повышения сопряженности окислительного фосфорилирования. Его применение возможно при всех видах гипоксии.
Цитохром С — ферментный препарат, является катализатором клеточного дыхания. Железо, содержащееся в Цитохроме С, обратимо переходит из окисленной формы в восстановленную, в связи с чем применение препарата ускоряет ход окислительных процессов. При применении препарата возможны аллергические проявления.
Антиоксиданты
Антиоксиданты — соединения различной химической природы, способные обрывать цепь реакций свободнорадикального перекисного окисления липидов или непосредственно разрушать молекулы перекисей. Антиоксиданты участвуют в уплотнении структуры мембраны, что уменьшает доступность кислорода к липидам.
Убихинон (коэнзим Q10) — эндогенный антиоксидант и антигипоксант с антирадикальным действием. Он защищает липиды биологических мембран от перекисного окисления, предохраняет ДНК и белки организма от окислительной модификации.
Защитная роль коэнзима Q10 при ИБС обусловлена его участием в процессах энергетического метаболизма кардиомиоцита и антиоксидантными свойствами. Клинические исследования последних десятилетий показали терапевтическую эффективность коэнзима Q10 в комплексном лечении ИБС, артериальной гипертензии, атеросклероза и синдрома хронической усталости [2, 3]. В терапии больных ИБС Убихинон композитум может сочетаться с бета-адреноблокаторами и ингибиторами ангиотензинпревращающего фермента (ИАПФ). Накопленный клинический опыт позволяет рекомендовать применение коэнзима Q10 и как средство профилактики сердечно-сосудистых заболеваний. Лечебные дозы Убихинона составляют 30–150 мг/сут, профилактические — 15 мг/сут.
Препарат малоэффективен у больных с низкой толерантностью к физической нагрузке, при наличии высокой степени стенозирования коронарных артерий.
Эмоксипин является синтетическим антиоксидантным средством, обладающим широким спектром биологического действия. Он ингибирует свободнорадикальное окисление, активно взаимодействует с перекисными радикалами липидов, гидроксильными радикалами пептидов, стабилизирует клеточные мембраны. Может комбинироваться с изосорбида-5-мононитратом, что позволяет достичь большего антиангинального и противоаритмического эффектов, предотвратить развитие сердечной недостаточности.
Мексидол — оксиметилэтилпиридина сукцинат. Подобно Эмоксипину, Мексидол является ингибитором свободнорадикальных процессов, но оказывает более выраженное антигипоксическое действие.
Основные фармакологические эффекты Мексидола: активно реагирует с перекисными радикалами белков и липидов; оказывает модулирующее действие на некоторые мембрансвязанные ферменты (фосфодиэстеразу, аденилатциклазу), ионные каналы; обладает гиполипидемическим действием, снижает уровень перекисной модификации липопротеидов; блокирует синтез некоторых простагландинов, тромбоксана и лейкотриенов; оптимизирует энергосинтезирующие функции митохондрий в условиях гипоксии; улучшает реологические свойства крови, подавляет агрегацию тромбоцитов.
Клинические исследования подтвердили эффективность Мексидола при расстройствах ишемического генеза, в том числе при различных проявлениях ИБС.
Цитопротекторы
В последнее время возрос интерес к метаболическому направлению в лечении стабильных форм ИБС. Метаболически действующие препараты потенциально могут сохранить жизнеспособность миокарда (гибернирующий миокард) до проведения операции по восстановлению коронарного кровотока. Метаболическая терапия направлена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ИБС.
Возможные пути цитопротекции:
Из известных в настоящее время миокардиальных цитопротекторов наиболее изученным препаратом с доказанными антиангинальным и антиишемическим действиями является триметазидин, реализующий свое действие на клеточном уровне и воздействующий непосредственно на ишемизированные кардиомиоциты. Высокая эффективность триметазидина в лечении ИБС объясняется его прямым цитопротекторным антиишемическим действием. Триметазидин, с одной стороны, перестраивает энергетический метаболизм, повышая его эффективность, с другой — уменьшает образование свободных радикалов, блокируя окисление жирных кислот [10, 13].
Механизм действия триметазидина связан:
Указанные процессы помогают сохранить в кардиомиоцитах необходимый уровень АТФ, снизить внутриклеточный ацидоз и избыточное накопление ионов кальция.
Таким образом, противоишемическое действие триметазидина осуществляется на уровне миокардиальной клетки за счет изменения метаболических превращений, что позволяет клетке повысить эффективность использования кислорода в условиях его сниженной доставки и таким образом сохранить функции кардиомиоцита.
Триметазидин на российском фармацевтическом рынке представлен такими препаратами, как «Предуктал» (Франция), «Триметазид» (Польша), «Триметазидин», «Римекор» (Россия).
В многочисленных исследованиях убедительно продемонстрирована высокая антиангинальная и антиишемическая эффективность триметазидина у больных ИБС как при монотерапии, так и в комбинации с другими лекарственными средствами [14, 17, 18]. Препарат не менее эффективен в лечении стабильной стенокардии, чем бета-адреноблокаторы или антагонисты кальция, однако наибольшую эффективность он проявляет в сочетании с основными гемодинамическими антиангинальными препаратами. К преимуществам триметазидина относится отсутствие гемодинамических эффектов, что позволяет назначать препарат независимо от уровня артериального давления, особенностей сердечного ритма и сократительной функции миокарда.
Триметазидин может быть назначен на любом этапе лечения стенокардии в составе комбинированной антиангинальной терапии для усиления эффективности бета-адреноблокаторов, антагонистов кальция и нитратов у следующих категорий больных:
Триметазидин позволяет уменьшить дозу препаратов, оказывающих побочные действия, улучшая общую переносимость лечения.
Важными моментами являются отсутствие противопоказаний, лекарственной несовместимости, а также его хорошая переносимость. Нежелательные реакции возникают очень редко и всегда слабо выражены. Это позволяет применять препарат лицам пожилого возраста, при наличии сахарного диабета и других сопутствующих заболеваний.
Данных о влиянии триметазидина на отдаленные исходы и сердечно-сосудистую смертность у больных ИБС пока нет, поэтому целесообразность его назначения в отсутствие стенокардии или эпизодов безболевой ишемии миокарда не установлена.
Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ХСН. Метаболическая терапия у таких больных должна быть нацелена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Однако работ, посвященных изучению особенностей действия триметазидина у больных ХСН, крайне мало [7, 11, 16].
В связи с этим на кафедре клинической фармакологии и фармакотерапии ФППОВ ММА им. И. М. Сеченова было проведено исследование с целью определить пределы и возможности триметазидина в комплексной терапии больных ХСН, осложнившей течение ИБС.
В исследование было включено 82 больных ХСН II–III функциональных классов по NYHA, осложнившей течение ИБС. В их числе было мужчин — 67, женщин — 15, средний возраст составил 62,2 ± 7,3 года. Перед включением в исследование у всех пациентов была достигнута стабилизация состояния на фоне терапии сердечными гликозидами, диуретиками, бета-адреноблокаторами в индивидуально подобранных дозах. Все больные были распределены в две группы: в первую (основную) группу вошли 40 больных, которым к комплексной терапии был добавлен триметазидин в дозе 60 мг/сут и ИАПФ эналаприл в дозе 5–10 мг/сут; вторую (контрольную) группу составили 42 больных, которым к комплексной терапии был добавлен только эналаприл без триметазидина. Между группами не было достоверных различий по возрасту, полу, давности заболевания, ФК ХСН. Длительность наблюдения составила 16 нед.
Клиническую эффективность терапии оценивали по динамике функционального класса ХСН. Всем больным проводилось холтеровское мониторирование ЭКГ с оценкой среднесуточной частоты сердечных сокращений (ЧСС), общего количества эпизодов депрессии сегмента ST, максимальной величины депрессии сегмента ST. Тренды сегмента ST расценивались как ишемические при его горизонтальном снижении не менее чем на 1 мм относительно точки J продолжительностью 1 мин и более. Антиишемический эффект считали достоверным, если количество эпизодов ишемии миокарда уменьшалось на 3 и более и/или суммарная депрессия сегмента ST сокращалась на 50% и более. Также оценивался характер нарушений ритма сердца: количество изолированных желудочковых экстрасистол (ЖЭ), парных ЖЭ, наджелудочковых экстрасистол (НЖЭ), эпизодов неустойчивой желудочковой тахикардии (ЖТ), пробежек наджелудочковой тахикардии (НЖТ). Критериями антиаритмического эффекта считали уменьшение изолированных ЖЭ на 50%, парных ЖЭ — на 90% при полном устранении эпизодов ЖТ.
Для оценки толерантности к физической нагрузке больным проводился тредмил-тест. Критериями положительной пробы являлись типичный приступ стенокардии и/или стойкая горизонтальная депрессия сегмента ST на 1 мм и более. При анализе результатов тредмил-теста оценивались максимальная мощность выполненной нагрузки и общая продолжительность нагрузки.
С целью оценки состояния внутрисердечной гемодинамики пациентам проводилось эхокардиографическое исследование с оценкой следующих морфофункциональных параметров сердца: размер левого предсердия (ЛП), см; конечно-диастолический размер (КДР)Я, см; конечно-систолический размер (КСР), см; фракция выброса (ФВ) левого желудочка, %.
Клинические и инструментальные исследования проводили до и через 16 недель непрерывной терапии.
Статистический анализ полученных данных проводили с использованием стандартных методов статистики, включая вычисление непарного критерия t Стьюдента. Все данные представлены в виде средних стандартных отклонений (М ± m).
Анализ динамики ФК ХСН показал, что через 16 недель лечения у 28% больных первой группы и у 26% больных второй группы было достигнуто улучшение клинического состояния и переход в более низкий ФК ХСН. Количество больных III ФК уменьшилось в первой группе с 50 до 27,5%, во второй — с 64,3 до 30,9%. Количество больных II ФК увеличилось до 67,5 и 66,7% соответственно. На фоне лечения в обеих группах появились больные I ФК: 5% — в первой группе и 2,4% — во второй. В целом ФК ХСН снизился на 11% (р 0,05) и 6,9% (р > 0,05) соответственно, количество НЖЭ — на 26,4% (р 0,05) и 10,8% (р > 0,05) соответственно.
Ни у одного больного, получавшего терапию триметазидином, не было зарегистрировано вновь появившихся парных ЖЭ или эпизодов неустойчивой ЖТ.
По данным холтеровского мониторирования ЭКГ отмечено и достоверное уменьшение суточного количества эпизодов депрессии сегмента SТ в первой группе на 55,5% (р
Т. Е. Морозова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
СЕРДЕЧНЫЕ ГЛИКОЗИДЫ
Сердечные гликозиды — кардиотоннческие средства из группы стероидных О-гликозидов. В природе Сердечные гликозиды содержатся в растениях 45 видов, относящихся к различным семействам (кутровым, лилейным, лютиковым, бобовым и др.), а также в кожном яде некоторых жаб.
Растения, содержащие Сердечные гликозиды, использовали в качестве лекарственных средств и ритуальных ядов еще в глубокой древности. Простые и галеновы препараты наперстянки впервые внедрены в медицинскую практику во второй половине 18 в. английским врачом Уайтерингом (W. Withering). Большой вклад в изучение Сердечных гликозидов внесли русские ученые Е. В. Пеликан, С. П. Боткин, Н. Д. Стражеско и др.
К С. г., наиболее широко используемым в современной мед. практике, относятся препараты наперстянки (см.), напр, дигитоксин (см.), дигоксин (см.), ацетилдигитоксин (см.), целанид (см.), лантозид и др., строфанта — строфантин (см.), ландыша (см.) — коргликон и настойка ландыша, горицвета (см.) — адонизид и экстракт горицвета сухой.
Содержание
Химическое строение сердечных гликозидов
Молекула Сердечных гликозидов состоит из генинов (агликонов) и гликонов. Генины представляют собой стероидные спирты из группы производных циклопентанпергидрофенантрена, у к-рого в положении C17 имеется ненасыщенное лактонное кольцо. С наличием в структуре С. г. генинов связаны основные фармакол. свойства этих веществ. Кольца циклопентанпергидрофенантренового ядра обозначают латинскими буквами А, В, С и D. Для генинов фармакологически активных С. г. характерно наличие цис-связи между кольцами А и В, С и D, а также транссвязи между кольцами В и С. Кроме того, в молекуле генинов имеется метильная группа в положении C13 и гидроксильная группа в положении C14.
В зависимости от радикала при C10 различают генины с альдегидной, спиртовой и метильной группами. Радикалы при C5 и C17 могут быть представлены водородом или гидроксильной группой, а при C16 — различными хим. группами (рис. 1). Изменения любого из перечнеленных радикалов в генинах определяют водорастворимость и липофильность, а следовательно, полноту всасывания, скорость наступления и продолжительность действия соответствующих С. г. В зависимости от структуры лактонного кольца (рис. 2) генины подразделяют на карденолиды (с пятичленным непредельным 7-лактонным кольцом) и буфадиенолиды (с шестичленным, дважды ненасыщенным В-лактонным кольцом).
При насыщении лактонного кольца уменьшается активность и ускоряется развитие фармакологического действия С. г., а раскрытие этого кольца сопровождается инактивацией генинов.
Под гликонами в молекуле С. г. подразумевают остатки циклических сахаров, связанные через кислородный мостик с генинами в положении С3. Применяемые в медицине С. г. содержат от одного до четырех остатков сахаров, т. е. являются моно-, дио-, трио- или тетразидами. С увеличением количества остатков сахаров биол. активность С. г. понижается. В зависимости от характера гликона С. г. подразделяют по следующим критериям. По таутомерной форме моносахаридов, входящих в гликон, С. г. делят на пиранозиды (шестичленное кольцо) и фуранозиды (пятичленное кольцо). По а- или р-конфигурации полуацетального гидроксила, связанного с генином, различают альфа- и бета-гликозиды. В зависимости от природы сахарного остатка С. г. разделяют на пентазиды, гексозиды и биозиды. В состав гликонов С. г. может входить более 30 моносахаридов, многие из к-рых входят только в состав сердечных гликозидов (D-дигиталоза, D-дигиток-соза, D-цимароза и др.), а другие широко распространены в природе (D-глюкоза, L-рамноза, D-фукоза и др.). От характера гликона зависит растворимость, активность и токсичность С. г., а также степень их фиксации в тканях.
При гидролизе от молекулы С. г. отщепляются остатки сахаров. Этим объясняется образование так наз. вторичных гликозидов из первичных (генуинных), содержащихся в растительном сырье.
Свойства и механизм действия сердечных гликозидов
Сердечные гликозиды оказывают прямое избирательное действие на миокард и вызывают положительный инотропный эффект (усиление сердечных сокращений), отрицательный хронотропный эффект (урежение частоты сердцебиений), отрицательный дромотропный эффект (уменьшение проводимости) и положительный батмотропный эффект (повышение возбудимости всех элементов проводящей системы сердца, за исключением синусного узла). При применении С. г. в терапевтических дозах проявляются первые три эффекта этих препаратов и лишь частично положительный батмотропный эффект. Дромо- и батмотропный эффекты наиболее выражены при интоксикации С. г.
В основе положительного инотропного действия С. г. лежит смещение вверх кривой сила — скорость. В результате этого увеличивается способность сердца выполнять работу при данном давлении наполнения, систолическом давлении в желудочках, ударном объеме и данной изгоняемой фракции крови, укорачивается систола и уменьшается конечно-систолический объем желудочков. Положительное инотропное действие С. г. клинически выражено лишь в условиях сердечной недостаточности, когда ударный объем ограничен вследствие снижения сократимости. У здоровых лиц признаки положительного инотропного эффекта С. г. можно выявить только с помощью специальных гемодинамических исследований.
Увеличение под влиянием С. г. силы и скорости сердечных сокращений приводит к нек-рому повышению потребления кислорода здоровым сердцем. Однако при недостаточности кровообращения (см.) эти эффекты С. г. не сопровождаются увеличением потребления кислорода и субстратов окисления, поскольку С. г. существенно разгружают миокард и переводят его на энергетически более выгодный уровень работы, уменьшая объем сердца и развиваемое им напряжение.
Компенсируя по критерию изоос-мотичности увеличение внутриклеточной концентрации натрия и кальция, ионы К+ покидают кардиомиоциты. Градиент концентрации ионов К+ на мембране уменьшается, в результате чего потенциал покоя клеток сдвигается ближе к порогу деполяризации. В низких концентрациях С. г. мало изменяют величину потенциала покоя, в высоких — значительно снижают ее. В связи с этим при отравлениях С. г. увеличивается автоматизм всех элементов проводящей системы сердца (см.) и провоцируется появление эктопической активности. Неблагоприятный положительный батмотропный эффект С. г. усугубляется при гиперкальциемии, гипокалиемии, действии симпатомиметических аминов и эуфиллина. Уменьшение потенциала покоя сопровождается укорочением потенциала действия. Соответственно этому укорачивается эффективный рефрактерный период, что способствует возникновению предсердных и узловых аритмий (см. Аритмии сердца).
Отрицательное дромотропное действие С. г. проявляется уменьшением скорости атриовентрикулярной проводимости и соответствующим укорочением интервала PQ. Этот феномен обусловлен как прямым действием С. г. на миокард, так и активацией блуждающего нерва. Отрицательный дромотропный эффект С. г. является причиной развития вначале неполной, а затем и полной атриовентрикулярной блокады (см. Блокада сердца) и аритмий по механизму повторного входа возбуждения. Вместе с тем замедление атриовентрикулярной проводимости обеспечивает терапевтический эффект С. г. при суправентрикулярных тахикардиях, в т. ч. при мерцательной тахисистолии (см. Мерцательная аритмия). Внутрижелудочковую проводимость по волокнам Пуркинье, измеряемую по длительности комплекса QRS, сердечные гликозиды существенно не ухудшают.
В малых дозах С. г. оказывают отрицательное хронотропное действие в результате активации влияний блуждающего нерва на миокард. Этот эффект устраняется атропином (см.). При применении высоких доз С. г. преобладает прямое отрицательное дромотропное действие на синоатриальное соединение. Активация блуждающего нерва при влиянии С. г. осуществляется рефлекторно с барорецепторов синокаротидной и аортальной зон (синокардиальный рефлекс) и с рецепторов растяжения миокарда (так наз. эффект Бецольда, или кардио-кардиальный рефлекс Бецольда — Яриша). Одновременно снижается интенсивность рефлекса Бейнбриджа (см. Рефлексогенные зоны) вследствие уменьшения растяжения рецепторов устьев полых вен. Т. о., при сердечной недостаточности (см.) сердечные гликозиды в терапевтических дозах замедляют синусовый ритм гл. обр. в результате улучшения кровообращения.
Сердечные гликозиды вызывают более быстрое расслабление миокарда и изменяют направление процесса реполяризации, в связи с чем на ЭКГ уменьшается амплитуда зубца Т, а сегмент ST снижается ниже изолинии. Эти изменения не устраняются атропином и не являются признаком токсического действия.
Данные о влиянии С. г. на коронарное кровообращение противоречивы. В терапевтических дозах С. г. обычно не ухудшают его. Однако описаны случаи провокации приступов стенокардии (см.) под влиянием С. г.
Кардиотоническое действие всех С. г. в сопоставимых дозах идентично. Отдельные препараты С. г. отличаются друг от друга в основном фармакокинетическими параметрами (см. статьи, посвященные отдельным препаратам С. г.).
Показания и противопоказания к применению сердечных гликозидов
Основным показанием к применению С. г. является сердечная недостаточность (см.). С. г. наиболее эффективны при сердечной недостаточности, вызванной перегрузками, напр, при артериальной гипертензии, клапанных пороках сердца, атеросклеротическом кардиосклерозе. В других случаях, напр, при сдавлении опухолью устьев полых вен или обызвествленном перикарде, когда контрактильность сердца нормальна, С. г. не оказывают значимого леч. эффекта.
С. г. сравнительно мало эффективны при большинстве миокардиодистрофий (см.), кардиомиопатий (см.), миокардитов (см.), а также при аортальной недостаточности, особенно сифилитической этиологии (см. Пороки сердца приобретенные), и тиреотоксикозе (см.), если сохранен синусовый ритм, при легочном сердце (см.) без терапии основного заболевания. Однако С. г. не противопоказаны при этих заболеваниях, т. к. оказывают нек-рое лечебное действие, уменьшая симптомы сердечной декомпенсации. При острых миокардитах С. г. назначают только в уменьшенных дозах.
При приступах пароксизмальной суправентрикулярной тахикардии С. г. дают хороший профилактический и лечебный, эффект, но суправентрикулярная пароксизмальная тахикардия (см.) с атриовентрикулярной блокадой может появиться и при интоксикации С. г. Поэтому назначать С. г. можно, лишь точно зная, что ранее больные с указанной патологией не принимали эти препараты. С. г. высокоэффективны при тахисистолической форме мерцания или трепетания предсердий в сочетании с отеком легких. Желудочковая экстрасистолия (см.), возникшая на фоне лечения С. г., является одним из признаков интоксикации и требует отмены препарата. Вместе с тем экстрасистолия, связанная с перегрузкой желудочков при сердечной недостаточности, после адекватной терапии С. г. может исчезнуть.
При желудочковой тахикардии С. г. можно с осторожностью применять для лечения сопутствующей недостаточности кровообращения. Однако при появлении желудочковой тахикардии на фоне терапии С. г. необходимо отменить используемый препарат, т. к. нарушение ритма может быть следствием интоксикации С. г.
С. г. умеренно эффективны при острой левожелудочковой недостаточности разной степени, обусловленной острым инфарктом миокарда, но противопоказаны при кардиогенном шоке (см.). При остром инфаркте миокарда (см.) С. г. применяют в сниженных дозах, поскольку ишемизированные области миокарда аритмогенны. При осторожном применении в случаях острого инфаркта миокарда С. г. статистически достоверно не увеличивают ни смертность, ни количество аритмических осложнений.
При стенокардии, возникшей на фоне сердечной недостаточности и кар диомегалии, С. г. оказывают положительный эффект. Однако при отсутствии сердечной недостаточности они могут усугублять клин, проявления стенокардии и в ряде случаев провоцируют появление ее приступов. Поэтому при нестабильной стенокардии эти препараты применять нецелесообразно.
С. г. противопоказаны при идио-патическом субаортальном стенозе, т. к. вызываемое ими усиление сердечных сокращений увеличивает степень нарушения оттока крови из левого желудочка. При атриовентрикулярной блокаде второй степени С. г. противопоказаны вследствие опасности развития полной поперечной блокады, особенно на фоне приступов Морганьи — Адамса — Стокса (см. Морганьи — Адамса — Стокса синдром). Не следует применять С. г. при синдроме Вольф-фа — Паркинсона — Уайта (см. Вольффа — Паркинсона — Уайта синдром).
Во время беременности и кормления грудью С. г. необходимо назначать с осторожностью, т. к. они относительно легко проникают через плацентарный барьер и выделяются с материнским молоком.
Побочное и токсическое действие сердечных гликозидов
Различают сердечные и внесердечные проявления токсического действия С. г. Сердечные проявления интоксикации обусловлены особенностями механизма действия С. г. на миокард.
Так, вызываемое С. г. уменьшение амплитуды потенциала покоя, сопровождающееся укорочением рефрактерного периода, может явиться одной из причин фатальной фибрилляции желудочков, желудочковых и предсердных экстрасистол, часто протекающих по типу аллоритмий (вплоть до бигеминии). В связи с отрицательным дромотропным действием С. г. могут вызывать атриовентрикулярную блокаду различной степени. Для интоксикации С. г. характерны также непароксизмальные суправентрикулярные тахикардии с атриовентрикулярной блокадой. Возможна синусовая аритмия, синоатриальная блокада, остановка синусного узла, тахикардия из атриовентрикулярного соединения и политопная желудочковая тахикардия. Электрокардиографическими признаками интоксикации являются синусовая брадикардия, атриовентрикулярная диссоциация, желудочковые аритмии и суправентрикулярные аритмии с атриовентрикулярной блокадой.
К внесердечным проявлениям интоксикации относятся жел.-киш., неврологические и нек-рые другие расстройства. Нарушения функций жел.-киш. тракта (анорексия, тошнота, рвота) наиболее часто развиваются у больных, принимающих С. г. перорально. Однако в ряде случаев эти нарушения отмечаются и при внутривенном введении препаратов. К неврол. нарушениям, вызываемым С. г., относятся невралгии, головные боли и др.
При длительном приеме С. г. возможна брадикардия (см.), усугубление сердечной недостаточности, потеря веса, нарушение цветового зрения (скотома, видение в желтом или зеленом цвете, белые ореолы вокруг объектов), развитие делирия (см. Делириозный синдром), вялость, бессонница (см.), головокружение (см.).
К числу редких осложнений, вызываемых С. г., относятся гинекомастия (см.), кожные аллергические реакции, иммунная тромбоцитопения (см.). Одной из главных причин интоксикации С. г. является передозировка препаратов. Развитию интоксикации способствует изменение фармакокинетики С. г. при нек-рых патологических состояниях, напр. при гипотиреозе, почечной или печеночной недостаточности. Чувствительность к С. г. повышена у лиц пожилого возраста, а также при кардиомиопатиях, гипоксии миокарда (напр., при остром инфаркте), нарушениях кислотно-щелочного состояния, особенно при алкалозе (см.), гипомагниемии и гиперкальциемии (см.). Чаще всего развитию интоксикации С. г. способствует истощение запасов калия под влиянием салуретиков и в связи с вторичным гиперальдостеронизмом (см.). К провоцирующим аритмии факторам можно отнести также электрическую кардиоверсию.
Развитию интоксикации способствует назначение лекарственных средств, усиливающих действие С. г., напр, препаратов кальция, или средств, увеличивающих концентрацию ионов кальция в крови, напр, хинидина на фоне терапии дигоксином. Отмена препаратов, ослабляющих эффекты С. г., напр, фенобарбитала, бутадиона, холестирамина, препаратов калия, также может быть причиной усиления токсичности С. г.
При интоксикационных тахиаритмиях С. г. отменяют и назначают препараты калия, дифенин, кси-каин, бета-адреноблокаторы, напр, анаприлин. При наличии гипокалиемии (см.) назначают препараты калия, напр, калия хлорид внутрь (до 4—7 г в сутки) или внутривенно (на 5% р-ре глюкозы со скоростью 40 мэкв/час в течение 1—3 час.). Не рекомендуется назначать калий при атриовентрикулярной блокаде или гиперкалиемии. В таких случаях целесообразно применять дифенин.
Ксикаин весьма эффективен при желудочковых тахиаритмиях, возникающих при v интоксикации С. г. Однако его можно использовать только при отсутствии атриовентрикулярной блокады. В последнем случае может потребоваться применение искусственного водителя ритма (см. Кардиостимуляция). Для терапии желудочковых аритмий, вызванных С. г., нельзя пользоваться электрической кардиоверсией, т. к. она может привести к фибрилляции желудочков. При появлении фибрилляции электрическая дефибрилляция (см.) является методом выбора.
При интоксикациях Сердечными гликозидами эффективны также донаторы сульфгидрильных групп, напр. унитиол, и препараты, связывающие ионы кальция и снижающие их содержание в сыворотке крови, напр, динатриевая соль этилендиаминтетрауксусной кислоты.
Библиография: Вотчал Б. Е. и Слуцкий M: Е. Сердечные гликозиды, М., 1973, библиогр.; Гацура В. В. и Кудрин А. Н. Сердечные гликозиды в комплексной фармакотерапии недостаточности сердца, М., 1983; Машковский М. Д. Лекарственные средства, ч. 1, с. 341, М., 1977; Сивков И. И. и Кукес В. Г. Хроническая недостаточность кровообращения, Д., 1973; Сычева И. М. и Виноградов А. В. Хроническая недостаточность кровообращения, с. 72, М., 1977; Cardiac diagnosis and treatment, ed. by N. O. Fowler, p. 1009, Hagerstown, 1976; Harrison’s principles of internal medicine, ed. by K. J. Isselbacher a. o., p. 1064, N. Y., 1980; The heart, ed. by J. W. Hurst a. o., p. 1942, N. Y. a. o., 1978; Heart disease, ed. by E. Braunwald, p. 509; Philadelphia a. o., 1980; The pharmacological basis of therapeutics, ed. by A. G. Gilman а. о., N. Y., 1980.