Гормональный кюретаж дюфастоном что это
Центр ЭКО в Курске
Мы диагностируем и лечим все формы бесплодия как у женщин, так и у мужчин. Мы используем самые современные медицинские технологии, чтобы осуществить ваше желание стать родителями. Для нас нет ничего невозможного! В клинике «Центр ЭКО» вы получите не только грамотно подобранное лечение, но и психологическую поддержку, и комфортные условия.
Почему пациенты выбирают «Центр ЭКО»?
В клинике «Центр ЭКО» в распоряжении врачей находится самое современное оборудование для проведения наиболее точной диагностики и лечения пациентов. За счет этого клиника обеспечивает высокую эффективность протоколов ЭКО. Специалисты клиники «Центр ЭКО» проведут грамотную консультацию, назначат все необходимые анализы и обследования, чтобы подобрать каждой паре самый оптимальный курс лечения. Клиника «Центр ЭКО» проводит лечение пациентов в рамках программ ЭКО по ОМС.
В нашей клинике ведут прием высококвалифицированные специалисты, постоянно повышающие свою квалификацию и желающие помочь каждому пациенту. Любая семья, обратившаяся к нам в клинику, получает шанс стать счастливыми родителями. Записаться на консультацию в клинику можно, заполнив форму на сайте или позвонив нам по телефону.
Популярные программы ЭКО:
Наша клиника является одной из первых частных клиник России, участвующих в программе государственного финансирования
ЭКО в естественном цикле считается наиболее щадящим способом лечения бесплодия из всех методов вспомогательных репродуктивных технологий.
Новая технология противорецидивной гормональной терапии гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста
Проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста. Разработана новая медицинская технология гесагенотерапии гиперпластических процессов эндометрия, позволяющая
The study on specific binding of progesterone receptors and synthetic gestogens in women of late childbearing age, was done. The new medical technology of gestogen therapy of hyperplastic processes of endometrium, which allows to reduce recurrence frequency, was developed.
.jpg)
Патогенез ГПЭ характеризуется сложным взаимодействием общих системных процессов и локальных изменений в эндометрии. В свете современных концепций в основе развития ГПЭ лежит гормональный дисбаланс, который выражается абсолютной или относительной гиперэстрогенемией [4–6]. Эндометрий является самой чувствительной тканью-мишенью половых гормонов. Исследования последних лет показали, что ведущую роль в развитии ГПЭ играет чувствительность слизистой оболочки матки к стероидным гормонам [2, 7–9]. Для противорецидивной терапии ГПЭ применяют гормональные препараты, состав и дозу которых выбирают в зависимости от результатов гистологического исследования соскоба эндометрия, сочетанных гинекологических и соматических заболеваний, возраста женщины и индивидуальной переносимости препарата. В практическом здравоохранении у пациенток позднего репродуктивного возраста наиболее часто используются синтетические гестагены. Однако, по литературным данным, отсутствие эффекта от гестагенотерапии при ГПЭ варьирует от 25,9% до 78,0% [6, 10].
Резервом повышения эффективности терапии ГПЭ является индивидуальный выбор препаратов. Для осуществления персонализованного подбора гормональной терапии мы предложили использовать силу связывания препарата с рецепторами прогестерона из ткани эндометрия конкретной пациентки. Данное предположение основано на тезисе, что сила связывания лиганда с рецептором определяет эффект от лечения, то есть чем выше связывание гестагенов с прогестерон-связывающими участками, тем лучший эффект ожидается от лечения.
С целью проверки данной гипотезы на кафедре молекулярной фармакологии и радиобиологии им. академика П. В. Сергеева ГБОУ ВПО РНИМУ им. Н. И. Пирогова совместно с МОНИИАГ было проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста с гиперпластическими процессами эндометрия. Проведенные в отделении гинекологической эндокринологии исследования показали, что выбор гестагена с учетом индивидуальной чувствительности эндометрия к препарату позволил значительно снизить частоту рецидивов железистой гиперплазии эндометрия [4, 5, 7]. По результатам исследования была разработана новая медицинская технология и получен патент на изобретение «Способ гестагенотерапии гиперпластических процессов эндометрия» [11].
Материал и методы исследования
В исследование вошли 164 женщины позднего репродуктивного возраста. Критериями включения в исследование явились: наличие ГПЭ (простой железистой гиперплазии и/или железистых полипов эндометрия), отсутствие тяжелой соматической патологии и выраженных метаболических нарушений, препятствующих проведению противорецидивной гормональной терапии.
Клинические методы исследования включали общее стандартное гинекологическое обследование женщин: осмотр шейки матки в зеркалах, влагалищное бимануальное исследование, трансвагинальное ультразвуковое сканирование органов малого таза (на 5–8 день менструального цикла), мазок на флору и ЗППП. Ультразвуковое сканирование органов малого таза у пациенток позднего репродуктивного возраста проводилось на базе НКО МОНИИАГ, аппаратом Siemens Sequoia 512 с использованием вагинального датчика от 6 до 8 мГц, в режиме двухмерной визуализации.
Ткань эндометрия для определения цитозольных рецепторов половых стероидов получали во время выскабливания стенок полости матки при использовании серийного аппарата Circon Acmi на базе эндоскопического отделения МОНИИАГ или путем эндорам-биопсии.
Уровень рецепторов прогестерона и специфическое связывание стандартных гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия по методу [12].
Цитозольную фракцию получали стандартным методом с помощью ультрацентрифугирования (105 000 g, ультрацентрифуга UP-65 M, 60’). Уровень рецепторов прогестерона (РП) и специфическое связывание гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия радиолигандным методом [13].
Белок определяли методом Лоури.
Статистическую обработку материала проводили на персональном компьютере, в работе использовалась программа GraphPad Prism 5.0 и стандартные методы статистического анализа.
Результаты и обсуждение
Из 136 обследованных пациенток с ГПЭ 73 (54%) были с рецидивирующим течением (в анамнезе от 1 до 6 раздельных диагностических выскабливаний (РДВ) слизистой стенок матки и цервикального канала), у остальных 63 женщин (46%) гиперплазия эндометрия была выявлена впервые.
В контрольную группу вошли 28 женщин (без измененного эндометрия), в группу с ГПЭ вошли 73 пациентки, при гистологическом исследовании у 51 (37,5%) пациентки были диагностированы железистые полипы эндометрия, а у 85 — простая железистая гиперплазия эндометрия.
У пациенток с ГПЭ в 112 случаях (82%) были гормонзависимые заболевания гениталий (миома матки и/или эндометриоз различной локализации), 58% обследуемых женщин имели избыточную массу тела (ИМТ ≥ 25).
37 (27,2%) пациенткам с ГЭ проводили гистероскопию с РДВ во II фазу менструального цикла в условиях МОНИИАГ. 99 (73%) женщинам РДВ с или без гистероскопии было проведено по месту жительства.
Уровень РП в эндометрии изменялся в зависимости от нозологической формы гиперплазии. Так, при полипах эндометрия средняя величина этого параметра снизилась в 1,4 раза по сравнению с нормой и составила в среднем 16,9 ± 3,7 фмоль/мг белка, а при железистой гиперплазии эндометрия — в 1,2 раза и равнялась 19,2 ± 5,6 фмоль/мг белка (р ≤ 0,05).
В качестве тестируемых гестагенов использовались: медроксипрогестерона ацетат, норэтистерон, дидрогестерон. Приведенные гестагены выбраны по принципу различий структуры и наличия доступных лекарственных форм. Уровень рецепторов прогестерона в цитозоле эндометрия, как и сила специфического связывания с гестагенами, варьировали в широких пределах. При этом усредненные данные показали, что наибольшую силу связывания продемонстрировал медроксипрогестерона ацетат (64,6 ± 7,2 при полипах эндометрия и 73,8 ± 5,2 при гиперплазии (р ≤ 0,001)), наименьшую — норэтистерон (52,7 ± 4,1 при полипах эндометрия и 60,3 ± 2,6 при гиперплазии (р ≤ 0,001)).
При исследовании были выделены следующие группы: контрольная группа (I группа) — 28 пациенток; женщины с рецидивирующим течением ГПЭ, которым была назначена гормональная противорецидивная терапия по методу слепой выборки (II группа) — 41 пациентка; женщины с рецидивирующим течением ГПЭ, которым назначалась гормональная противорецидивная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками (III группа) — 32 пациентки.
II группе была назначена гормональная противорецидивная терапия с использованием препаратов, в состав которых входят тестируемые гестагены. Эффективность терапии пациенток данной группы (отсутствие рецидивов в течение 6 месяцев по окончании лечения) сравнивали с результатами индивидуального тестирования аффинитета рецепторов прогестерона, полученных из эндометрия пациенток до начала лечения.
III группе была назначена гормональная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками цитозоля эндометрия конкретной пациентки.
Все пациентки, имеющие рецидивирующее течение заболевания, получали:
Оценка эффективности гормональной терапии проводилась по клиническим симптомам, а также по результатам трансвагинального ультразвукового сканирования органов малого таза на 3-м и 6-м месяцах гормональной терапии. Ультразвуковое исследование проводили на 4–8 день менструального цикла, толщина эндометрия считалась нормальной при значениях 0,3–0,6 см, если же она превышала данные значения, то проводилась гистероскопия для уточнения диагноза.
В результате клинико-лабораторного исследования показано, что во II группе частота рецидивов составила 17,1%, в то время как в III группе частота рецидивов составила 6,3%.
Сравнительный анализ противорецидивной эффективности синтетических гестагенов в проведенном исследовании показал, что количество рецидивов при использовании норэтистерона было максимально и составило 18 через 3 месяца во II группе, тогда как при терапии медроксипрогестерона ацетатом рецидивов обнаружено не было через 3 и 6 месяцев.
Выводы
Таким образом, нами рекомендуется алгоритм проведения персонализированной противорецидивной гормональной терапии по схеме, представленной на рис. 2.
Медико-социальная эффективность
Снижение частоты рецидивов гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста ведет к:
Таким образом, предложенная медицинская технология представляет собой подбор индивидуальной гормональной терапии гиперпластических процессов эндометрия на основании индивидуальной оценки связывающих свойств рецепторов прогестерона эндометрия.
Работа выполнена в рамках программы развития НИУ ГБОУ ВПО РНИМУ им Н. И. Пирогова, 2010–2019, приоритетное направление развития ПНР-2, персонализированная медицина.
Литература
В. И. Краснопольский*, доктор медицинских наук, профессор, член-корреспондент РАМН
Н. Д. Гаспарян*, доктор медицинских наук, профессор
Л. С. Логутова*, доктор медициинских наук, профессор
Е. Н. Карева**, доктор медицинских наук, профессор
О. С. Горенкова*, кандидат медицинских наук
Д. А. Тихонов**
*ГБУЗ Московской области МОНИИАГ,
**ГБОУ ВПО РНИМУ им. Н. И. Пирогова, Москва
Нерегулярные или избыточные маточные кровотечения
Во время фолликулярной фазы (1 фаза) менструального цикла под действием эстрогенов толщина эндометрия увеличивается. На гистологическом уровне этот процесс проявляется возрастанием количества митозов в железах, то есть происходит рост эндометрия. Во время лютеиновой фазы (2 фаза), продуцируемый желтым телом прогестерон останавливает рост эндометрия, вызывает в нем секреторную трансформацию, обеспечивая условия для имплантации оплодотворенной яйцеклетки. В конце менструального цикла, если не наступила беременность, вследствие регресса желтого тела в крови падают уровни женских половых гормонов, что приводит к началу менструальных кровотечений.
Начало и завершение нормального менструального кровотечения требует четкого взаимодействия между гормональными влияниями и эндометрием. Во время лютеиновой фазы менструального цикла эндометрий состоит из трех слоев: базального, губчатого слоя и компактного слоя. Базальный слой находится на границе между миометрием и эндометрием и именно из него в каждом новом цикле обновляется эндометрий. Губчатый слой, следующий после базального, является самым толстым слоем, занимающим половину всей толщины эндометрия во второй фазе цикла. В губчатом слое располагаются спиральные артерии.
Сосудистая структура эндометрия является продолжением сосудов миометрия. Аркуатные артерии миометрия, разветвляясь, формируют радиальные и базальные артерии, которые начинают извиваться и создают так называемые спиральные артерии, проникающие в эндометрий. Спиральные артерии, в отличие от базальных, чувствительны к колебаниям эстрогенов и прогестерона, что обеспечивает процесс десквамации функционального слоя эндометрия вследствие вазоконстрикции, приводящей к ишемии и некрозу. После завершения десквамации начинается регенерация базальных артерий. На микроскопическом уровне в этом процессе выделяют 4 стадии: а) разрушение базальной мембраны; б) миграция эндотелиальных клеток; в) пролиферация эндотелиальных клеток и г) формирование капилляра. В процессе деградации базальной мембраны специфические ферменты (стромелизин, коллагеназа и др.) разрушают элементы экстацеллюлярного матрикса. Затем эндотелиальные клетки мигрируют в конец сосуда, чему способствуют среда, богатая коллагеном I и III типа и стимулирующее действие bFGF. Дальнейшая пролиферация эндотелиальных клеток и формирование просвета, вероятно, тоже зависят от компонентов экстацеллюлярного матрикса.
Таким образом, механизм, посредством которого осложнения беременности могут привести к появлению маточного кровотечения, становится очевидным. Процесс имплантации эмбриона включает в себя инвазию трофобласта в эндометрий, в чем существенную роль играет развитие локальной сосудистой сети в эндометрии, обеспечивающей условия для дальнейшего протекания беременности. В случаях, когда беременность по той или иной причине начинает прерываться, материнские сосуды открываются в полость матки, что приводит к развитию кровотечения.
Опухоли матки вызывают кровотечение за счет разрушения нормальной целостности структуры эндометрия. Маточные кровотечения, вызванные эндометритом, являются следствием разрушения сосудов и желез эндометрия веществами, продуцирующимися при воспалении.
Первым этапом в формировании тромба является агрегация тромбоцитов, поэтому любые заболевания, сопровождающиеся нарушением агрегации тромбоцитов (тромбофилии, нарушения в системе гемостаза, тромбоцитопеническая пурпура и др.), могут привести к маточным кровотечениям.
Среди гормональных нарушений, приводящих к патологическим маточным кровотечениям, ведущее место занимает ановуляция. Суть ановуляторных кровотечений заключается в длительной стимуляции эндометрия эстрогенами в отсутствии прогестерона, что приводит к избыточному росту эндометрия и периодическому его отторжению за счет дистрофических процессов в поверхностных слоях.
Гормональные нарушения, приводящие к патологическим маточным кровотечениям
Причин для нарушения овуляции множество. В большинстве случаев первые менструальные циклы после менархе – ановуляторные, однако, в дальнейшем при нормальном функционировании всех систем, циклы становятся овуляторными. В норме, 2-3 года после менархе менструальный цикл может быть ановуляторным с характерной этому состоянию нерегулярностью. Среди наиболее распространенных причин, препятствующих овуляции на ранних этапах можно выделить нарушение функции гипоталамо-гипофизарного комплекса вследствие перенесенных нейроинфекций, травм, пороков развития, эндокринопатий, а также другие причины, обусловленные недостаточной массой тела и психическими факторами и др.
Наибольший риск развития гиперпластических процессов эндометрия и карцином эндометрия (рака) наблюдается у женщин пременопаузального возраста в особенности на фоне повышенной массы тела. Предполагается, что внеяичниковый синтез эстрогенов в жировой клетчатке, за счет ферментации андрогенов в эстрогены, суммируясь с эстрогенами яичникового происхождения, приводит к усилению пролиферативных процессов в эндометрии, что в условиях отсутствия адекватной продукции прогестерона создает фон для формирования гиперплазии. Однако, помимо гиперэстрогении и недостаточности прогестерона необходимы другие факторы для развития гиперпластического процесса. Интересно, почему у молодых девушек с повышенной массой тела и ановуляторным менструальным циклом гиперпластические процессы эндометрия развиваются крайне редко? Принимая во внимание результаты нескольких последних исследований, вероятнее всего большую роль в формировании гиперпластических процессов эндометрия играет хронический эндометрит, возникающий вследствие инфекций, передающихся половым путем, большого числа инвазивных гинекологических вмешательств, эндометриоза матки (аденомиоз).
Диагностировать ановуляторный менструальный цикл довольно просто. Клинически для него характерна олигоменорея, то есть пациентка пожалуется на «нерегулярный менструальный цикл с задержками». Проведение УЗ исследования в зависимости от фазы цикла может подтвердить диагноз. В целом при УЗ исследовании на фоне ановуляции в яичниках можно обнаружить мелкие фолликулы (дисфункиональное маточное кровотечение вследствие атрезии фолликулов), персистирующий фолликул (дисфункциональное маточное кровотечение вследствие персистенции фолликулов). Толщина эндометрия будет зависеть от времени, прошедшего после последней менструации и количества эстрогенов, продуцируемых яичниками. Также важным критерием будет отсутствие желтого тела.
Для дисфункциональных маточных кровотечений, причиной которых является недостаточность желтого тела (НЛФ), характерна полименорея, то есть менструации у такой пациентки будут приходить регулярно, но менее, чем через 21 день. Диагностическими критериями для этого состояния могут быть: низкий уровень прогестерона во второй фазе менструального цикла при установленном факте овуляции, короткая (менее 10 дней) гипертермическая фаза на графике базальной температуры.
Лечение
Кровотечения в первой фазе менструального цикла чаще всего связаны с недостатком эстрогенов, который можно восполнить их введением извне, к примеру, в виде оральных контрацептивов.
К наиболее часто выявляемым органическим причинам маточных кровотечений относятся полипы эндометрия и цервикального канала, гиперпластический процесс эндометрия и кровотечения, обусловленные наличием миомы матки или внутреннего эндометриоза (аденомиоза). Все эти состояния с большой вероятностью можно выявить при УЗ исследовании в сочетании со стандартным клиническим обследованием.
Если механизм развития маточных кровотечений на фоне полипов и гиперплазии эндометрия очевиден, то в отношении причин маточных кровотечений, вызванных миомой матки, до сих пор нет однозначных мнений.
Таблица№1 Нормальные показатели менструального цикла
Безоперационное лечение атипической гиперплазии эндометрия за 1 сеанс фотодинамической терапии
Аденоматоз эндометрия
Д.м.н., профессор Сеченовского университета, онколог, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению атипической гиперплазии и рака матки, а также предраковых и опухолевых заболеваний шейки матки.
Атипическая гиперплазия эпителия – это диагноз, который в онкогинекологии однозначно классифицируется как предраковое заболевание с высокой степенью канцерогенности – способностью перерождаться в рак.
Женщин репродуктивного возраста врачи стараются лечить. Проводят тяжелую гормональную терапию или хирургическую процедуру – лазерную абляцию эндометрия. Оба эти метода имеют достаточно серьезные последствия.
На фоне приема гормонов женщина погружается в состояние, свойственное менопаузе, и испытывают такие осложнения, как набор лишнего веса, усталость, снижение либидо и повышенный риск тромбоэмболии (1, 2).
Частым же осложнением абляции является развитие так называемого синдрома Джозефа Ашермана, когда в процессе заживления полость матки срастается.
К сожалению, атипичная гиперплазия матки – это очень серьезное заболевание, которое тяжело поддается лечению. Абляция и гормонотерапия гиперплазии эндометрия с очагами атипии эффективны лишь в определенном проценте случаев.
При неэффективности гормонотерапии и абляции, медицина сегодня может предложить фактически единственный способ избежать озлокачествления процесса и сохранить жизнь. Этот способ – удаление матки. Зачастую показания требуют удаления матки вместе с придатками – то есть, вместе с маточными трубами и яичниками. Поэтому отсутствие эффекта на фоне гормонального лечения или абляции всегда заканчивается одинаково – радикальной рекомендацией избавиться от матки.
Новый высокотехнологичный метод фотодинамической терапии (ФДТ), который я использую в своей практике, за 1-2 сеанса обеспечивает выздоровление более чем в 80% случаев.
Безоперационный метод ФДТ позволяет сохранить матку, а вместе с ней сохранить женское здоровье, возможность зачать и самостоятельно родить.
Перед тем, как продолжить наш разговор об атипической гиперплазии, давайте определимся, что скрывается за этим термином и какова природа заболевания. Это позволит понять, почему классические методы мало эффективны против атипии и оценить все преимущества ФДТ.
Что такое гиперплазия матки
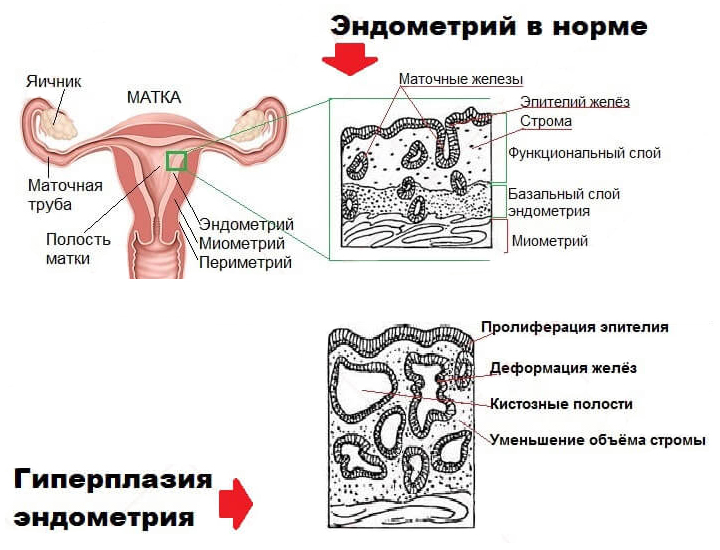
Изнутри матку выстилает слизистый слой – эндометрий. Эндометрий не однороден. Он состоит из:
1. маточных желез и
2. стромы – служебной ткани, которая поддерживает железы и обеспечивает их питание.
В норме строма и железы занимают примерно равный объем, 1:1.
Каждый месяц к моменту овуляции матка готовится принять в себя яйцеклетку, и толщина эндометрия увеличивается. После выхода яйцеклетки из яичника железы эндометрия активируются и начинают вырабатывать слизь (секрет), создавая благоприятную среду для оплодотворения. Когда оплодотворения не происходит, эндометрий отслаивается и выходит вместе с кровью.
Если по каким-то причинам эндометрий не отторгается во время менструации (например, в этом цикле у женщины не было овуляции), он продолжает разрастаться. Это состояние и называется гиперплазией эндометрия.
Классификация гиперплазии эндометрия
Гиперплазия эндометрия подразделяется на:
1. простую гиперплазию эндометрия,
2. атипическую гиперплазию эндометрия.
Если толщина эндометрия увеличивается локально, на отдельных участках, такое состояние называется очаговой гиперплазией. Если повсеместно по всей полости матки – диффузной.
Но так как далеко не все гинекологи и морфологи взяли на вооружение новую классификацию, в статье я буду использовать все существующие названия этого диагноза.
Что такое простая гиперплазия эндометрия
Это начальная стадия гиперплазии, которая характеризуется утолщением эндометрия и незначительным неравномерным расположением маточных желез, некоторые из которых превращаются в кисты – закупоренные железы, расширенные изнутри собственным секретом. Соотношение маточных желез и стромы примерно соответствует здоровому – 1:1.
К простым формам гиперплазии сегодня относят следующие диагнозы:
Сочетание нескольких из указанных видов ранее относили и трактуются коллегами как сложная гиперплазия.
Гиперплазия проявляется кровотечениями или мажущими кровянистыми выделениями в период между менструациями. При УЗИ выявляется неоднородная эхоструктура эндометрия.
В силу стрессов – смены часового пояса, недосыпания, отсутствия овуляции (ановуляторный цикл) и нервного перенапряжения, – простая железистая гиперплазия может проявиться в самом обычном цикле даже у самой здоровой женщины. Поэтому можно говорить, что признаки простой гиперплазии наблюдаются в течение жизни у 90% женщин.
Это состояние достаточно легко поддаётся коррекции гестагенными препаратами, а также Дюфастоном, Норколутом, Утрожестаном и др. Молодым пациенткам для лечения часто назначают комбинированные оральные контрацептивы – Джесс, Жанин и другие.
Простая гиперплазия эндометрия не является предраковым состоянием и не требует специального противоопухолевого лечения.
Что такое атипичная гиперплазия эндометрия матки, или аденоматозная гиперплазия эндометрия (код N85.1 в МКБ-10 – международная классификация болезней 10 пересмотра)
Аденоматоз эндометрия, или атипическая гиперплазия матки – стадия развития гиперплазии, которая характеризуется появлением атипичных клеток. Слово «атипичные» означает почти то же самое, что «нетипичные»: эти клетки не похожи на нормальные.
Все наши клетки имеют четкую форму, располагаются слоями и выполняют определенную функцию. Но по каким-то причинам (ученые не пришли к единому мнению о причинах развития атипии в эндометрии матки), они изменяют свою форму, размер и перестают выполнять заложенную природой функцию.
Появление атипических клеток – очень серьезный звонок! Эта стадия развития гиперплазии в медицине относится к предраковым заболеваниям матки.
Атипичные клетки продолжают делиться и накапливать повреждения. Если процесс не остановить, атипичная форма гиперплазии приводит к появлению злокачественных клеток и переходит в рак матки.
Атипичная гиперплазия эндометрия в медицинской практике носит сразу несколько названий – сложная или комплексная гиперплазия с атипией клеток, аденоматозная гиперплазия эндометрия, атипичная железистая гиперплазии эндометрия, очаговый аденоматоз эндометрия, сложная гиперплазия с атипией, железистая гиперплазии эндометрия с атипией, кистозно-аденоматозная гиперплазия, очаговая гиперплазия с атипией клеток и атипическая железистая гиперплазия эндометрия. Некоторые из них устарели, но используются до сих пор.
И какой бы диагноз из этого списка вам не поставили, при появлении атипии все эти состояния трактуются как предраковые и лечатся одинаково.
Название «аденоматозная» эта форма гиперплазии получила не случайно. Аденома – это доброкачественная опухоль, образованная из клеток железистого эпителия, в нашем случае – из эпителия маточных желез.
Как проявляется сложная атипическая гиперплазия эндометрия
Сложная гиперплазия эндометрия с атипией клеток сопровождается разрастанием желез слизистой оболочки матки. Большое количество маточных желез на ограниченном участке располагаются очень плотно друг к другу и деформируются. Соотношение железистой ткани и стромы смещается к пропорции 2:1. Общая структура эндометрия значительно нарушается.
Многие железы закупориваются, переполняются собственным секретом, образуют кисты и аденомы.
Атипическая гиперплазия эндометрия может переходить в рак – в этом ее основная опасность
К сожалению, не только может, но и переходит – атипическая гиперплазия эндометрия имеет высокий риск озлокачествления.
Данные статистики сильно отличаются, но в общем и целом от 23 до 81%*** случаев атипической гиперплазии приводят к раку матки.
С одной стороны, такой разброс в цифрах объясняется разным периодом наблюдения за больными с атипической гиперплазией (при длительном наблюдении цифра приближается к 100%).
С другой стороны, даже квалифицированный специалист-патоморфолог, который рассматривает клетки под микроскопом и определяет степень их злокачественности, испытывает сложности при постановке диагноза.
Мы не будем вдаваться в тонкости работы патоморфолога, но, поверьте, крайне сложно однозначно дифференцировать предраковое и начальное раковое состояние эндометрия. И одни видят атипию там, где другие уже видят рак.
Атипичная гиперплазия эндометрия матки – это рак?
Атипичная гиперплазия не являются раком в истинном смысле слова:
То есть, атипичные клетки уже приобрели свойства раковых – они разного размера и с увеличенными ядрами, но еще не преодолели сопротивление организма.
Еще раз повторюсь, что вопрос атипических процессов в матке совсем непростой. Постановка диагноза по материалу биопсии или после выскабливания крайне затруднительна. Поэтому при подозрении на диагноз «атипическая гиперплазия эндометрия матки» пересмотр стекол почти всегда сопровождается новым заключением патоморфолога.
Точная диагностика характера очагов аденоматоза возможна только после удаления матки, когда специалист получает возможность прицельно исследовать структуру эндометрия на всю его глубину. То есть, провести не цитологическое исследование (исследование клеток), а гистологическое исследование (исследование тканей), которое позволяет получить более точный результат.
Между тем по литературным данным диагностика тканей матки после гистерэктомии выявляет рак эндометрия у каждой третьей и даже у каждой второй (54%) больной***!
Как раньше проводили лечение атипичной гиперплазия эндометрия
Раньше после постановки диагноза «очаговая атипическая гиперплазия эндометрия» гинекологи не могли порадовать своих пациенток наличием эффективного нехирургического метода лечения и благоприятным прогнозом на выздоровление.
Как я уже говорил, стандартный международный подход лечения аденоматоза матки у молодых женщин предусматривает приём тяжелых гормональных препаратов, таких как Депо Провера и его аналоги. Этот метод еще называется «гормональным кюретажем». Такое гормональное лечение направлено на усиление секреции – отторжение гиперплазированного эндометрия.
При отсутствии эффекта лечение аденоматозной гиперплазии эндометрия проводят хирургически – методом абляции (выпаривания) эндометрия при помощи лазера с его последующим кюретированием (выскабливанием). Кюретаж эндометрия выполняют не более трех раз, поскольку этот метод лечения имеет высокие риски развития синехий – осложнения, в результате которого внутренние стенки матки часто в процессе заживления срастаются.
Женщинам репродуктивного возраста, планирующим иметь детей, после проведения выскабливания назначается гормональное лечение прогестероном.
При этом важно понимать, что при железистой гиперплазии с атипией гормональное лечение позволяет уменьшить толщину эндометрия, но слабо при этом влияет на атипию, и атипические клетки продолжают свое деление. То есть, прогестероновая терапия не является профилактикой рака.
В случае неэффективности всех перечисленных методов, женщине выполняют удаление матки.
Да, в последние годы европейская медицина при малейшем появлении атипии часто направляет пациентку на удаление матки, исключая таким образом риск перерождения атипии в рак.
«Гистерэктомия», или удаление матки, – такова современная международная тактика ведения пациенток по поводу гиперплазии с атипией клеток, принятая в Европе и Америке. И хотя в отношении не рожавших женщин западная медицина тоже назначает горомонотерапию, финальный исход в виде гистерэктомии считается неизбежным как для рожавших, так и для не рожавших женщин любого возраста.
Такая тактика спасает жизнь, но приводит к развитию крайне серьезных осложнений.
Последствия удаления матки
По этому поводу я написал разъясняющую статью, к каким последствиям приводит удаление матки для женщины.
В первую очередь это касается другого качества жизни после операции. Как говорится, природой лишних органов не задумано. И понятно, что при утрате органа, даже по медицинским показаниям, утрачивается и функция этого органа. Но это только часть проблемы. Крайне отрицательное воздействию после операции испытывают и соседние органы.
После удаления матки серьезно страдает мочевыделительная система, нарушается работа толстой кишки, развивается высокое артериальное давление, серьезно повышаются риски инфарктов и инсультов.
Женщинам же репродуктивного возраста, ведущих активную половую жизнь, приходится адаптироваться не только к изменению ощущений во время секса, но и к изменившемуся размеру влагалища.
Стремясь найти эффективное лечение без удаления органа, я разработал протокол лечения атипической гиперплазии эндометрия методом фотодинамической терапии.
Как проходит процедура фотодинамической терапии
Именно такое избирательное воздействие обеспечивает полноценное удаление атипичных клеток и гиперплазированного эндометрия и выздоровление после процедуры.
Как происходит заживление
Спустя 6–7 недель после сеанса фотодинамической терапии слизистая заживает без рубцов. Формируется здоровый эпителий матки.
В течение полугода все пациентки проходят 3-кратный контроль, который включает:
В дальнейшем нужно будет посещать гинеколога один раз в пол года для профилактических осмотров.
Пациентка, 34 года, г. Москва, диагноз «атипическая гиперплазия эндометрия»
Обратилась с поставленным диагнозом зимой этого года. С Января 2015 года перестали приходить самостоятельно менструации. По назначению гинекологов принимала гестагенные препараты (Дюфастон) в непрерывном режиме.
| Здесь следует отметить характерные для атипической (сложной) гиперплазии эндометрия жалобы – отсутствие самостоятельных менструаций, признак патологии эндометрия. |
В мае 2016 года при проведении раздельно выскабливания матки и гистероскопии диагноз снова подтвердился. Гистологическое заключение после пересмотра в лаборатории института онкологии им. Блохина № 24730: в готовых препаратах и препаратах, приготовленных с блока в соскобе кусочки эндометриального полипа с картиной простой железистой гиперплазии без атипии и сложной атипической гиперплазии. Показано проведение специального противоопухолевого лечения в объёме гистерэктомии, гормонотерапии. Была консультирована в том же онкоцентре им. Блохина, от предложенной гормонотерапии решила воздержаться в пользу проведения сеанса фотодинамической терапии.
В октябре 2016 года проведена фотодинамическая терапия матки. Послеоперационный период без осложнений. Пайпель биопсия эндометрия от 03.02.2017 года, гистологическое заключение № 171005746: «вероятнее всего определяется фрагмент железистого полипа эндометрия гиперпластического типа с очаговым фиброзом стромы, фокусами лимфоцитарной инфильтрации».
С целью профилактики рецидива атипической гиперплазии в апреле 2017 года пациентке проведён второй сеанс ФДТ матки, перед которым проведено раздельное выскабливание матки, гистологическое заключение № 171020496: «очаговая простая железистая гиперплазия эндометрия без атипии с кисточкой трансформацией желёз».
Пациентка вылечена. Клинический признак выздоровления: с декабря 2016 года у пациентки восстановился цикл, стали приходить менструации.
На сегодняшний день пациентка здорова и планирует беременность.
Почему лечение аденоматоза эндометрия нужно проводить методом ФДТ
Я не могу гарантировать, что ФДТ способна вылечить атипическую гиперплазию эндометрия на 100%, так как причина этого заболевания – в основе своей – комплексная (гормональная).
1. Фотодинамическая терапия прицельно устраняет атипические клетки и, как следствие, избавляет от риска развития рака матки.
После правильно выполненной фотодинамической терапии с возникновением адекватных фотохимических реакций, можно говорить о том, что в зоне лечения атипичных клеток не остается. Это означает, что рецидиву взяться попросту неоткуда.
2. Фотодинамическая терапия сохраняет матку – орган, который важен не только для рождения детей, но и для нормального функционирования всего женского организма – от кишечника до сосудов.
3. Процедура не затрагивает глубокие слои матки, позволяет сохранить целостность матки и все функции здорового органа. Такая матка впоследствии позволяет зачать, выносить и родить.
При этом акушеры и гинекологи в своей практике наблюдают интересный факт – беременность и период лактации благотворно влияют на гормональный фон женщины и служат отличной профилактикой: после родов гиперплазия эндометрия развивается крайне редко.
4. Исследования** эффективности ФДТ показывают удивительную способность процедуры тормозить избыточное разрастание эпителия матки.
На протяжении 6 месяцев наблюдений после одного сеанса ФДТ гиперплазии не была обнаружена у 82 % пациентов, и еще у 7% регрессировала после повторного сеанса ФДТ.*
Это обнадеживает и дает запас времени всем планирующим беременность.
Из пяти моих пациенток с пролеченной атипической гиперплазией четыре уже прошли контроль и здоровы. Одна еще находится под наблюдением в ожидании контроля.
5. ФДТ исключает сращение внутренних стенок матки – распространенное осложнение после хирургической абляции.
Хуже не будет, а высокая – более 80 процентов – вероятность излечения – хорошее основание, чтобы устранить очаг атипической гиперплазии методом ФДТ. Принять решение об удалении матки всегда успеете.
Таким образом, из всех орагносохраняющих методов лечения гиперплазии эндометрия с атипией фотодинамическая терапия является самым результативным.
Результаты лечения пациентки 39 лет, Москва
Зарубежный опыт лечения гиперплазии матки методом ФДТ подтверждает его высокую эффективность
Основанием для усовершенствования моей методики проведения ФДТ стала работа врачей из Южной Кореи (3), которые пролечили несколько пациенток с высокодифференцированной аденокарциномой эндометрия матки и получили показательный результат.
Выше мы уже говорили о сложностях разграничения тяжёлой атипической гиперплазии эндометрия (дисплазии) и высокодифференцированной аденокарциномы эндометрия. Поэтому данные корейских коллег можно рассматривать в качестве релевантных и для случаев атипической гиперплазии.
Лечение проходила группа пациенток репродуктивного возраста 24-35 лет. У 10 из 16 пациенток удалось добиться выздоровления после одного сеанса ФДТ. Еще у двух пациенток удалось добиться выздоровления после второго и третьего сеанса ФДТ соответственно.
Таким образом, доля положительного ответа на лечение методом ФДТ составила 75% (12/16).
Из 7 пациенток, которые попытались забеременеть после лечения, у четырех пациенток (57%) прошло семь успешных беременностей, которые привели к рождению 6 живых младенцев.
Стоит также отметить, что после успешного лечения методом ФДТ на протяжении 78 месяцев наблюдения не было отмечено рецидива болезни ни у одной из пациенток. Также не было отмечено серьезных побочных эффектов, связанных с фотодинамической терапией.
Почему направление ФДТ в медицине не развивается?
Идея и опыт применения фотодинамической терапии в лечении атипической гиперплазии эндометрия и рака тела матки не нова. Работы по фотодинамической терапии проводилась еще на кафедре акушерства и гинекологии II Медицинского университета им. Н.И. Пирогова.
1. Метод технологически сложный и объединяет в себе три направления науки: медицину, биологию и физику. Ни одну из этих составляющих нельзя считать второстепенной.
Как следствие, практикующий ФДТ специалист должен исповедовать мультидисциплинарный подход и быть специалистом в разных областях знаний. Не у каждого врача это получается.
2. Врачи мало знают про этот метод или не знают совсем, хотя он уже входит в федеральный стандарт оказания медицинской помощи по акушерству и гинекологии при патологии шейки матки при CIN – смотрите Приказ Минздрава России от 01.11.2012 N 572н (ред. от 11.06.2015) «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» (Зарегистрировано в Минюсте России 02.04.2013 N 27960).
3. Сейчас не производят катетеры по форме матки. Что касается лечения матки, технология усложняется тем, что матка – полый мышечный орган треугольной формы. Около 5 лет назад в России и в Швейцарии производили баллонные катетеры по форме матки, но в последнее время их выпуск остановлен.
На сегодняшний день мной совместно с доктором физических наук, профессором Лощёновым В.Б. (ЗАО БИОСПЕК) инициирована разработка и сертифицированное производство внутриматочного баллонного световода нового поколения.
Показания к проведению фотодинамической терапии предрака матки
Чтобы получить консультацию, показана ли вам фотодинамическая терапия, и рассчитать цену процедуры, высылайте вашу историю болезни и анализы на e-mail doctor.afanasyev@mail.ru. Или звоните по телефону 8 (800) 555-77-26 в Москве.
Прием ведет Афанасьев Максим Станиславович, акушер-гинеколог, онкогинеколог, онколог, иммунолог, доктор медицинских наук, профессор и член ученого совета Первого МГМУ им. И.М. Сеченова МЗ РФ, эксперт по лечению атипической гиперплазии матки.
Прием проводится в двух клиниках в Москве, а также в Санкт-Петербурге, Махачкале, Курске, Ставрополе, Барнауле, Самаре, Набережных Челнах, Салавате, Челябинске, Сургуте и других регионах России. Уточнить дату, место приема в вашем городе и записаться на консультацию вы можете у администратора по телефону +7 (495) 204-18-93.
После лечения я поддерживаю обратную связь со всеми пациентками и решаю все возникающие вопросы. Гепатит и положительный ВИЧ статус не является противопоказаниями для лечения методом ФДТ.
1. Ramirez PT, Frumovitz M, Bodurka DC, et al. Hormonal therapy for the management of grade 1 endometrial adenocarcinoma: a literature review. Gynecol Oncol. 2004;95:133-138.
2. Banno K, Kisu I, Yanokura M, et al. Progestin therapy for endometrial cancer: the potential of fourth-generation progestin [review]. Int J Oncol. 2012;40:1755-1762.
3. Сохранение фертильности путем фотодинамической терапии у молодых пациенток с ранней стадией карциномы эндометрия. Долгосрочное исследование, основанное на последующем наблюдении пациенток. Авторы: Мин Чул Чой, Санг Геун Джунг, Хьюн Парк, Юн Хьюн Чо, Чан Ли, Сеунг Джо Ким.
5. *** Новикова Е.Г., Чулкова О.В., Пронин С.М. Лечение атипической гиперплазии эндометриия / Практическая онкология. 2004. Т. 4, № 1. С. 52-59.
_575.gif)
.gif)