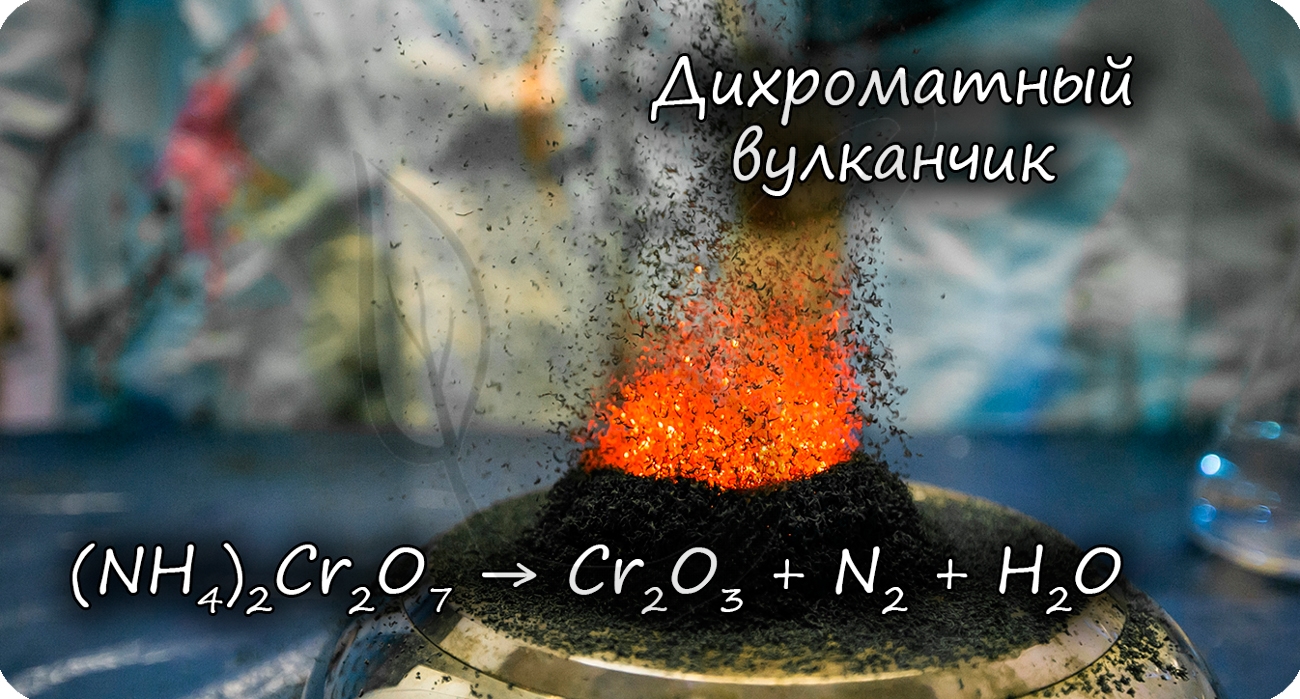Иду сдавать химию зная что хром это браузер тетрадь
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Протекает в раскаленном состоянии.
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Fe + S = FeS (t > 700°C)
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Медь способна восстанавливать неметаллы из их оксидов.
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Как подготовиться к ЕГЭ по химии без репетитора: советы эксперта предметной комиссии
Как сделать подготовку к экзамену по химии продуктивной, какими интернет-ресурсами воспользоваться, какие задания вызывают сложности у выпускников и что поможет их преодолеть? Рассказывает заместитель председателя предметной комиссии ЕГЭ по химии, эксперт Московского центра качества образования (МЦКО) Ольга Гончарук.
Химию сложно освоить без грамотного наставника
Самоподготовка эффективна тогда, когда у учащихся есть цель и мотивация (для чего мне это надо?), а также сформирован комплекс универсальных учебных умений (как я буду это делать?).
А это не что иное, как навык учиться: планировать свои действия, ориентироваться в собственной системе знаний, получать и интерпретировать учебную информацию, контролировать процесс увеличения изученного материала и способов деятельности, брать на себя ответственность за свое обучение.
Специфика химии как предмета заключается в том, что ее сложно освоить без грамотного наставника. Поэтому в первую очередь обратитесь к своему учителю химии — он подскажет, поможет и направит. Однако и про самоподготовку забывать не стоит — лишним это точно не будет. Тем более что сегодня для этого есть масса возможностей и полезных ресурсов. Например, многие уважаемые химики (и эксперты МЦКО, в частности) записывают видеоролики с разбором заданий ЕГЭ.
Необходимое условие верного решения задачи — правильно написанное уравнение
Конечно, для подготовки к экзамену нужно выполнить большое количество заданий в формате ЕГЭ. Но прежде чем приступать к ним, необходимо разобраться с теорией. Так, эксперты МЦКО подготовили ролики для выпускников. В них есть теоретическая часть, которую необходимо знать для решения конкретной задачи. Вебинары по разбору заданий Единого государственного экзамена по химии можно найти на сайте Московского центра качества образования.
Приступая к обобщению и повторению теории, помните, что готовиться нужно не по заданиям, а по блокам
Например, задания 6, 7, 8, 9, 10, 30, 31, 32 — это свойства неорганических веществ. Во время занятий составьте конспект и внесите в него как можно больше свойств неорганических веществ: уравнения реакций, качественные реакции, возможность проявлять свойства окислителя или восстановителя.
Возьмите таблицу растворимости и раскрасьте цветные осадки и растворы, отметьте вещества, образующиеся в растворе в виде газа и воды, обратите особое внимание на прочерки (это явная подсказка, что вещество гидролизуется до конца). Эти опорные точки помогут вам запомнить свойства неорганических веществ.
Задания 11 и 12 — это строение органических веществ. В органической химии начинать нужно именно с этой темы, так как от строения органического вещества зависят его свойства. Свойства органических веществ — следующий блок, это задания 13–18, 33 и 35. При подготовке обратите внимание на то, как зависит тип реакций, характерных для веществ одного класса, от особенностей их строения (например, одинарные связи — реакции замещения, кратные связи — реакции присоединения). Особо отметьте, как происходит окисление веществ и как среда раствора влияет на поведение окислителей. Изучая свойства органических веществ, не забывайте про их генетическую связь!
Сдать ЕГЭ по химии и биологии на 100 баллов. Не читайте чаты, пишите пробники и не думайте о баллах
Необходимое условие верного решения задачи — правильно написанное уравнение, а для этого нужно знать свойства веществ. Разбирая большое количество задач, вы заметите, что для каждого типа есть определенный алгоритм решения. Если вы его поймете, то научитесь выполнять даже самые сложные задания.
Информационные ресурсы
Первое, что вы используете для поиска информации, — интернет. Но не всегда ему можно доверять. Вы, наверное, знаете сайты, которые подберут коэффициенты абсолютно к любому уравнению. Даже к тому, которое написано для несуществующей реакции. Но на них опираться нельзя.
Лучше старайтесь каждый день выполнять несколько заданий в формате ЕГЭ. Если появится ошибка — разберитесь с ее причиной, выпишите задание в тетрадь для подготовки, вспомните или изучите теорию. Отрабатывайте каждое задание, прежде чем приступить к выполнению всего контрольного измерительного материала.
При самоподготовке к экзаменам нужно пользоваться проверенными учебными материалами, в том числе и информационными ресурсами. Я рекомендую посетить открытый банк заданий Федерального института педагогических измерений, послушать вебинары по разбору заданий Единого государственного экзамена по химии, посмотреть видеоконсультации на сайте Московского образовательного телеканала.
Кроме того, Московский центр качества образования совместно с Московским образовательным телеканалом запустили еженедельный проект — «Субботы московского выпускника» для учащихся 9-х и 11-х классов. Ведущие эксперты МЦКО в прямом эфире помогают разбирать решения заданий ЕГЭ и ОГЭ, а также проводят видеоконсультации по различным темам для подготовки к государственной итоговой аттестации. Школьники могут сами выбрать тему ближайшей программы. Для этого необходимо принять участие в голосовании, которое проходит каждую неделю с понедельника по среду.
Наиболее трудные задания прошлого года
При подготовке я рекомендую уделить особое внимание следующим элементам содержания:
Именно эти элементы содержания на экзамене 2020 года стали наиболее трудными для выпускников. Как видите, довольно много заданий в списке относятся к разделу «Органическая химия», что указывает на необходимость уделить чуть больше внимания этим вопросам.
Примеры заданий можно посмотреть на сайте Федерального института педагогических измерений (ФИПИ) в демоверсии. Загляните и в другие документы — спецификацию и кодификатор. Уверена, что они будут полезны всем участникам экзаменационной сессии.
Фото: Shutterstock / Gorodenkoff, Zodar
Хром. Химия хрома и его соединений
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
3. Оксид хрома (III) не взаимодействует с водой.
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
3. Гидроксид хрома (II) – сильный восстановитель.
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту: