Иммуноглобулиновая терапия что это
Иммуноглобулины на страже здоровья
Лекарства на основе иммуноглобулинов (или антител) известны давно. Еще в начале XX века немецкий ученый Эмиль Беринг изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших, и именно за это получил самую первую Нобелевскую премию по физиологии и медицине. Учение об антителах стало одним из перспективных направлений в науке на долгие годы вперед.
На практике это сделало возможным появление новых лекарств против опасных заболеваний, таких как гепатит B, клещевой энцефалит, столбняк и др. Но несмотря на доказанную пользу и вируснейтрализующее действие, у иммуноглобулинов первого поколения были выраженные побочные эффекты и неудобная форма приема – внутримышечная. Она была болезненной и имела ограничения по объему, допустимому для введения в организм. Это заставило ученых сконцентрироваться на инновациях в области иммуноглобулинов. Дальнейший рост производства был неразрывно связан с прогрессом в технологиях очистки, повышающих безопасность препаратов.
В XXI столетии мировые лидеры в этом направлении используют современные стандарты многоступенчатой очистки иммуноглобулинов. Благодаря им примеси, провоцирующие побочные реакции в препарате сведены к минимуму, а концентрация чистого иммуноглобулина класса G достигает 98%. Препараты последнего поколения безопасны и защищены от вирусов. Именно передовые методы очистки позволили использовать потенциал антител в борьбе с инфекционными агентами в полной мере.
Сегодня разработки холдинга «Нацимбио» Госкорпорации Ростех приходят на помощь и в борьбе с коронавирусной инфекцией – недавно в России был официально одобрен ее препарат направленного действия «КОВИД-глобулин». Это первый в мире зарегистрированный препарат иммуноглобулинов из плазмы крови для лечения COVID-19.
Рассказываем о том, что такое иммуноглобулины, об истории изучения антител, их применении в борьбе с коронавирусом.
История вопроса: как антитела превратились в «волшебную пулю»
Иммуноглобулины (антитела) – это особые белки, которые участвуют в иммунном ответе. Они связываются с фрагментами опасных «врагов» нашего организма – бактерий, вирусов, грибов, собственных опухолевых клеток, токсинов, и запускают механизм уничтожения угрозы. Антитела можно назвать эволюционным изобретением человека, как и всех позвоночных животных. В день наш организм производит порядка 2-3 граммов разнообразных антител. Всего в течение жизни в человеческом теле может синтезироваться огромное множество уникальных вариантов разновидностей иммуноглобулинов. Благодаря этому наш организм способен подобрать специфическое антитело к любому из опасных агентов, с которым встретится.
Изучать эти процессы ученые начали во второй половине XIX века. Именно тогда зародилась иммунология, появились первые данные о способности организма распознать и победить возбудителя заболевания при повторной встрече с ним. Конечно, основу заложил еще английский врач Эдвард Дженнер, который в конце XVIII века изобрел первую вакцину против натуральной оспы. Позже ученые выяснили, что такая защита возможна благодаря особым веществам в жидкой части крови – сыворотке. Значит сыворотку можно ввести в организм вместо прививки и добиться временной защиты или помочь справиться с инфекцией уже больному человеку. Первым на практике это успешно продемонстрировал немецкий ученый Эмиль Беринг в конце XIX века, когда изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших.

Эмиль Беринг с ассистентом
В то время дифтерия уносила тысячи детских жизней по всему миру – каждый двадцатый ребенок в Европе и США становился жертвой этой коварной болезни. Медики были бессильны, поэтому первый успех антидифтерийной сыворотки Беринга для кого-то стал настоящим рождественским чудом. В ночь перед Рождеством 1891 года умирающие от дифтерии пациенты Берлинского детского госпиталя получили инъекцию спасительной сыворотки Беринга. Тогда этот укол оказался последним шансом на жизнь для многих маленьких пациентов, но не стал спасением для всех.
Доработать и довести до совершенства противодифтерийную сыворотку Берингу помог коллега и приятель врач-иммунолог Пауль Эрлих. Его глубокие познания в иммунологии помогли точнее рассчитать дозировку антитоксина и подготовить очищенные, более безопасные сыворотки. В 1894 году новая версия была успешно введена более 200 маленьким пациентам.
Популярный сегодня термин «иммуноглобулины» появился гораздо позже – в 1959 году его предложил бельгийский иммунохимик Йозеф Хереманс. Это название очень хорошо отражает двойную сущность антител – функционально они являются иммунными факторами, а по своей структуре относятся к группе белков сыворотки крови с названием «глобулины».
В 1972 году было расшифровано химическое строение антител – за это американский иммунолог Джеральд Эдельман и английский биохимик Родни Портер также получили Нобелевскую премию. Следующие два важных открытий в этой сфере произошли в 1984 году – обоснование теории идиотипической цепи и разработка методики получения моноклональных антител, которые также удостоились Нобелевской премии. С этого же периода стартовало развитие методов очистки иммуноглобулинов, которые стали ключевым условием эффективности терапии. Сегодня стандартом в этой области является хроматография.
Более ста лет исследований и четыре Нобелевские премии – такого внимания и признания не получало ни одно другое открытие в области физиологии и медицины.
Иммуноглобулинотерапия – природный механизм защиты
В наши дни иммуноглобулины используются для борьбы с различными инфекционными болезнями – клещевым энцефалитом, цитамегаловирусом, стафилококком, а также как терапия пациентов с аллергиями и первичным иммунодефицитом. В последнем случае показано лечение с использованием иммуноглобулина человека нормального. При таких видах иммунодефицитов, когда организм пациентов не способен вырабатывать антитела самостоятельно, препарат иммуноглобулина человека нормального восполняет нехватку антител, обычно циркулирующих в крови здорового человека, обеспечивая пациентам высокое качество жизни.
В случае лечения аллергии используют препарат противоаллергического иммуноглобулина. Иммуноглобулины также помогают в борьбе с аутоиммунными болезнями, такими как системная красная волчанка, синдром Гийена – Барре или синдром Кавасаки.
Иммуноглобулинотерапия в силу своей естественной природы часто прописывается беременным, когда противопоказаны многие антибиотики из-за негативного влияния на плод. При этом, антирезусный иммуноглобулин – это единственный способ избежать гемолитическую болезнь плода при резус-конфликте во время беременности.
Сегодня фарминдустрия может предложить препараты специфических иммуноглобулинов к различным видам микроорганизмов. Но даже при отсутствии нужного препарата, его можно достаточно оперативно создать. В этом и заключается одно из ключевых преимуществ иммуноглобулинов – возможность экстренно получить специфические антитела. Таким образом, иммуноглобулинотерапия незаменима при появлении новых штаммов инфекции, например, вируса гриппа, при эпидемиях, особенно в условиях отсутствия вакцины. Неудивительно, что терапия иммуноглобулином стала особо актуальной в условиях пандемии COVID-19.
Двойной иммунный ответ «ковиду»
В нашей стране одним из крупнейших производителей препаратов на основе антител является «Нацимбио». Предприятие фармхолдинга – НПО «Микроген» – выпускает «Иммуноглобулин человека нормальный», «Альбумин» и другие лекарства на основе плазмы крови, включая специфические иммуноглобулины, линейку которых недавно дополнил «КОВИД-глобулин». Таким образом, Россия получила возможность применять сразу два вида иммунизации против коронавируса – иммуноглобулин и вакцину.

Фото: Нацимбио
«Нацимбио» разрабатывал препарат при активном сотрудничестве с Департаментом здравоохранения Москвы. К этой работе были привлечены столичные врачи и эксперты, Москва также предоставила центры для проведения клинических испытаний препарата. Ну, и самое главное – это передача сырья для производства иммуноглобулина. «КОВИД-глобулин» создается на основе плазмы крови людей, обладающих антителами к вирусу SARS-CoV-2. Для этого столичный Департамент здравоохранения поставил «Нацимбио» 2,5 тонны донорской плазмы. Особенностью иммуноглобулина является применение системы хроматографической очистки, которая обеспечивает вирусную безопасность и полное отсутствие посторонних элементов и белков.
После успешно проведенных доклинических испытаний и первой фазы клинических исследований Минздрав РФ зарегистрировал «КОВИД-глобулин». В начале апреля стартовала вторая и третья фазы клинических испытаний, которые продлятся примерно полгода.
В планах на этот год – переработка не менее 15 тонн плазмы, что позволит помочь 10-15 тыс. пациентов. Стать причастным к этому большому делу может любой желающий, кто перенес COVID-19. Подробнее о том, как стать донором плазмы читайте здесь
Инструкция
Препарат является иммунологически активной белковой фракцией, выделенной из плазмы крови доноров, обследованных на отсутствие поверхностного антигена вируса гепатита В (HBsAg), антител к вирусу иммунодефицита человека (ВИЧ-1, ВИЧ-2), антител к вирусу гепатита С, очищенная и концентрированная методом фракционирования спиртоводными осадителями, а также прошла стадию вирусной инактивации сольвент-детергентным методом.
Прозрачная или слегка опалесцирующая, бесцветная или желтоватая жидкость. В процессе хранения возможно появление незначительного осадка, исчезающего при встряхивании. Препарат не содержит консервантов и антибиотиков.
Качественный и количественный состав
1 мл препарата содержит:
действующее вещество — иммуноглобулины G — 100 мг;
вспомогательные вещества — натрия хлорид;
вспомогательные вещества — глицин (гликокол, кислота аминоуксусная).
1 ампула 1,5 мл содержит 150 мг иммуноглобулина G.
Распределение IgG по подклассам: нет данных.
Фармакотерапевтическая группа
Иммунологическое и биологическое свойства. Препарат повышает неспецифическую резистентность организма. Действующей основой являются иммуноглобулины — антитела разной специфичности, концентрация которых в крови при введении препарата достигает максимума через 24 часа. Период полувыведения антител из организма составляет 4-5 недель. Препарат содержит от 9 до 11 % белка.
Показание для применения
1. Профилактика кори. Иммуноглобулин человека нормальный — Биофарма может предупредить или модифицировать корь у восприимчивых лиц (не вакцинированных и не болевших раньше корью), в контакте с больными
Способ применения и дозы
Иммуноглобулин человека нормальный вводят исключительно внутримышечно.
Профилактика кори: препарат назначают однократно.
Детям в возрасте от 3-х месяцев, которые не болели корью, когда от момента контакта прошло не более 6 суток, препарат вводится из расчета 0,25 мл/кг массы тела для внутримышечного пути введения. У пациентов с ослабленным иммунитетом доза может быть увеличена до 0,5 мл/кг массы тела. Максимальная доза 15 мл не должна быть превышена.
Лечение гипо— и агаммаглобулинемии: в исключительных случаях, когда может быть применен препарат для подкожного или внутривенного введения, низкие дозы Иммуноглобулина человека нормального — Биофарма могут быть введены внутримышечно. Внутримышечная инъекция должна быть осуществлена врачом или медсестрой. Доза — 100-150 мг/кг (0,6-0,9 мл/кг). Препарат не может быть применен внутримышечно в случае тяжелой тромбоцитопении и при других расстройствах гемостаза.
Реакции на введение иммуноглобулина, как правило, отсутствуют.
могут наблюдаться реакции в месте инъекции: боль и чувствительность.
лихорадка, озноб, утомление;
артларгия, боль в спине;
головная боль, головокружение;
В случае шока применять стандартное лечение. В связи с этим пациенты должны находиться под медицинским надзором 30 минут после введения препарата.
Противопоказания
Тяжелые аллергические реакции на введение белковых препаратов крови человека.
Тяжелая тромбоцитопения и другие нарушения гемостаза — опасность кровотечения и кровоизлияния в месте инъекции.
Дефицит Ig А, у пациентов с наличием антител к Ig А.
Специальные предупреждения и меры предосторожности
Прямое введение иммуноглобулина в кровеносный сосуд может вызвать шок.
Пациент должен находиться под наблюдением на предмет возникновения побочных реакций на протяжении всей процедуры введения и как минимум в течение 20 минут после её окончания.
Некоторые побочные эффекты возникают чаще у пациентов, получающих нормальный человеческий иммуноглобулин впервые и реже у пациентов, переведённых на данный препарат, а также у пациентов после перерыва в лечении более 8 недель.
Реакции гиперчувствительности редки и могут наблюдаться у пациентов с IgA дефицитом с присутствием анти-IgA антител. Данным пациентам препарат должен назначаться с осторожностью.
В редких случаях введение иммуноглобулина может вызвать падение артериального давления с развитием анафилактической реакции. Данное осложнение может наблюдаться даже у пациентов, которые ранее были толерантны к нормальному человеческому иммуноглобулину. Следующие действия могут помочь избежать развития потенциальных осложнений.
— пациент не страдает гиперчувствительностью к нормальному человеческому иммуноглобулину (первое введение продукта проведите с низкой скоростью);
— пациент находится под наблюдением на предмет выявления симптомов осложнений на протяжении всего времени введения. В частности, это касается пациентов, впервые получающих нормальный человеческий иммуноглобулин, и пациентов, которые переведены с альтернативных методов лечения, пациентов после долгого перерыва в лечении — такие больные должны находиться под наблюдением в течение всего периода первой инъекции и одного часа после. Остальные пациенты должны наблюдаться в течение 20 минут после введения препарата.
При подозрении на возникновение симптомов побочных реакций следует немедленно прекратить введение препарата. При появлении признаков шока следует прибегнуть к противошоковой терапии.
Для контроля за качеством лекарственного средства настоятельно рекомендуется записывать название и серию препарата Иммуноглобулин человека нормальный — Биофарма при применении у каждого пациента — это позволит выявить связь между каждым больным и той или иной серией препарата.
Препарат Иммуноглобулин человека нормальный — Биофарма не защищает от гепатита А. Иммуноглобулин человека нормальный применяют с осторожностью при почечной недостаточности: сообщалось о транзиторном увеличении уровня креатинина после введения иммуноглобулина нескольким больным с нарушениями функции почек (у больных сахарным диабетом и системой красной волчанки). У таких больных следует наблюдать за уровнем креатинина сыворотки в течение трех дней после введения.
Данные о применении препарата у людей пожилого возраста отсутствуют.
Введение препарата внутривенно запрещено! После окончания срока годности использование препарата недопустимо.
Применение при беременности и в период лактации
Не рекомендуется применять препарат во время беременности и в период лактации. Больным, которые имеют в анамнезе аллергические заболевания, не связанные с введением белковых препаратов донорской крови, в день введения иммуноглобулина и в следующие 3 суток рекомендуются антигистаминные препараты. Лицам, которые страдают иммунопатологическими системными заболеваниями (болезни крови, соединительной ткани, нефрит и др.), иммуноглобулин вводится на фоне соответствующей терапии.
Несовместимый в одном шприце с другими лекарственными средствами. Допустимо смешивать только с 0,9 % раствором натрия хлорида.
Взаимодействие с другими лекарственными средствами
В комплексной терапии совместим с другими группами препаратов. Снижает активность ослабленных живых вакцин против кори, краснухи, эпидемического паротита, ветряной оспы (при введении в первые две недели после вакцинации против кори, паротита и краснухи прививки указанными вакцинами следует повторить не ранее чем через 3 месяца). Для кори этот период может длиться до 1 года, поэтому необходимо проверить титр антител до иммунизации. При необходимости использования иммуноглобулина раньше этого срока вакцинацию против кори или эпидемического паротита необходимо повторить. Прививки против других инфекций могут быть проведены в любые сроки до или после введения иммуноглобулина. Временное повышение уровня антител в крови пациента после введения иммуноглобулина может быть причиной ложнопозитивных серологических проб. Препарат следует смешивать только с 0,9 % раствором натрия хлорида. Другие препараты добавлять в раствор нельзя, так как изменение концентрации электролита или значение pH может вызвать денатурацию белка.
Иммуноглобулиновая терапия что это
Иммуноглобулины для внутривенного введения (ВВИГ) являются наиболее часто используемыми препаратами, изготовленными из плазмы крови доноров. Государственный реестр лекарственных средств и Анатомо-терапевтическо-химическая (Anatomical Therapeutic Chemical) классификация (АТХ) относят ВВИГ к фармацевтической группе «медицинские иммунобиологические препараты» (код по АТХ JO6BA02) [3].
Современные ВВИГ получают фракционированием плазмы крови человека. Они представляют собой препараты поликлональных антител класса IgG, синтезированных В-лимфоцитами в ответ на антигенные стимулы, имевшие место на протяжении жизни человека-донора. IgG – гликопротеин с молекулярной массой около 150 кДа, содержащийся в плазме человека в количестве от 7 до 12 г⁄л [12]. Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип IgG определяется последовательностью аминокислот константной области тяжелой цепи [2].
Современные препараты ВВИГ подразделяются на три группы [3]:
I. Стандартные препараты – содержат в основном IgG (иммуноглобулин человека нормальный для внутривенного введения).
II. Стандартные специфические (гипериммунные) препараты – содержат в основном IgG, но имеют более высокое содержание противовирусных антител.
III. Обогащенные препараты ВВИГ – содержат антитела классов IgG, IgM, IgA против патогенных вирусов и бактерий.
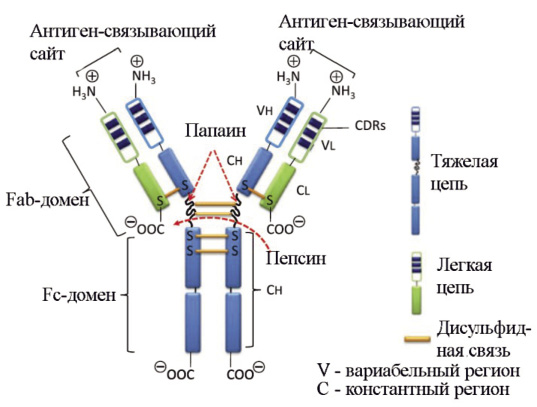
Эффективность и безопасность медицинского применения ВВИГ определяются дуализмом функции IgG: они могут специ фически взаимодействовать с чужеродными антигенами и одновременно способны вызывать неспецифические эффекты. Такая функциональная дихотомия является следствием особенностей структуры молекулы IgG. Ее вариабельный регион (два Fab-фрагмента) состоит из легкой и частично из тяжелой цепей и специфически взаимодействует с антигенами, что обусловлено меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы. Константный регион (Fc- или кристаллизующийся фрагмент) связывает компонент комплемента 1 (С1) и взаимодействует с Fc-рецепторами макрофагов или нейтрофилов. Активация эффекторной функции Fc-фрагмента антитела происходит после агрегации IgG на поверхности антигена, структура молекулы меняется, что служит сигналом для запуска системы комплемента или индукции опсонизации через фагоцитоз (рис. 1) [2].
Рис. 1. Схематическое строение иммуноглобулина G. Обработка пепсином приводит к расщеплению в участке молекулы на С-концевой стороне, за дисульфидной связью, соединяющей две тяжелые цепи вариабельного участка IgG. В результате образуются один сдвоенный F(аb’)-фрагмент [F(аb’)2] и один Fc-фрагмент. Расщепление IgG папаином происходит в N-концевом участке, непосредственно перед дисульфидной связью, в результате образуются два одинаковых Fab-фрагмента и один Fc-фрагмент [12]
Обобщение опыта клинического применения ВВИГ позволило Е.К. Донюш [3] утверждать, что они обеспечивают:
– увеличение бактерицидной активности сыворотки, стимуляцию фагоцитоза, нейтрализацию некоторых бактериальных токсинов;
– блокаду дифференцировки В-лимфоцитов, продуцирующих антитела;
– предотвращение или блокаду взаимодействия аллергена с IgE, фиксированного на тучной клетке, за счет IgG4 блокирующих антител;
– подавление продукции аллерген-специфических и ауто-антител за счет воздействия антиидиотипических антител;
– снижение продукции и активности провоспалительных цитокинов;
– предупреждение комплемент-зависимого повреждения тканей за счет связывания C3b и C4b компонентов комплемента;
– предохранение от дополнительных вирусных инфекций, обладающих триггерным эффектом при аутоиммунных заболеваниях.
Первыми неспецифическими иммуноглобулинами, использованными в клинической практике, были иммуноглобулины для внутримышечного применения (intramuscular immunoglobulin, IMIG). В России разрешены иммуноглобулин человека нормальный, противоаллергический и 6 специфических иммуноглобулинов, получаемых из плазмы крови иммунизированных людей (противооспенный, антирабический, антистафилококковый, противостолбнячный, против гепатита В и клещевого энцефалита) [1].
Технология приготовления таких иммуноглобулинов разработана в 1940-х гг. Включает этапы получения плазмы крови человека и осаждения из нее IgG этанолом при температуре ниже 0 °С и определенном значении рН [1, 2]. Дополнительной очистки IgG не проводится. Получаемый препарат содержит 70–80 % мономерных IgG и значительные количества IgA и IgM. Вводимые в его составе в организм человека антитела имеют обычный период полураспада, активируют комплемент в присутствии антигена и обладают опсонизирующими свойствами. Применение нормальных иммуноглобулинов оказалось эффективным для профилактики и лечения кори, гепатита А и для предупреждения бактериальных инфекций у детей с наследственной агаммаглобулинемией [3, 12].
Непреодолимыми в рамках данной технологии получения IgG недостатками данных препаратов, стали болезненность в месте введения, низкая скорость поступления антител в системный кровоток и невозможность быстро создавать высокие концентрации антител в ургентных ситуациях. При попытках внутривенного введения у пациентов развивались опасные анафилактоидные реакции и гипотония, что связано с неспецифической активацией комплемента в результате спонтанного образования агрегатов иммуноглобулинов и наличием в препарате следовых количеств протеаз [7]. Поэтому применение препаратов, полученных по данной технологии, ограничено внутримышечным введением.
Попытки повысить безопасность ВВИГ в 1960-х гг. привели к значительному снижению терапевтической эффективности таких препаратов. Сделав правильный вывод о ключевой роли Fc-фрагмента IgG в неспецифической активации комплемента, разработчики предприняли попытки получить ВВИГ либо без такого фрагмента, либо инактивировав его в составе IgG. Для этого IgG расщепляли пепсином, но F(аb’)2 исчезали из кровотока в течение 2 суток; расщепление плазмином приводило к получению моновалентных F(аb’) с низкой нейтрализующей способностью; не удавалось добиться и полной инактивации Fc-фрагмента в составе IgG обработкой алкилирующими и ацетилирующими соединениями. К тому же энзиматические и химические модификации IgG приводили к утрате ими важной физиологической функции – активации комплемента комплексом «антиген-антитело», что необходимо для эффективного лизиса бактерий и вирусов, поглощенных лейкоцитами [12]. В настоящее время выпуск таких препаратов прекращен [2].
Низкая терапевтическая эффективность энзиматических и химических производных IgG вынудила разработчиков ВВИГ в начале 1970-х гг. вернуться к получению интактного IgG. Особую значимость для потребителей препаратов крови в те годы приобрела их вирусная безопасность. Проблемы качества и безопасности ВВИГ на основе интактного IgG решались строгой государственной регламентацией процессов сбора и фракционирования плазмы доноров, контроля производства. Были разработаны национальные и международные документы, регулирующие производство ВВИГ. Система таких мер приведена в табл. 1.
Меры безопасности и контроля качества при производстве ВВИГ [12]
Требования к этапу, критические для обеспечения качества/безопасности ВВИГ
Учреждение по заготовке крови (лицензирование и проверяются национальным регулирующим органом; контроль оборудования, фракционирующего плазму)
Скрининг донор крови и плазмы
Эпидемиологический надзор за населением, идентификация доноров, конфиденциальное анкетирование кандидатов в доноры на наличие факторов риска, анализ их медицинских документов и анкеты
Процедура сбора крови/плазмы
Контроль длительности процедуры забора крови у доноров, смешивания с растворами, предотвращающими коагуляцию, температуры от момента забора крови до ее направления в блок переработки и др. параметров процесса, определенных нормативным документом
Тестирование донора на вирусоносительство перед забором крови
Выявление антител к ВИЧ 1 и 2, вирусам гепатитов А, В и С, HBsAg, парвовируса В19. Исследование должно проводится индивидуально или минипулами, использованные методы должны быть валидированы
Другие тесты у доноров
Тестирование на изоагглютинины к антигенам А, В, D, не использование крови доноров с высокими титрами антител к этим антигенам
Должна использоваться плазма, замороженная в течение 24–72 ч после забора
Замораживание и хранение плазмы
Должен использоваться быстрый способ замораживания плазмы, в процессе ее хранения температура не должна меняться
Во время транспортировки должен вестись постоянный мониторинг температуры ее хранения с записью соответствующим оборудованием. Температура хранения при транспортировке должна быть минус 20 °С или менее
Предприятия по фракционированию плазмы крови (лицензирование и инспекция национальным регулирующим органом)
Используются технологии амплификации нуклеиновых кислот. Определяется нуклеиновая кислота ВИЧ 1 и 2, вирусов гепатитов А, В и С, парвовируса В19
Тестирование производственного пула
Антитела на ВИЧ 1 и 2, вирус гепатита С, HBsAg (обязательно); РНК вируса гепатита С (обязательно в Европе). Исследование нуклеиновых кислот других вирусов – в соответствии с регулирующими документами
Предприятие по фракционированию плазмы
Должно быть разработано, построено и функционировать в соответствии с GMP
Этапы очистки белков и инактивация вирусов
Все процессы должны быть валидированы, все операции должны выполняться в соответствии с утвержденной СОП
Стерилизующая фильтрация и асептическое заполнение упаковок
Лиофильное высушивание (когда необходимо)
Проверка конечного продукта
Все операции должны выполняться в соответствии с утвержденной СОП
Устранение недостатков, характерных для ВВИГ на основе интактного IgG, проводилось путем более тщательной очистки препарата от агрегатов иммуноглобулинов, протеаз, плазмина, плазминогена, активатора прекалликреина, примесей IgA и IgM. Е.К. Донюш [3] выделяет 4 поколения ВВИГ.
Препараты первого поколения – начало 1970-х гг., это энзиматически и химически модифицированные IgG, не имевшие функционального Fc-фрагмента.

Рис. 2. Основные технологии, используемые для получения коммерческого ВВИГ и других компонентов крови из плазмы человека [12]. А, Б, В и Г – технологии, описанные в работах Bertolini J. [8], Teschner W. et al. [17], Terpstra F.G. et al. [16] и Stucki M. еt al. [15] соответственно
Препараты второго поколения – конец 1970-х гг., включали полностью интактную молекулу IgG с активной Fc-функцией и могли применяться не только с целью заместительной, но и иммуномодулирующей терапии. Однако степень их очистки оставалась низкой, они содержали IgA в количествах, вызывающих анафилактические реакции при внутривенном введении, показатель Fc-функции не превышал 70–75 %.
Препараты третьего поколения создавались в середине-конце 1980-х гг., характеризовались высокой чистотой и полной активностью Fc-фрагмента, высокой степенью вирусной безопасности, достигаемой многоступенчатым процессом производства. Выпускались в жидком виде и могли храниться при температуре 2–8 °С.
Препараты четвертого поколения – препараты, удовлетворяющие более жестким требованиям вирусной безопасности и физиологического распределения IgG по подклассам. Разработаны в 1990-х гг. и широко используются в настоящее время. Имеют высокую чистоту IgG с нормальным распределением по подклассам, содержание мономеров и димеров более 95 %. Активность Fc-фрагмента молекулы IgG приближается к 100 %. Препараты получают, используя многоступенчатую схему инактивации вирусов, включающую не менее двух самостоятельных методов (сольвент-детергентная обработка + инкубация при низких значениях рН или пастеризация в сочетании с обработкой полиэтиленгликолем). Препараты выпускают в жидком виде, допускается хранение при комнатной температуре.
В качестве стабилизаторов ВВИГ четвертого поколения используются вещества, безопасные для пациентов с нарушением углеводного обмена и дисфункцией почек, 10 %-е растворы ВВИГ позволяют снизить объемную нагрузку на пациента. Учитывая, что степень очистки IgG в препаратах четвертого поколения приближается к 100 %, их можно считать пределом развития всего направления получения ВВИГ из плазмы крови доноров. Отдельные усовершенствования будут касаться повышения эффективности технологий получения и клинического применения ВВИГ (препарат для подкожного применения, комбинации различных иммуноглобулинов в препарате и др.), их вирусной безопасности, способов очистки от примесей компонентов, которые раньше не считали способными влиять на результат клинического применения (растворимые молекулы CD4, CD8, HLA, следовые количества факторов свертывания крови VIII, IX, X, XI, XII и др.). Основные технологии, используемые в настоящее время для получения ВВИГ и других компонентов крови, показаны на рис. 2.
Получение коммерческого ВВИГ из плазмы человека начинается с отделения от нее так называемого «криопреципитата». Для этого замороженную плазму оттаивают в контролируемых условиях, затем центрифугируют с помощью центрифуг непрерывного действия (при температуре 2–3 °С). Полученный криосупернатант («cryosupernatant» или «cryo-poor plasma») используют для хроматографического выделения белков протромбинового комплекса, антитромбина или C1-ингибитора системы комплемента крови. Для осаждения фибриногена супернатант может подвергаться первой этанольной преципитации (8 % этанола при нейтральном значении pH). Для выделения ВВИГ используют три или четыре этапа осаждения этанолом при низких значения рН (осаждение по Кону) и обработку пепсином в низких концентрациях – при этом получают так называемую фракцию II (fraction II). Для уменьшения антикомплементарной активности ВВИГ и более глубокой очистки от IgА, осаждение этанолом может быть дополнено комбинацией этапов хроматографической очистки на катионных и анионных обменниках (с заменой третьего и четвертого осаждения по Кону). Выход фракции II при таком способе очистки плазмы составляет 3–6 г/л, в зависимости от исходного количества IgG в плазме и использованных методов его преципитации и последующей очистки [12].
Стандартная технология производства позволяет из 1 литра плазмы получить до 2,5 упаковок альбумина 10 %, до 3,5 упаковок иммуноглобулина для внутривенного введения 5 % и около 200–250 МЕ фактора VIII [4].
Основной тенденцией в стабилизации препаратов ВВИГ в настоящее время считается использование высокой концентрации IgG (100 мг/ мл по белку); слабокислой среды (рН 4,5–5,5); включение в лекарственную форму стабилизаторов, таких как полиолы (сорбит), сахара (мальтоза, глюкоза), или аминокислоты (глицин, пролин, изолейцин); отсутствие в препаратах хлорида натрия и сахарозы; осмолярность, близкая к физиологической; отсутствие консервантов и антибиотиков [1, 10].
Требования к свойствам ВВИГ следующие [3]:
– они должны иметь оптимальный спектр антител в соответствии с инфицированностью населения (более 1000 доноров);
– обладать доказанной эффективностью (с помощью контролируемых клинических исследований);
– распределения IgG по подклассам должно соответствовать их содержанию в плазме крови;
– для каждой партии препарата должен быть задекларирован титр антител;
– макроагрегаты должны составлять менее 1 % общего содержания IgG;
– антикомплементарная активность не должна превышать 1,0 СН50/1 мг белка протеина;
– гемолизины не должны содержаться в препарате, титр АВ-антител должен быть менее 1:8;
– активаторы прекалликреина, консерванты, активированные ферменты, токсические вещества не должны присутствовать в препарате;
– если предусмотрено применение у пациентов с врожденным дефицитом IgA; содержание IgA должно быть минимальным;
– высокая противовирусная очистка.
Возможность получения IgG с высокой степенью очистки позволила в последнее десятилетие вернуться к практике их подкожного введения, оказавшейся неудачной в 1940–1950-е гг. из-за большого количества реакций на балластные компоненты иммуноглобулинов, получаемых по технологиям того времени. Иммуноглобулины для подкожного введения (subcutaneous immunoglobulin, SCIG) в основном используются для лечения пациентов с врожденными нарушениями антителообразования (низкий уровень IgA), с повышенным содержанием в сыворотке крови воспалительных маркеров, флебитами, заболеваниями почек и другой патологией, создающей условия для осложнения при введении ВВИГ [6]. В настоящее время за рубежом в клинической практике используется не менее 6 SCIG. Сравнение свойств SCIG с аналогичными свойствами ВВИГ приведено в табл. 2.
Для улучшения проницаемости внеклеточного матрикса для IgG в SCIG добавляется рекомбинантная человеческая гиалуронидаза (rHuPH20), что позволяет сократить расход препарата на курс лечения пациента и добиться более высоких уровней антител в плазме крови [9]. По совокупности свойств и благодаря более простому применению в клинике, SCIG, особенно препараты с rHuPH20, способны вытеснить ВВИГ с рынка фармацевтических препаратов.
Существует серьезное противоречие между требованиями к качеству и эффективности ВВИГ, и его безопасностью. Прежде всего, оно имеет отношение к вирусной безопасности ВВИГ и других препаратов крови. Чтобы ВВИГ был эффективным и соответствовал критериям качества, плазма должна быть получена от как можно большего количества доноров, более 1000. Но чем больше донаций использовано для получения плазмы, тем больше риск того, что она будет инфицирована опасными для человека вирусами. Когда ВВИГ начали применять в клинической практике, считалось, что если IgG фракционируют холодным этанолом, то это обеспечивает вирусную безопасность полученных препаратов. Но эти надежды не оправдались, вирусы, особенно возбудитель гепатита С, продолжали находить в крупных партиях ВВИГ [19].