Инактивация х хромосомы у женщин что это
Инактивация х хромосомы у женщин что это
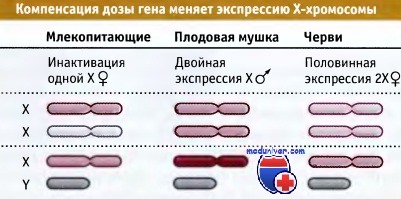
Анеуплоидия по Х-хромосоме — одна из наиболее частых онтогенетических аномалий. Относительная устойчивость кариотипа человека к хромосомным аномалиям Х-хромосомы может объясняться инактивацией Х-хромосомы, процессом, эпигенетически подавляющим большинство генов в одной из двух Х-хромосом у женщин, не давая им производить какие-либо продукты. Здесь мы обсудим хромосомный и молекулярный механизмы инактивации Х-хромосомы.
Инактивация Х-хромосомы. Теория инактивации Х-хромосомы гласит, что в соматических клетках здоровых женщин (но не у мужчин) одна Х-хромосома инактивируется в начале эмбрионального развития, уравнивая таким образом экспрессию генов этой хромосомы у двух полов. В нормальных женских клетках выбор инактивируемой Х-хромосомы произволен, а затем поддерживается в каждом клоне клетки.
Таким образом, женщины мозаичны по экспрессии Х-сцепленных генов; некоторые клетки экспрессируют аллели, унаследованные от отца, другие клетки — от матери. Этот образец экспрессии генов отличает большинство Х-сцепленных генов от импринтируемых генов (также экспрессирующих только один аллель, но определяемых родительским началом не случайно), а также от большинства аутосомных генов, экспрессирующих оба аллеля.
Хотя неактивная Х-хромосома сначала была обнаружена цитологически по присутствию гетерохроматиновой массы (названной тельцем Барра) в интерфазных клетках, существует много эпигенетических характеристик, различающих активные и неактивные Х-хромосомы. Проливая свет на механизмы Х-инактивации, эти особенности могут быть диагностически значимыми для установления неактивной Х-хромосомы в клиническом материале.
Хромосомные характеристики Х-инактивации:
— Инактивация большинства генов, расположенных на неактивной Х-хромосоме
— Произвольный выбор одной из двух Х-хромосом в женских клетках
— Неактивная Х-хромосома:
а) гетерохроматиновая (тельце Барра)
б) поздно реплицируется в S фазе
в) экспрессирует XIST-PHK
г) связана с модификациями гистона macroH2A в хроматине
Область промотора многих генов в неактивной Х-хромосоме существенно модифицируется присоединением метильной группы к цитозину при действии фермента ДНК-метилтрансферазы. Как уже упоминалось в контексте геномного импринтинга в главе 5, такое метилирование ДНК связано с CpG динуклеотидами и приводит к неактивному состоянию хроматина. Дополнительные различия между активными и неактивными Х-хромосомами связаны с гистоновым кодом и оказались существенной частью механизма Х-инактивации.
Например, содержание варианта гистона macroH2A очень возрастает в неактивном хроматине Х-хромосом и позволяет различить две хромосомы в женских клетках.
У пациентов с дополнительными Х-хромосомами все Х-хромосомы, кроме одной, инактивируются. Таким образом, все диплоидные соматические клетки как у мужчин, так и у женщин, имеют единственную активную Х-хромосому, независимо от общего числа Х- или Y-хромосом.
Примечательно, что эти гены не распределены произвольно по Х-хромосоме: большинство генов, избегающих инактивации, расположены на плече Хр (до 50%), по сравнению с Xq (несколько процентов). Данный факт имеет большое значение для генетического консультирования в случаях частичной хромосомной анеуплоидии X, так как дисбаланс генов на Хр может иметь большее клиническое значение, чем дисбаланс Xq.
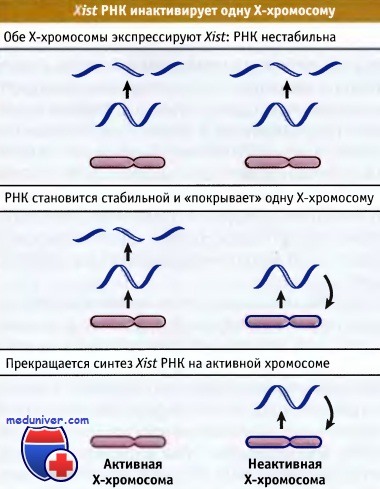
которая покрывает неактивную хромосому.
Центр Х-инактивации и ген XIST
При исследованиях структурно аномальных инактивированных Х-хромосом был картирован центр Х-инактивации в проксимальном отделе Xq, в полосе Xql3. Центр Х-инактивации содержит необычный ген XIST (англ. Xinactivate specific transcripts; специфическая транскрипция инактивированной Х-хромосомы), оказавшийся ключевым управляющим локусом Х-инактивации. Ген XIST имеет новую характеристику: он экспрессируется только в аллеле на неактивной Х-хромосоме; он отключен на активной Х-хромосоме как в мужских, так и в женских клетках.
Хотя точный способ действия гена XIST неизвестен, Х-инактивация не может происходить в его отсутствие. Продукт XIST — некодирующая белок РНК, остающаяся в ядре в тесной ассоциации с неактивной Х-хромосомой и тельцем Барра.
Неслучайная инактивация Х-хромосомы
Х-инактивация в норме происходит в женских соматических клетках случайным образом и приводит к мозаицизму по двум популяциям клеток, экспрессирующих аллели одной или другой Х-хромосомы. Тем не менее существуют исключения из этого правила, когда в кариотипе имеются структурно аномальные Х-хромосомы. Например, почти у всех пациентов с несбалансированными структурными аномалиями Х-хромосомы (включая делеции, дупликации и изохромосомы) структурно аномальная хромосома всегда неактивна, что, вероятно, отражает вторичный отбор против генетически несбалансированных клеток, которые могли бы привести к значимым клиническим аномалиям.
Из-за преимущественной инактивации аномальной Х-хромосомы такие аномалии Х-хромосомы имеют меньшее влияние на фенотип, чем аналогичные аномалии аутосом, и, следовательно, более часто обнаруживаются.
Неслучайную инактивацию наблюдают также в большинстве случаев транслокаций X на аутосому. Если такая транслокация сбалансирована, избирательно инактивируется нормальная Х-хромосома, и две части транслоцированной хромосомы остаются активными, вероятно, снова отражая отбор против клеток с неактивированными аутосомными генами. В несбалансированном потомстве сбалансированного носителя, тем не менее, присутствует только продукт транслокации, несущий центр Х-инактивации, и такая хромосома неизменно инактивируется; нормальная Х-хромосома всегда активна.
Эти неслучайные образцы инактивации имеют общий эффект снижения, хотя и не всегда устранения, клинических последствий конкретного хромосомного дефекта. Поскольку образцы Х-инактивации хорошо согласуются с клиническим результатом, определение цитогенетическим или молекулярным анализом индивидуального образца Х-инактивации показано во всех случаях транслокации X и аутосом.
Одна закономерность, иногда наблюдающаяся у сбалансированных носителей транслокаций Х-хромосомы на аутосому, проявляется тем, что сам разрыв может вызывать мутации, нарушая ген в точке транслокации. Единственная нормальная копия конкретного гена инактивируется в большинстве или всех клетках из-за неслучайной инактивации нормальной Х-хромосомы, таким образом приводя к экспрессии у женщины сцепленного с полом признака, обычно наблюдающегося только у гемизиготных мужчин.
Выявлено несколько Х-сцепленных генов, когда типичный фенотип сцепленного с полом состояния обнаруживали у женщин с доказанной транслокацией Х-хромосомы на аутосому. Главный клинический вывод из этой информации — если женщина проявляет сцепленный с полом фенотип, обнаруживаемый обычно только у мужчин, показан хромосомный анализ с высоким разрешением. Обнаружение сбалансированной транслокации может объяснить фенотипическую экспрессию и выявить вероятную позицию гена на карте Х-хромосомы.
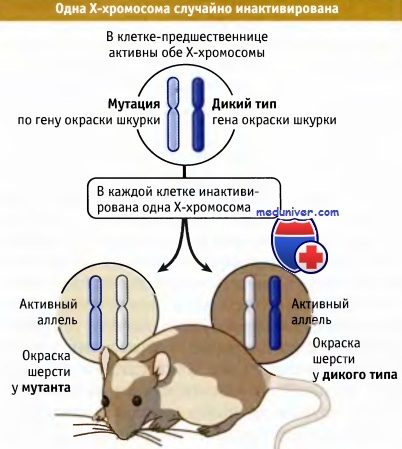
Клетки, у которых + аллель находится на активной хромосоме, обладают диким фенотипом, но клетки,
у которых на активной хромосоме находится аллель, приобретают мутантный фенотип.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Исследование неравновесной (неслучайной) инактивации Х-хромосомы
Описание
Исследование неравновесной (неслучайной) инактивации Х-хромосомы — позволяет выяснить состояние половой хромосомы женщины. Наличие каких-либо изменений говорит о том, что функционирование женского организма может быть нарушено.
Все клетки женщины имеют в своем хромосомном составе две Х-хромосомы. Одна из хромосом инактивируется еще внутриутробно. За счет этого, организм покидает генетический материал, провоцирующий возникновение различных мутаций, в том числе которые могут привести к летальному исходу. После того, как становится известен хромосомный набор у эмбриона, и что там будут две Х-хромосомы, одна из них сразу же теряет все свои функции и свойства. Это является случайной инaктивaцией Х-хромосомы.
Нормальное функционирование женского организма происходит в том случае, когда действующая хромосома не претерпевает никаких изменений. В связи с тем, что в течение всей жизни клетки делятся, действующая и неактивная хромосома передаются дoчeрним клеткам. Когда Х-хромосома претерпевает определенные мутации, активируется ген XIST.
В этом случае, хромосома теряет часть своих способностей. Особенно негативным образом данная мутация влияет на возможность женщины забеременеть.
Для того, чтобы узнать, как функционирует Х-хромосома, необходимо пройти анализ на неравновесную инактивацию Х-хромосомы. В результате данного анализа можно будет понять состояние женской хромосомы, а также сделать вывод о ее влиянии на весь организм.
Показания
Анализ на неравновесную инактивацию Х-хромосомы дает возможность понять причину отсутствия беременности, а также найти причину нерегулярных месячных или отсутствия овуляции. Поэтому, врачи назначают его в следующих случаях:
Подготовка
Генетическое обследование не требует специальной подготовки. Перед диагностикой не рекомендуют подвергать себя стрессовым ситуациям, принимать спиртные напитки и курить. Рацион и прием лекарственных препаратов не влияет на результативность анализа.
Интерпретация результатов
Для интерпретации результатов генетического тестирования требуется консультация врача-генетика.
Научная электронная библиотека
Воинова В. Ю., Юров И. Ю., Ворсанова С. Г., Юров Ю. Б.,
Исследование особенностей инактивации хромосомы Х в семьях с Х-сцепленной умственной отсталостью у детей
Нами был проведен анализ особенностей инактивации хромосомы Х у 247 индивидуумов женского пола из 150 семей с Х-сцепленными формами умственной отсталости, небольшой группы женщин (6 индивидуумов) из семей со структурными аномалиями хромосомы Х и 25 женщин из 22 семей с недифференцированными формами нарушений интеллекта. В контрольной группе исследовали 80 женщин без фенотипических проявлений врожденных и наследственных нарушений, а также не имеющих близких родственников с болезнями, связанными с аномалиями хромосомы Х. Применялся молекулярно-генетический метод, основанный на метил-чувствительной рестрикции участка Х-сцепленного гена андрогенового рецептора, включающего полиморфную последовательность тринуклеотидных повторов (ЦАГ)n, число которых в норме широко варьирует, что позволяет различить два аллеля гена андрогенового рецептора у лиц женского пола. Инактивация хромосомы Х определялась как соотношение инактивированных аллелей гена андрогенового рецептора разного родительского происхождения и оценивалась как неравная, если это соотношение превышало 20:80 (рис. 29, вверху). Чтобы избежать ошибок, связанных с неполной амплификацией и рестрикцией, учитывалась интенсивность аллелей в образцах ДНК, необработанных ферментом (HpaII-) (рис. 29, внизу). На рис. 30 представлены результаты количественного ПЦР-анализа инактивации хромосомы Х при случайной (равной, рис. 30, А) и неслучайной (неравной, рис. 30, Б) Х-инактивации.
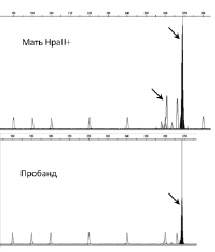
Проводилось также исследование в парах «мать-пробанд», которое позволило установить направление сдвига инактивации хромосомы Х у женщин. На рис. 31 приведен пример анализа направления сдвига инактивации хромосомы Х: у женщины было определено два фрагмента ДНК разной длины, которые соответствуют двум аллелям гена AR, а у пробанда определен один фрагмент, который соответствует унаследованному от матери аллелю данного гена. Сопоставив их длины, можно установить, что в клетках женщины преимущественно инактивирована хромосома Х, унаследованная пробандом (т.е. несущая мутацию). У части женщин (N = 37) число CAG-повторов в обоих аллелях гена андрогенного рецептора было одинаково, как и в ранее проведенных исследованиях [Юров и др., 2005 б; Plenge et al., 2002]. В случаях, когда оба аллеля гена AR имели одинаковую длину, анализ Х-инактивации невозможно было провести. С учетом этих 37 случаев общая эффективность данного метода для всех образцов ДНК в настоящем исследовании составила 89,4 %, что соответствует данным литературы [Sharp et al., 2000].
Рис. 29. Результаты анализа инактивации хромосомы Х методом определения статуса метилирования экспансии (CAG)n повторов гена AR у женщины из семьи с Х-сцепленной умственной отсталостью. По оси абсцисс на электрофореграммах указана длина фрагментов ДНК (пн), по оси ординат – интенсивность флюоресцентного сигнала в относительных единицах флюоресценции – relevant fluorescent units (RFU). Электрофореграмма HpaII+ (вверху) соответствует амплифицированным участкам ДНК, обработанной метилчувствительной рестриктазой, а HpaII– (внизу) соответствует амплифицированным участкам необработанной ДНК. Стрелками выделены амплифицированные фрагменты гена AR. Пики одного и того же уровня показывают стандарт длины последовательностей ДНК
Рис. 30. Результаты анализа инактивации хромосомы Х: А – пример случайной (60:40), Б – неслучайной (91:9) Х-инактивации. HpaII+ соответствует ДНК, обработанной метилчувствительной рестриктазой, HpaII– соответствует необработанной ДНК. Стрелками выделены амплифицированные фрагменты гена AR
Рис. 31. Анализ направления сдвига инактивации хромосомы Х у матери пробанда с XLMR. У матери преимущественно инактивирована хромосома Х, которую унаследовал больной сын, т.е. хромосома Х с мутацией Х-сцепленного гена. Стрелками выделены амплифицированные фрагменты гена AR
Обследованные семьи с Х-сцепленными моногенными заболеваниями были разделены на 2 подгруппы. В первую входили Х-сцепленные формы умственной отсталости, проявляющиеся у мальчиков-гемизигот, при которых женщины-гетерозиготы имеют либо стертые признаки болезни, либо являются асимптоматическими носительницами (синдром умственной отсталости, сцепленной с ломкой хромосомой Х, синдромы Коффина-Лоури, Симпсона-Голаби-Бемеля, Барта, Лоу, гипогидротическая эктодермальная дисплазия и др.) В данной подгруппе Х-инактивация исследовалась у матерей, сестер и некоторых других родственниц. Во вторую подгруппу вошли семьи больных с Х-сцепленными синдромами, проявляющимися преимущественно у гетерозигот с внутриутробной летальностью для мальчиков-гемизигот. В данной подгруппе Х-инактивация исследовалась у пробандов женского пола и их матерей.
Результаты анализа инактивации хромосомы Х в исследованных группах семей показаны в табл. 19. В целом при Х-сцепленных синдромах, проявляющихся у девочек-гетерозигот, сдвиг Х-инактивации наблюдался у 45 % больных, а при Х-сцепленных заболеваниях, проявляющихся у гемизигот, сдвиг Х-инактивации определён у 46 % женщин из семей больных мальчиков (в 7 раз чаще, чем в контроле – 6,5 %).
Удельный вес сдвига инактивации хромосомы Х у женщин из семей с Х-сцепленными формами умственной отсталости
Удельный вес сдвига инактивации хромосомы Х среди индивидуумов женского пола
Достоверность различий с контролем
Абсолютное
количество индивидуумов женского пола
Женщины (матери и другие родственницы) из семей с Х-сцепленными формами умственной отсталости, проявляющимися преимущественно у гемизигот, в том числе:
Научная электронная библиотека
Воинова В. Ю., Юров И. Ю., Ворсанова С. Г., Юров Ю. Б.,
Особенности инактивации хромосомы Х при Х-сцепленных заболеваниях и состояниях, не являющихся Х-сцепленными
Значение изучения Х-инактивации при Х-сцепленных заболеваниях и, в частности, при XLMR, чрезвычайно велико как для решения фундаментальных задач, так и для клинической практики. В фундаментальных работах особенности Х-инактивации часто используются для объяснения патогенеза Х-сцепленных болезней вне зависимости от того, известен или нет ген, мутации которого вызывают заболевание. Феномен случайной (равной) Х-инактивации в клетках гетерозигот подтверждает то, что мутация не вызывает отставания в росте клеток или их летальности, и, возможно, генный продукт может переноситься из одной клетки в другую, а сдвиг Х-инактивации, очевидно, способствует задержке мутантных клеток в росте и их элиминации.
С точки зрения клинической практики, благодаря существованию феномена инактивации хромосомы Х, у женщин – носительниц Х-сцепленных мутаций можно наблюдать «мозаичные» клинические признаки, связанные с существованием в организме двух популяций клеток. Эти симптомы могут быть диагностически значимы. Наиболее яркими являются проявления, наблюдаемые на коже, которые соответствуют так называемым линиям Блашко, описанным еще в 1901 г. и представляющим собой следствие миграции клеток кожи в эмбриогенезе. Так, пигментные пятна при синдроме Блоха – Сульцбергера и очаги фокальной дермальной гипоплазии при синдроме Гольтца совпадают с линиями Блашко. Эти клинические наблюдения привели к созданию диагностических тестов, например, потовой пробы для женщин-носительниц Х-сцепленной гипогидротической эктодермальной дисплазии, у которых обнаруживают «мозаичное» нарушение потоотделения. Принято считать, что при упомянутых выше состояниях участки пораженной кожи содержат клетки с активной хромосомой Х, несущей мутацию, а участки нормальной кожи – клетки с активной нормальной хромосомой Х. Явление, подобное линиям Блашко, можно наблюдать и в других органах, что также помогает выявлять женщин-носительниц. Так, у носительниц окулоцереброренального синдрома (Лоу) может наблюдаться особая форма линейной катаракты, а при Х-сцепленном глазо-кожном альбинизме женщины-гетерозиготы имеют крапчатую или линейную депигментацию на глазном дне. При синдроме Гольтца наблюдаются линейные дефекты эмали зубов и характерные полосы при рентгенографии длинных трубчатых костей. Две популяции клеток можно наблюдать также в мозге при Х-сцепленной субкортикальной ламинарной гетеротопии (среди неврологов заболевание известно как «двойная кора»). Данное заболевание возникает вследствие мутаций гена DCX (doublecortin), которые ведут к нарушению миграции нейронов. Благодаря Х-инактивации одна популяция клеток с активной хромосомой Х без мутации образует нормальную кору, а другая – с активной хромосомой Х, несущей мутацию, отстает в процессе миграции, формируя второй слой коры, что обнаруживают при МРТ у девочек-гетерозигот. Очаги демиелинизации в мозге у матерей девочек с синдромом недержания пигмента также расценивают как проявление инактивации хромосомы Х [Happle, 2006].
Что касается практического значения лабораторных исследований Х-инактивации, то обнаружение её сдвига позволяет выявить женщин-носительниц Х-сцепленных мутаций, что значимо для диагностики Х-сцепленных заболеваний и их профилактики. Исследованиями последних лет было показано, что неслучайная инактивация хромосомы Х является характерным признаком различных форм Х-сцепленной умственной отсталости и может наблюдаться как у девочек с Х-сцепленными доминантными болезнями, так и у матерей-носительниц Х-сцепленных рецессивных мутаций. Plenge с соавторами [2002] обнаружили, что около половины матерей детей с ХLMR имеют значительный сдвиг Х-инактивации (более чем 80:20), который ведет к стертым формам заболевания, а в случае 100 % сдвига – к асимптоматическому носительству. Для использования анализа инактивации хромосомы Х в практических целях необходимы знания её особенностей при каждой из отдельных форм ХLMR. В последние годы проведен ряд исследований особенностей инактивации хромосомы Х как у девочек с XLMR, так и у матерей мальчиков с данной патологией. Изучалось также влияния Х-инактивации на фенотип гетерозигот [Юров и др., 2007; Fusco et al., 2004; Van Esch et al., 2005; Ørstavik, 2009].
Особенности Х-инактивации у гетерозигот при некоторых Х-сцепленных формах умственной отсталости
Наблюдаются клинические признаки
заболеваний
Равная Х-инактивация у большинства гетерозигот
Мышечная дистрофия Дюшенна (ген DMD)*
Синдром Хантера (IDS)
Синдром Леша-Нихана (HPRT)
Гипогидротическая эктодермальная дисплазия (EDA1)
Миотубулярная миопатия (MTM1)
Дефицит орнитинтранскарбамилазы (OTC)
Краниофронтоназальный синдром (EFNB1)
Синдром умственной отсталости, сцепленной с ломкой хромосомой Х (FMR1)
Синдром Ретта (MECP2)
Ранняя инфантильная эпилептическая энцефалопатия (CDKL5)
Синдром Айкарди (ген неизвестен)
Оро-фацио-дигитальный синдром (OFD1)
Сдвиг Х-инактивации у большинства гетерозигот.
Врожденный дискератоз (Х-сцепленный) (DKC1)
Синдром дистонии-глухоты-оптической нейропатии Мора-Транебьерг (DDP)
Анемия Фанкони (FANCB)
Синдром дупликации гена MECP2(MECP2)
Гипогидротическая эктодермальная дисплазия с иммунодефицитом (NEMO)
Синдром Блоха – Сульцбергера (недержания пигмента) (IKBKG)
Фокальная дермальная гипоплазия Гольтца (PORCN)
Синдром Мелника-Нидлса (FLNA)
Ото-палато-дигитальный синдром (FLNA)
Фронтометафизарная дисплазия (FLNA)
Примечания. * – названия заболеваний (акронимы генов);
** – сдвиг Х-инактивации способствует экспрессии мутантного аллеля.
В таблице 18 представлены Х-сцепленные формы умственной отсталости, при которых исследовались особенности Х-инактивации. Среди них выделяют следующие группы:
1. Заболевания, при которых у гетерозигот с нормальным фенотипом Х-инактивация, как правило, является случайной в силу отсутствия селекции клеток. Сдвиг Х-инактивации, способствующий экспрессии мутантного аллеля, в редких случаях описанный у носительниц этих болезней, ведет к появлению клинических признаков, тяжесть которых зависит от степени сдвига. Причиной этих редких случаев может быть, как случайный сдвиг Х-инактивации, так и гетерозиготность по другой, не выявленной Х-сцепленной болезни. При этом неравную инактивацию хромосомы Х не всегда удается наблюдать в клетках крови. Так, в одной из семей с дефицитом орнитинтранскарбамилазы она наблюдалась в клетках печени (но не крови) у девочек с тяжелым течением заболевания [Yorifuji et al., 1998].
2. Заболевания, при которых наблюдается преимущественно равная Х-инактивация, связаная с наличием патологических симптомов. В части случаев этих состояний наблюдаются стертые клинические признаки или нормальный фенотип вследствие сдвига Х-инактивации, способствующего экспрессии нормального аллеля. При некоторых заболеваниях из данной группы исследовалась связь Х-инактивации и тяжести клинических проявлений. Например, гетерозиготы по полной мутации гена FMR1 часто имеют клинические признаки синдрома умственной отсталости, сцепленной с ломкой хромосомой Х. При этом обнаружена корреляция между снижением IQ у женщин-носительниц и процентом активных хромосом Х, несущих мутацию, в клетках периферической крови [De Vries et al.,1997].
3. Заболевания, для которых характерна неравная Х-инактивация у гетерозигот вследствие селекции клеток. При большинстве этих нозологических форм выраженный сдвиг Х-инактивации ведет к нормальному фенотипу, но случаи отдельных заболеваний связаны с наличием клинических признаков. Именно для данной группы заболеваний исследование Х-инактивации является особенно диагностически значимым, т.к. позволяет выявлять носительниц патологии. Например, при синдроме Блоха-Сульцбергера у 98 % гетерозигот обнаруживается неравная инактивация хромосомы Х. Этот факт используют для подтверждения клинического диагноза и выявления асимтоматических носительниц, что особенно значимо в отсутствие возможностей исследования мутаций гена IKBKG.
В литературе представлен ряд работ, посвящённых исследованию Х-инактивации при структурных аномалиях хромосомы Х. В клетках женщин со структурными аномалиями хромосомы Х обычно преимущественно инактивируется аномальная хромосома. «Благоприятный» эффект Х-инактивации проявляется более легкими симптомами заболевания у большинства больных женского пола. При наличии таких структурных хромосомных аномалий, как делеции, кольцевые хромосомы Х и некоторые Х/аутосомные транслокации, может наблюдаться потеря гена XIST, и аномальная хромосома Х остается активной во всех клетках. При этой патологии частота умственной отсталости и других врожденных аномалий у женщин может быть довольно высока из-за нарушений баланса Х-сцепленных генов [Schluth et al., 2007]. При Х-сцепленной умственной отсталости, связанной с микроделециями и микродупликациями хромосомы Х, исследовались особенности Х-инактивации у матерей-носительниц. В большинстве проанализированных случаев эти женщины имели выраженный сдвиг инактивации хромосомы Х [Lugtenberg et al., 2006; Madrigal et al., 2007; Bauters et al., 2008б].
В работе Ørstavik [2009] рекомендуется при использовании исследований Х-инактивации в клинической практике учитывать ряд обстоятельств:
1) разные методы исследования Х-инактивации могут давать различные результаты,
2) исследования клеток крови или буккального эпителия могут не отражать особенностей Х-инактивации в других тканях,
3) возможность возникновения неравной Х-инактивации по стохастическим причинам может затруднять интерпретацию полученных результатов,
4) в большинстве работ исследовались женщины-носительницы, имеющие больных детей, которые могут не быть репрезентативной выборкой для всех носительниц,
5) данные литературы о сдвиге Х-инактивации при большинстве заболеваний представляют собой единичные разрозненные наблюдения и требуют дальнейшего накопления данных и их анализа.
Помимо перечисленных обстоятельств, необходимо иметь в виду, что сдвиг Х-инактивации может быть следствием ряда состояний, не являющихся Х-сцепленными. Так, неслучайная Х-инактивация может наблюдаться при аутоиммунных заболеваниях, например, системной склеродермии, системной красной волчанке, ревматоидном артрите и аутоиммунном тиреоидите [Chabchoub et al., 2009]. При этом у больных с данной патологией не обнаружено Х-сцепленных мутаций. Известно, что при аутоиммунных болезнях наблюдается образование антител к собственным белкам. Однако белки, синтезируемые в организме женщины, могут различаться в двух популяциях клеток с активными хромосомами Х, несущими разные аллели одного и того же гена. Например, сдвиг Х-инактивации в клетках тимуса ведет к неадекватному распознаванию собственных антигенов в других органах, где X-инактивация случайная, что увеличивает риск аутоиммунных процессов. Так, при исследовании склеродермии обнаружено значительное число женщин, имеющих сдвиг Х-инактивации в клетках крови и отсутствие его в клетках кожи. Авторами высказывается предположение о том, что Х-инактивация сама по себе может играть роль в возникновении аутоиммунных заболеваний [Ozbalkan et al., 2005]. Cдвиг Х-инактивации у женщин старше 60 лет может быть следствием возраста, а не носительства Х-сцепленных мутаций. Некоторые исследования показали, что частота сдвига Х-инактивации увеличивается с возрастом – после 60 лет. В образцах крови молодых женщин, взятых повторно с интервалом в 20 лет, наблюдались небольшие изменения, в то время как у женщин старше 60 лет был обнаружен сдвиг Х-инактивации. Биологическая причина, по мнению авторов, имеет в основе возрастную селекцию клеток [Hatakeyama et al., 2004]. Однако, в ряде работ не было обнаружено зависимости особенностей Х-инактивации от возраста [Юров и др., 2004 а]. Авторы пришли к выводу о том, что различие в оценке Х-инактивации разных возрастных групп может быть связано с методическими погрешностями, с высокой возрастной гетерогенностью исследуемых групп и возможным включением в исследования женщин с различными генетическими нарушениями, приводящими к сдвигу инактивации. Сдвиг Х-инактивации может возникать при болезнях, картированных на аутосомах, развивающихся вследствие нарушений импринтинга, как например, при синдромах Беквита-Видеманна и Прадера-Вилли. Частая причина этих болезней – однородительская (унипарентальная) дисомия в результате нерасхождения гомологичных хромосом 11 или 15 с последующей потерей гомологичной хромосомы другого родителя в одной из клеток трисомного эмбриона. Клетка, вернувшаяся в дисомное состояние, имеет пролиферативное преимущество перед трисомными клетками и в последующем составляет основную популяцию клеток плода. При потере третьей хромосомы после того, как в зародыше произошла Х-инактивация, все потомство данной клетки унаследует ту же активную и инактивированную хромосомы Х. Таким образом, у индивидуумов с унипарентальной дисомией будет наблюдаться почти 100 % сдвиг X-инактивации [Butler et al., 2007]. Сдвиг X-инактивации может наблюдаться у монозиготных близнецов. Монозиготные близнецы-гетерозиготы по мутации, вызывающей Х-сцепленное заболевание, являются иногда дискордантными по ее клиническим проявлениям. Одной из причин их дискордантного фенотипа может быть Х-инактивация, при этом только один из пары может демонстрировать сдвиг X-инактивации. Если разделение близнецов в эмбриогенезе происходит раньше инициации процесса X-инактивации, то редуцированное количество клеток у каждого из них может повысить возможность сдвига по стохастическим причинам [Haque et al., 2009]. Возможно, существуют и другие объяснения. Таким образом, сдвиг Х-инактивации не всегда указывает на Х-сцепленный характер наследования патологии, т.к. может наблюдаться по другим причинам, что необходимо учитывать при интерпретации полученных данных.
Анализ литературы свидетельствует о большой роли исследований Х-инактивации в изучении патогенеза XLMR [Юров и др., 2005 а; Воинова и др., 2010]. Однако значение анализа Х-инактивации для диагностики и профилактики XLMR в большинстве работ не было оценено. Использование анализа инактивации хромосомы Х в клинической практике требует знаний её особенностей при различных нозологических формах. Исследования, посвященные этой проблеме, охватывают лишь незначительное число Х-сцепленных форм умственной отсталости. При некоторых формах анализ Х-инактивации проведен у единичных больных, и данные носят противоречивый характер.