Индукционная терапия что это
Индукционная терапия что это
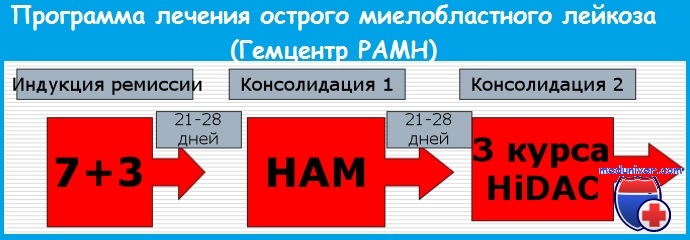
Стандартная индукционная терапия основана на комбинации цитарабина и антрациклина. Это приводит к достижению полной ремисии (ПР) у 50-75% больных моложе 60 лет.
Цитарабин в дозе 100 мг/м2 в день в виде постоянной инфузии в течение 7 дней в сочетании с даунорубицином (45 мг/м 2 в день в течение 3 дней цикла) является стандартным индукционным режимом «7+3». Больные, у которых не получена полная ремиссия (ПР) после первого курса терапии, имеют вероятность ее достижения после второго курса лечения по той же программе.
Частота полной ремиссии (ПР) при использовании «7+3» в качестве индукции достигает 60%, более короткие аналогичные циклы («5+2») менее эффективны.
При добавлении к данной комбинации 6-тиогуанина (режим «DAT» или «TAD») эффективность лечения аналогична. Добавление этопозида (VP-16) к «7+3» увеличивает длительность ремиссий у молодых пациентов. Перечисленные программы используются при всех вариантах острого миелоидного лейкоза (ОМЛ), хотя при отдельных формах отмечена более высокая эффективность некоторых цитостатиков (этопозида при миеломоно- и моноцитарных ОМЛ, этопозида и винкристина при мегакариоцитарном ОМЛ).
Убедительные данные о преимуществах индукционных программ второй генерации, в которых вместо даунорубицина используются митоксантрон, амсакрин или рубидазон, отсутствуют.
Идарубицин в комбинации с цитарабином обладает более высокой эффективностью по сравнению с даунорубицином у больных моложе 60 лет (полная ремиссия (ПР) часто достигается уже после первого курса индукции).
Использование высоких доз цитарабина (0,5-6,0 г/м2 в сутки в течение 3-8 дней) на этапе индукции способствует улучшению показателей длительной безрецидивной выживаемости, но сопровождается большей токсичностью и ранней летальностью.
Гемопоэтические ростовые факторы (Г-КСФ и ГМ-КСФ) применяются с целью уменьшения гематологической токсичности (сокращение длительности нейтропении) при проведении интенсивной индукционной терапии. Попытки использования этих препаратов до начала химиотерапии с целью усиления пролиферации лейкозных клеток и увеличения их чувствительности к цитостатикам не имели успеха.
Профилактика и лечение нейролейкоза при остром миелоидном лейкозе (ОМЛ)
Вовлечение в процесс ЦНС наблюдается редко при диагностике острого миелоидного лейкоза (ОМЛ), поэтому при отсутствии патологической неврологической симптоматики исследование цереброспинальной жидкости показано лишь в некоторых случаях.
Основными факторами риска развития нейролейкоза при остром миелоидном лейкозе (ОМЛ) являются монобластный и миеломонобластный варианты, а также гиперлейкоцитоз (более 100 • 10 9 /л). В этих ситуациях рекомендуется проведение профилактики нейролейкоза (6 интратекальных введений метотрексата и цитарабина во время проведения курсов индукционной химиотерапии).
Развитие нейролейкоза характеризуется появлением различной неврологической симптоматики, однако единственным подтверждением специфической природы поражения является обнаружение бластов в ликворе. Цефалгии и спутанность сознания могут быть следствием лейкостаза и микроэмболии мозговых сосудов (при остром миелоидном лейкозе (ОМЛ) с бластозом более 100 • 109/л). При этом показана ургентная терапия (лейкаферез или химиотерапия) с целью быстрого уменьшения количества бластных клеток в периферической крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стандартная индукционная терапия АНЦА-ассоциированных системных васкулитов: мифы и реальность
ФГБНУ Научно-исследовательскийинститут ревматологии им. В.А. Насоновой, Москва
АНЦА-ассоциированные системные васкулиты (АНЦА-СВ) сохраняют свое значение как одна из наиболее важных проблем практической ревматологии. Поздняя диагностика и запоздалое назначение индукционной терапии, неполное выполнение или ошибочное применение научно-обоснованных протоколов лечения способствуют более тяжелому течению АНЦА-СВ с необратимым повреждением органов, присоединением осложнений, повышением риска рецидива. Несмотря на внедрение при АНЦА-СВ высоко эффективной и относительно безопасной новой лечебной стратегии с использованием ритуксимаба, стандартная индукционная терапия циклофосфаном по-прежнему сохраняет равноправное значение как метод лечения первого ряда. Основой успешной стандартной индукционной терапии является рациональное и персонифицированное поддержание тонкого баланса между применением рекомендованного режима, достаточного для стойкого подавления активности АНЦА-СВ, и одновременного сдерживания риска осложнений лечения.
Системные васкулиты (СВ), ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА), являются жизнеугрожающими аутоиммунными заболеваниями, для которых характерно полиорганное поражение. В соответствии с современной классификацией группа АНЦА-СВ включает гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА), объединенные общностью патогенеза с ключевой ролью гиперпродукции АНЦА, сходством клинического течения и прогноза [1]. Необходимость ранней диагностики АНЦА-СВ и неотложного назначения активной терапии продиктована упорным, прогрессирующим течением этих заболеваний с фатальным прогнозом в отсутствие своевременного и адекватного лечения. Так, средняя продолжительность жизни больных ГПА без лечения не превышает 5 месяцев, летальность за первый год болезни достигает 82% [2]. МПА отличает худший прогноз по сравнению с другими формами АНЦ-СВ [3, 4].
Лечение АНЦА-СВ подразделяют на этапы индукционной и поддерживающей терапии. Термин «индукционная терапия» (ИТ) применяют по отношению к протоколам лечения, направленным на достижение ремиссии заболевания. Современное лечение аутоиммунных заболеваний, так же как и онкогематологической патологии, осуществляют в соответствии с протоколами, разработанными в результате систематически и транспарентно развивающегося международного научного процесса и представляющими собой научнообоснованные, ориентированные на практику руководства. Такие рекомендации, как правило, одобрены консенсусом комиссии экспертов в соответствии с рейтинговой схемой, включающей общепринятые понятия: уровень доказательности и силу рекомендации [5]. Так, уровень доказательности Ia и Iв обоснован как минимум одним рандомизированным контролируемым клиническим исследованием хорошего качества, непосредственно посвященным теме данной рекомендации и демонстрирующим общую устойчивость результатов.
Системные проблемы в лечении АНЦА-СВ могут быть связаны с неполным выполнением или ошибочным применением в условиях реальной клинической практики научно-обоснованных протоколов лечения. Повсеместно в мире обращают внимание на рост несоответствия между теоретическими знаниями и прикладной деятельностью [6]. С другой стороны, жесткое внедрение протоколов диагностики и лечения может приводить к сужению врачебного мышления.
В настоящее время при АНЦА-СВ эффективно применяют два общепринятых протокола ИТ: стандартное лечение циклофосфаном (ЦФ) в сочетании глюкокортикоидами (ГК) и пополнившую в последние годы арсенал ИТ биологическую анти-В-клеточную терапию ритуксимабом (РТМ) [7]. Поздняя диагностика и запоздалое назначение ЦФ или РТМ способствуют более тяжелому течению АНЦА-СВ с необратимым повреждением органов, присоединением осложнений, повышением риска рецидива.
Несмотря на высокую эффективность при АНЦА-СВ и относительную безопасность новой стратегии с использованием РТМ, в т.ч. для больных с длительным рецидивирующим течением заболевания или рефрактерных к ЦФ [8–11], стандартная схема, включающая ЦФ, по-прежнему обоснованно сохраняет равноправное значение как метод лечения первого ряда.
При планировании ИТ необходимо учитывать ряд факторов, в первую очередь тяжесть течения АНЦА-СВ и наличие коморбидной патологии. Рациональное и персонифицированное назначение ИТ базируется на оценке степени активности (индекс активности) [12] и фазы клинического течения (дебют, рецидив, ремиссия), определении риска тяжелых осложнений заболевания и факторов неблагоприятного прогноза [13], степени повреждения органов или тканей (индекс повреждения) [14], которое в отличие от воспалительной активности не будет поддаваться обратному развитию в результате лечения.
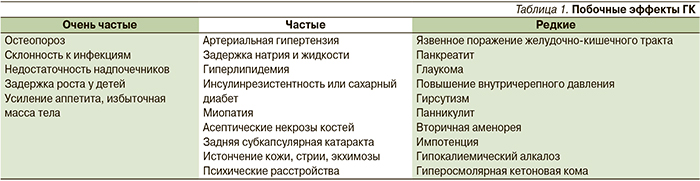
Выделяют рефрактерный вариант течения АНЦА-СВ, при котором отсутствует обратное развитие клинических проявлений заболевания или наблюдается увеличение клинической активности, несмотря на стандартную ИТ в течение 6 недель. В таких случаях эффективным может быть назначение РТМ или альтернативных методов лечения. В реальной клинической практике одним из распространенных заблуждений считается преувеличение возможностей ГК для контроля АНЦА-СВ.
Вместе с тем хорошо известно, что монотерапия ГК не оказывает существенного влияния на прогноз АНЦА-СВ. Так, выживаемость больных ГПА при монотерапии ГК не превышает трех лет [15]. Сроки назначения ГК не влияют на тяжесть последующего течения ГПА, в то время как позднее назначение ЦФ в два раза увеличивает риск генерализации ГПА и способствует более тяжелому течению с высокой клинической активностью и персистенции гранулематозного воспаления [16]. В крупном европейском исследовании недавно было продемонстрировано, что индекс повреждения АНЦА-СВ определяется продолжительностью примененияГК (наряду с возрастом, тяжестью дебюта и частотой рецидивов заболевания) [17].
Индукционная терапия что это
Общие принципы нейроанестезии ничем не отличаются от принципов анестезии в других областях хирургии. Анестезиолог отвечает за безопасность пациента, обеспечивает наиболее комфортные условия для осуществления хирургических манипуляций и старается способствовать наиболее быстрому восстановлению пациента после операции. Задача анестезиолога—достижение этих целей при проведении манипуляций, способных нанести травму нервной ткани. Этот раздел не предлагает готовых решений для каждой конкретной ситуации, но является общим руководством но «стандартному» нейроанестезиоло-гическому пособию.
Предоперационная подготовка к нейроанестезии
Предоперационная оценка. Предоперационная оценка описана в предыдущей статье. Целью предоперационного визита анестезиолога является знакомство с пациентом, разъяснение ему предстоящих манипуляций и получение информированного согласия, а также установление уровня сознания пациента перед операцией и понимания им предстоящей операции.
Как при любой обширной операции пациенты могут испытывать беспокойство относительно предстоящего вмешательства, анестезии, восстановления после операции, результатов биопсии или проб. Установление контакта с пациентом особенно важно при планировании операция при сохраненном сознании. Во время предоперационного визита необходимо также провести неврологическую оценку и оценку по шкале Глазго.
Согласие на анестезию. Законное согласие на анестезию может быть получено после разъяснения пациенту смысла предстоящей анестезиологической техники и предложения альтернатив, если это возможно. Пациенту необходимо предоставить информацию о возможном риске анестезии, об используемых анальгетиках и возможной необходимости гемотрансфузии (хотя при нейрохирургических и нейрорадиологических операциях она возникает сравнительно редко).
В Великобритании согласие на анестезию дастся в устной форме (это также приемлемо и важно как и официальное, письменное согласие), по обязательно отмечается в медицинских документах. При большинстве нейрохирургических операций не существует альтернативы общей анестезии. Но пациенту нужно описать все детали манипуляций, включая инвазивный мониторинг, постановку мочевого катетера, центральных катетеров (при необходимости), а также послеоперационное лечение в послеоперационной палате или палате интенсивной терапии если это планируется или может потребоваться.
Недееспособный пациент может быть не способен дать информированное согласие. В Великобритании согласие, полученное от родственников или близких, недействительно, до тех пор, пока им не предоставлена адвокатская доверенность или не выдана доверенность, позволяющая принимать решение о лечении, согласно Закону о дееспособности от 2005 г. Однако, опытные врачи полагают, что информировать родственников о планах лечения и дать им возможность задавать вопросы все-таки необходимо. В неотложных случаях суд всегда поддерживает решения принятые врачом в интересах пациента.
Премедикация. Премедикация в современной нейроанестезиологической практике редко назначается нейрохирургическим пациентам, а седативных препаратов в нейрохирургии избегают уже давно. Исключение делается только для тревожных пациентов с отсутствием значимого неврологического дефицита, т.е. ШКГ= 15. В день операции пациент получает стандартную медикаментозную терапию, за исключением ингибиторов АПФ и антагонистов ангиотепзина II. В некоторых случаях пациенты с риском аспирации получают Н2-блокаторы или блокаторы протонной помпы, хотя нет данных, подтверждающих достоверное снижение частоты или тяжести аспирационных пневмоний при их применении.
Пациенты, которым предстоит фиброоптическая интубация при бодрствовании,также получают средства, уменьшающие слюноотделение, например, гиосцин или гликопирролат.
Индукция анестезии
Мониторинг. Минимальный стандарт для интраоперациониого мониторинга описан на сайте ассоциации анестезиологов Великобритании и Ирландии.
Сигнальные устройства. Эти устройства полезны только при установке определенных значений. Например, они устанавливаются на инфузионные приборы, анестезиологические мониторы и аппараты ИВЛ, оповещая о достижении предельных значений.
Внутриартериальный мониторинг давления. При выполнении всех, кроме самых мелких нейрохирургических манипуляций, необходим инвазивпый мониторинг АД. Кроме того, что этот метод мониторинга позволяет четко контролировать артериальное давление и парциальное давление СО2 в конце выдоха (ЕТСО2), он также дает возможность следить за изменениями артериального давления между сердечными сокращениями, указывающими на повреждение нервов, например, при тракции нервов хирургом или сдавлении нервной ткани.
Периферическая стимуляция нервов. Электростимулятор периферических нервов используется для определения глубины нейромышечного блока и всегда должен использоваться при применении миорелаксангов. Двигательный ответ на электрическую стимуляцию мышц в TOF-режиме обычно оценивается субъективно. В нейроанестезиологии стимуляция периферических нервов используется в трех основных случаях:
• При интубации трахеи чтобы избежать увеличения ВЧД, вызванного неполным параличом голосовых связок.
• Интраоперационно, когда проводится инфузия миорелаксантов
• Перед экстубацией, чтобы начать введение таких антагонистов антидеполяризующих препаратов, как неостигмин, суммадекс.
Мониторинг температуры. Приборы, измеряющие температуру в ушном канале, мочевом пузыре, пищеводе, дают показания, согласующиеся с температурой в головном мозге. Ректальное изменение температуры хуже коррелирует с температурой мозга. Учитывая повреждающее воздействие гипертермии на головной мозг, измерение внутренней температуры тела пациента должно производиться во всех случаях, когда применяются приборы, способные вызвать нагревание.
Мониторинг ЦВА. Абсолютных показаний для мониторинга ЦВД в нейроапестезии нет. Его применяют обычно в следующих ситуациях:
• В случаях высокого риска воздушной эмболии (например, при операциях в положении сидя).
• При высоком риске массивного кровотечения во время операции
• При интракраниальном клипировании аневризм, когда излияние крови из сосуда может усилить гипоперфузию, которая развилась на фоне вазоспазма.
• У пациентов с сопутствующей сердечной недостаточностью для измерения ЦВД при периоперационпой инфузии жидкости.
• Для введения лекарственных средств, которые можно вводить только в центральную вену.
• При необходимости длительного венозного доступа, например, для антибиотикотерапии.
Мониторинг сердечного выброса. В последние 10 лет в Великобритании отказались от использования легочных артериальных флотационных катетеров, и предпочтение отдается менее инва-зивным методам оценки сердечного выброса. Для контроля объема внутривенных ипфузий используются мониторинг артериальных пульсовых волн и транспищеводная допплерография, которые могут с успехом применяться у пациентов с сопутствующими заболеваниями сердца. Однако их применение, скорее исключение, чем общепринятый метод мониторинга.
Прекардиальная допплерография. Это самый чувствительный метод исследования для диагностики венозной воздушной эмболии. Он позволяет выявить воздушную эмболию прежде, чем проявятся сердечно-легочные изменения, определяемые другими видами мониторинга (например, оценка парциального давления СО2 в конце выдоха (ЕТ-СО2), внутриаорталмтая баллонная контрпульсация, измерение объема церебрального кровотока).
Индукция анестезии обычно выполняется внутривенными препаратами. Хотя ингаляционные анестетики могут иногда использоваться в ситуациях с неконтактными или тревожными детьми, для взрослых пациентов абсолютные показания отсутствуют. Для индукции анестезии необходимо обеспечить венозный доступ диаметром минимум 16G.
• Наиболее часто используемыми внутривенными препаратами являются пропофол и тиопентал.
• Этомидата обычно избегают из-за его влияния на мозговой кровоток.
• Кетамин не используется в нейроанестезии из-за его влияния на внутричерепное давление и кровоток (хотя исследуются его нейропротективные свойства).
• При обширных нейрохирургических операциях во время индукции также используются опиоиды.
• Из опиоидов чаще всего применяется ремифентанил (хотя нет данных о более благоприятном исходе при его использовании чем у фентанила или алфентанила). Ремифентанил обычно вводится болюсно и затем продолжается иифузия или управляемая инфузия.
• Для малых интракраниальных операций и при спинальных операциях альтернативой является болюсное введение фентанила.
При необходимости поддержания достаточной глубины анестезии, пациенты с высоким внутричерепным давлением подвержены риску развития гипоперфузии при снижении артериального давления. В особенности пациенты с тяжелой травмой головного мозга (особенно те, у которых имеются и другие тяжелые травмы) очень чувствительны к препаратам для индукции, поэтому их нужно использовать с большой осторожностью и заранее иметь препараты для экстренной коррекции артериального давления.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Индукционная терапия что это
Во время тестирования одной или нескольких программ выбирается та, при тестировании которой показатели по шкале ВРТ от начального высокого измерительного уровня снижаются больше. При этом предпочтительнее на сеансе использование не более 2-х программ.
Индукционные программы применяются для направленной терапии и для формирования навыков (процессы запоминания и обучения). В процессе проведения направленной терапии сеансы назначаются 2 раза в неделю, а когда применяются программы для формирования определенных навыков, терапия может проводиться чаще.
Индукционная терапия
Выполняется с использованием устройств для магнитотерапии (УМТ) («пояс», «петля» и т.д.), которые накладывают на голову или проекционные участки пациента.
Подключение устройств для магнитотерапии осуществляется к комплексу «Имедис-Эксперт». При этом в данных приборах частотных спектр программ терапии устанавливается в автоматическом режиме.
Определение интенсивности влияния выполняется по методике ВРТ «Имедис-Тест». Показатель переносимой и эффективной для пациентов интенсивности: для детей – 5-20% от максимальной, для взрослых – 20-30%.
Во время дистанционной индукционной терапии (без накладывания на пациента индукторов) устанавливают максимальную интенсивность.
Также индукционную терапию могут проводить через соответствующие проекционные точки и зоны тела контактным электропунктурным воздействием.
Возможно использование индукционных программ на аппаратно-программном комплексе «Имедис-Экспорт» при проведении биорезонансной терапии. Также можно записывать нужную программу на носитель и назначать для перорального употребления 2-3 раза в неделю как поддерживающую терапию. Воздействие также проводятся, если по определенным причинам пациент не посещает сеансы лечения или при непереносимости влияния программы на голову (при появлении головной боли и др.).
Время исполнения в индукционных программах фиксировано, поэтому не следует раньше указанного времени завершать программу. Когда проводится индукционная терапия в рамках БРТ, то длительность сеанса биорезонансной терапии определяет время исполнения индукционной программы.
Возможно применение индукционной терапии, как самостоятельного метода, так и в комплексе с иными видами терапевтического воздействия.
При индукционной терапии применяются электромагнитные сигналы, которые совпадают со спектром электромагнитных волн, излучаемых человеческим мозгом.
При этом используется физиологический спектр частот:
Главное влияние индукционной терапии, прежде всего, осуществляется через влияние на структуры таламуса, тесно связанного с мезенхимой (системой рыхлой соединительной ткани). Мезенхима – это одна из основных управляющих систем, принимающих участие в обмене и проведении информации в организме.
Индукционная терапия – это основа для включения и наиболее оптимального применения механизмов саморегуляции организма человека. Благодаря способности организма запоминать полученные сведения эффект от сеансов данной терапии сохраняется долгое время.
Исследования позволили найти на поверхности человеческого тела «волновые точки», которые позволяют определять потребность применения при терапии электромагнитных колебаний, совпадающих с альфа-, бета-, тета- и дельта-ритмами головного мозга. Также такие «волновые точки» используются в качестве проекционных зон для влияния при индукционной терапии.
«Волновые точки» на поверхности человеческого тела локализованы так:
«Волновые точки», которые находятся в области лба, располагаются на линии неврастений китайской акупунктуры. Эта лини идет горизонтально по поверхности лба на 1 поперечник большого пальца выше точки Ин-Тан, которая находится между бровями. Вертикальные линии, где располагаются эти точки – альфа- и бета-ритма, идут вверх через центр зрачков до пересечения линией неврастении. Ближе к середине на поперечнике большого пальца расположены 2 другие волновые точки – дельта и тета.
На практике получается, что 1-а из данных 4-х точек очень чувствительна к надавливаниям. Данная точка указывает на ритм, который нужен для выполнения индукционной терапии.
Перед сеансом требуется повторно проводить тестирование «волновых точек», потому что периодически нужный ритм и функциональная картина состояния организма меняются.
Сначала волновые точки на лбу подвергают влиянию индукционной терапии. Они считаются «открывателями дверей», ведущие к восстановлению вышестоящих регуляционных центров и позволяющие восстанавливать нарушения частотных спектров.
При этом лечение длится 2 минуты, то есть время равняется времени, за которое частотный диапазон проходит соответствующий ритм.
Помимо этого, волновые точки линии неврастении значимы в тех случаях, если через них тестируют диапазон частот, подвергающийся во время терапевтического сеанса воздействию, к примеру, когда точка альфа-ритма на лбу наиболее болезненна при надавливании, то альфа-ритмом оказывается воздействие на прочие точки, при этом значение не имеет, о каких точках упоминается.
 Описание метода
Описание метода
В процессе экзогенной БРТ фиксированными частотами применяются определенные частоты, которые характерны для разных патологических состояний и обладают свойством их нивелирования, и частоты разных систем и органов. Они систематизированы как программы по нозологиям, органам и эффектам.
Частоты для удобства терапии и диагностики представляют, как номера программ. На пациента воздействуют электрическим током при помощи электродов их токопроводящей резины и металлических электродов или магнитным полем при помощи разных приборов для магнитной терапии («поясов», «петель», индукторов).
Важный момент при терапии заключается в правильном расположении индукторов и электродов. Индукторы размещаются на проекции органа или участке тела, который подлежит терапии. Можно также расположить маленькие электроды из токопроводящей резины или металлические электроды на коже над проблемным участком.
УМТ «пояс» позволят охватывать почти все органы, размещая его сзади, спереди или сбоку.
Общие правила:
Но из-за того, что системой меридианов в целом охватывается весь организм при применении обоих видов электродов, происходит лечение всего организма.
Чтобы расширить возможности терапии, можно одновременно подключать ножные и ручные электроды и индукторы.
Важно размещать стопы на ножных электродах, при этом они должны хорошо с ними контактировать. Дополнительно можно увлажнять низ стопы для улучшения электрического контакта. При электротерапии установка интенсивности осуществляется так, чтобы достичь индивидуального порога чувствительности человека в виде легкого покалывания под электродами.
При магнитной терапии интенсивность определяют тестированием по методике ВРТ «Имедис-Тест». Зачастую при терапии, переносимой и эффективной для пациентов является интенсивность 30 у.е. по шкале прибора.


 Описание метода
Описание метода