Ингибиторы интерлейкина что это
АНАКИНРА (ANAKINRA) ОПИСАНИЕ
Фармакологическое действие
Иммунодепрессант, ингибитор интерлейкина. Представляет собой рекомбинантную версию антагониста рецептора интерлейкина-1 (IL-1ra) человеческого, продуцированного штаммом E.coli с использованием технологии рекомбинантной ДНК.
Блокирует биологическую активность интелейкина-1α (ИЛ-1α) и интерлейкина-1β (ИЛ-1β) путем конкурентного ингибирования их связей с рецептором интерлейкина-1 типа I. Интерлейкин-1 (ИЛ-1) является ключевым провоспалительным цитокином, медиатором многих клеточных ответов, включая те, которые имеют важное значение при синовиальном воспалении.
Анакинра ингибирует реакции, индуцированные ИЛ-1 in vitro, в т.ч. индукцию оксида азота и простагландина Е 2 и/или синтез коллагеназы синовиальными клетками, фибробластами и хондроцитами.
Спонтанные мутации в гене CIAS1/NLRP3 былии обнаружены у большинства пациентов с криопирин-ассоциированными периодическими синдромами (CAPS). CIAS1/NLRP3 кодирует криопирин, компонент инфламмасомы. Активация инфламмасомы приводит к протеолитической матурации и секреции ИЛ-1β, который вызывает широкий спектр реакций, включая системное воспаление. У пациентов с CAPS, не получавших лечение, отмечают повышенный уровень С-реактивного белка (СРБ), амилоида А (САА) и ИЛ-6 в сыворотке крови по сравнению с нормальными уровнями. Было отмечено, что применение анакинры приводит к снижению уровней острофазных белков и уменьшению экспрессии ИЛ-6. Снижение уровней острофазных белков было зарегистрировано в течение первых недель лечения.
Фармакокинетика
После п/к введения анакинры в дозе 70 мг абсолютная биодоступность у здоровых добровольцев (n = 11) составляет 95%. Процесс абсорбции является фактором, ограничивающим скорость выведения анакинры из плазмы после п/к инъекции.
У пациентов на фоне лечения C max анакинры в плазме достигалась через 3-7 ч после п/к введения в клинически значимых дозах (от 1 до 2 мг/кг; n=18). Концентрация в плазме уменьшалась без очевидной фазы распределения, а T 1/2 составлял от 4 до 6 ч. У пациентов, получавших анакинру кумуляция не наблюдалась после ежедневного п/к введения в течение до 24 недель. Средние (SD) показатели клиренса и V d по результатам популяционного фармакокинетического анализа данных 35 пациентов составили 105 (27) мл/мин и 18.5 (11) л соответственно. Выводится почками. Клиренс анакинры возрастает с увеличением КК.
Показания активного вещества АНАКИНРА
Взрослым, подросткам и детям в возрасте от 8 месяцев и старше с массой тела от 10 кг и выше: лечение криопирин-ассоциированных периодических синдромов (CAPS), включая мультисистемное воспалительное заболевание неонатального возраста (NOMID)/хронический младенческий неврологический кожно-артикулярный синдром (CINCA); cиндром Макла-Уэллса (MWS); семейный холодовой аутовоспалительный синдром (FCAS).
Режим дозирования
Лечение проводит врач-специалист, имеющий опыт диагностики и лечения CAPS.
Для взрослых, подростков и детей в возрасте от 8 месяцев и старше с массой тела от 10 кг и выше начальная доза составляет 1-2 мг/кг/сут.
В течение 1-2 месяцев может потребоваться увеличение дозы с учетом терапевтического ответа и клинической ситуации.
Побочное действие
Противопоказания к применению
Повышенная чувствительность к анакинре или производным белка E.coli; нейтропения (АЧН 9 /л).
Указания в анамнезе на рецидивирующие инфекции или предрасполагающие факторы, которые могут привести к развитию инфекции; повышение активности печеночных ферментов в анамнезе или печеночную недостаточность тяжелой степени тяжести; почечную недостаточность средней степени тяжести (КК 30-59 мл/мин); бронхиальную астму; злокачественные новообразования; при необходимости применения вакцинации; пациенты пожилого возраста; у пациентов, принимающих одновременно варфарин или фенитоин.
Применение при беременности и кормлении грудью
Данные о применении анакинры при беременности ограничены. Результаты исследований на животных не указывают на наличие прямой или косвенной репродуктивной токсичности. В качестве меры предосторожности рекомендуется избегать применения анакинры во время беременности, а также женщинам детородного возраста, не использующих контрацепцию.
Неизвестно, выделяется ли анакинра/метаболиты с грудным молоком у человека. Риск для новорожденного ребенка/младенца не может быть исключен. Во время лечения анакинрой грудное вскармливание следует прекратить.
ВОЗ рекомендовала блокаторы рецепторов интерлейкина-6 для лечения COVID-19
Это первые препараты, признанные ВОЗ эффективными против коронавирусной инфекции, после положительных рекомендаций в сентябре 2020 года относительно кортикостероидов.
Метаанализ показал, что у тяжело или критически больных пациентов назначение этих препаратов снижает вероятность смерти на 13% по сравнению со стандартным уходом. Это означает, что на тысячу пациентов будет на 15 смертей меньше, а на каждую тысячу тяжелобольных пациентов — на целых 28 смертей меньше. Вероятность искусственной вентиляции легких среди тяжелых и критических пациентов снижается на 28% по сравнению со стандартным уходом. Это означает, что на 23 пациента из тысячи будет меньше нуждающихся в ИВЛ.
Исследователи клинических испытаний в 28 странах предоставили в ВОЗ данные, которые и были проанализированы. После чего была выпущена рекомендация по использованию блокаторов рецепторов интерлейкина-6 у тяжелых и критических пациентов с COVID-19.
Эти препараты дают надежду пациентам и семьям, страдающим от разрушительных последствий тяжелой и критической формы COVID-19. Однако блокаторы рецепторов IL-6 остаются недоступными как в физических объемах, так и по цене для большинства населения мира, — сказал глава ВОЗ д-р Тедрос Адханом Гебрейесус.
По его словам, «несправедливое распределение вакцин означает, что люди в странах с низким и средним уровнем дохода наиболее восприимчивы к тяжелым формам COVID-19. Таким образом, наибольшая потребность в этих препаратах существует в странах, которые в настоящее время имеют наименьший доступ к вакцинации», отметил Гебрейесус.
Для расширения доступа к этим препаратам, ВОЗ призывает производителей снизить цены и сделать поставки препаратов доступными для стран с низким и средним уровнем дохода, особенно там, где наблюдается рост заболеваемости COVID-19. Также Всемирная организация здравоохранения призвала компании согласиться на прозрачные, неэксклюзивные добровольные лицензионные соглашения с использованием C-TAP–платформы и Патентного пула лекарственных средств или отказаться от эксклюзивных прав на тоцилизумаб и сарилумаб.
Кроме того, ВОЗ объявила о заинтересованности в преквалификации производителей блокаторов рецепторов интерлейкина-6. Преквалификация инновационных и биоаналогичных продуктов направлена на расширение доступности лекарственных средств гарантированного качества, а также на расширение доступа за счет рыночной конкуренции и снижения цен для удовлетворения неотложных потребностей системы здравоохранения.
Буквально на прошлой неделе разрешение на экстренное применение препарата Actemra для лечения COVID-19 было выдано FDA
Второе поколение ингибиторов рецепторов интерлейкина 6 – новая веха в ревматологии. Общероссийский конгресс с международным участием «Проблемы аутоиммунитета и воспаления в ревматологии». Сателлитный симпозиум компании «Санофи»
Роль интерлейкина 6 в патогенезе иммуновоспалительных заболеваний
Сделав краткий экскурс в историю, выступающий отметил, что у истоков изучения ИЛ-6 стояли японские исследователи. В 1982–1988 гг. им удалось клонировать ИЛ-6 и продемонстрировать эффективность моноклонального антитела (мАТ) к рецептору ИЛ-6 при коллагеновом артрите. В 2000 г. появились работы о применении мАТ к рецептору ИЛ-6 при болезни Кастлемана.
В 2009–2011 гг. данные зарубежных и российских исследований послужили основанием для регистрации ингибитора к рецептору ИЛ-6, препарата тоцилизумаб, для лечения пациентов с РА в США, Европе и России. 2018 г. ознаменовался регистрацией препарата сарилумаб – ингибитора к рецептору ИЛ-6 второго поколения.
Установлено, что в отличие от ИЛ-11, ИЛ-27, ИЛ-31, цилиарного нейротрофического фактора, кардиотрофина 1, онкостатина М, которые оказывают достаточно таргетное влияние на определенные органы и системы, ИЛ-6 глобально воздействует на организм. Он способен активировать гены-мишени, участвующие в процессах дифференцировки, выживаемости, апоптоза и пролиферации клеток. Кроме того, он может действовать и как провоспалительный, и как противовоспалительный цитокин, стимулируя продукцию белков острой фазы и в то же время регулируя воспалительный ответ. Одной из отличительных особенностей данного цитокина, обеспечивающей широкий спектр его эффектов, также является специфическая система передачи сигнала – классический путь сигнализации, обусловленный связыванием ИЛ-6 с мембранным рецептором, и транс-сигнализация. В осуществлении альтернативного транс-сигнального пути участвуют растворимые рецепторы ИЛ-6. Связывание растворимого рецептора с ИЛ-6 приводит к образованию комплекса, который способен связываться с молекулой gp130 и индуцировать передачу сигнала в клетках, не экспрессирующих мембранный рецептор ИЛ-6. Оба пути сигнализации приводят к активации JAK (Janus Kinase) – тирозинкиназы, вызывающей рекрутирование и фосфорилирование латентных факторов транскрипции STAT-1 и STAT-3 (Signal Transducers Activators Transcription), регулирующих синтез широкого спектра провоспалительных медиаторов. Полагают, что транс-сигнализация ИЛ-6, связанная с экспрессией gр130, лежит в основе патогенных, провоспалительных эффектов ИЛ-6, в то время как классическая сигнализация в большей степени обеспечивает регуляцию гомеостаза, метаболизм липидов, целостность эпителиального барьера.
Согласно современным представлениям, патологическая активация и экспансия Th17-клеток играют ведущую роль в развитии РА. Интерлейкин 6 является одним из цитокинов, который участвует в активации Th17-клеток. Образование патогенных Th17-клеток может быть связано с ИЛ-6-зависимой транспрезентацией именно за счет взаимодействия дендритных клеток. Этот механизм требует дальнейшего изучения.
В глобальном плане патогенетическое значение ИЛ-6 очень велико. Интерлейкин 6, продуцируемый различными типами лимфоидных и нелимфоидных клеток, участвует в таких физиологических процессах, как миграция и активация Т- и В-лимфоцитов, моноцитов, остеокластов, повышение концентрации белков острой фазы воспаления.
Интерлейкин 6 стимулирует рост гепатоцитов и продукцию гепсидина, вносящего значимый вклад в развитие анемии хронического воспаления, заболевания, которое очень часто выявляется у больных РА.
Кроме того, ИЛ-6 влияет на адаптивный иммунитет. Как было отмечено ранее, данный цитокин способствует пролиферации и дифференцировке В-лимфоцитов в зрелые плазматические клетки, секретирующие аутоантитела и иммуноглобулины, которые оказывают воздействие на плазмобласты. ИЛ-6 способствует подавлению экспансии Т-регуляторных клеток. Патологические нарушения этих клеточных популяций рассматриваются в качестве ключевых в формировании хронического воспаления и аутоиммунитета при иммуновоспалительных ревматических заболеваниях.
«В настоящее время ингибиторы рецепторов ИЛ-6 заняли достойное место в лечении ревматоидного артрита. Следующий шаг – расширение показаний к их применению, в частности при ревматической полимиалгии, гигантоклеточном артериите», – пояснил академик Е.Л. Насонов, завершая выступление.
Мультиморбидный пациент в практике ревматолога
Системное действие ИЛ-6 сопряжено с регуляцией нейроэндокринной системы, регенерации клеток печени, поджелудочной железы, желудочно-кишечного тракта, сосудистого эндотелия, транспорта железа, метаболизма глюкозы, липидов и др.
Рассматриваемый цитокин отвечает и за другие системные эффекты. Установлено, что он оказывает многоуровневое влияние на головной мозг. Так, результатом действия ИЛ-6 могут быть лихорадка, нарушение настроения, боль, расстройство гипоталамо-гипофизарно-надпочечниковой (ГГН) системы.
Таким образом, за счет двойного сигнального пути воздействия роль ИЛ-6 в развитии суставных и системных проявлений РА значительно расширяется. Следствием этого может быть возникновение многих сопутствующих РА нарушений. Речь, в частности, идет о развитии сердечно-сосудистых заболеваний, диабета, усталости и депрессии.
В настоящее время для лечения РА одобрено два ингибитора рецепторов ИЛ-6: тоцилизумаб (гуманизированное мАТ) и сарилумаб (человеческое мАТ). Оба препарата связываются со вторым доменом рецептора ИЛ-6, но с различным аффинитетом к нему. Сарилумаб отличается более высокой аффинностью с рецептором ИЛ-6. Как следствие, более редкий режим применения – один раз в две недели по сравнению с еженедельным использованием тоцилизумаба в виде раствора для подкожного введения.
В исследованиях также оценивалась безопасность ингибиторов рецепторов ИЛ-6. Установлено, что такое лечение может сопровождаться повышением риска развития cерьезных и оппортунистических инфекций, перфорации органов желудочно-кишечного тракта, частоты случаев нейтропении, уровня печеночных трансаминаз, общего холестерина. Влияние терапии сарилумабом или тоцилизумабом на риск озлокачествления новообразований не изучено.
Резюмируя сказанное, профессор Э. Чой отметил:
Ингибиторы рецепторов интерлейкина 6 второго поколения: новые возможности в решении старых проблем
Ревматоидный артрит – иммуновоспалительное (аутоиммунное) ревматическое заболевание, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, приводящее к ранней инвалидизации и сокращению жизни пациентов. По словам директора НИИ ревматологии им. В.А. Насоновой, д.м.н., профессора Александра Михайловича ЛИЛЫ, не менее важными составляющими этого заболевания являются депрессия, анемический синдром, осложнения со стороны внутренних органов и систем (амилоидоз и др.).
Интерлейкин 6, высвобождаемый синовиальной тканью, обладает способностью к модификации функциональной активности жировой ткани, скелетных мышц, печени и эндотелия сосудов, стимулирует остеокластогенез, синтез белков острой фазы воспаления, продукцию гепсидина, играющего ключевую роль в развитии анемии хронического воспаления, а также приводит к дисрегуляции гипоталамо-гипофизарно-надпочечниковой системы. Клиническим проявлением этого является повышенная утомляемость и депрессия.
В исследование TARGET было включено 546 пациентов с РА, у которых наблюдались недостаточный клинический ответ на терапию ингибиторами фактора некроза опухоли альфа (ФНО-альфа) или их непереносимость. Пациенты получали сарилумаб в дозе 200 или 150 мг или плацебо каждые две недели в комбинации с традиционными болезнь-модифицирующими антиревматическими препаратами (метотрексат, лефлуномид и др.).
В исследовании MONARCH сравнивали эффективность и безопасность монотерапии препаратом сарилумаб 200 мг и монотерапии препаратом адалимумаб 40 мг у пациентов с активным РА, у которых был получен недостаточный ответ на фоне приема метотрексата или наблюдалась его непереносимость.
Каков портрет пациента с РА, которому может быть назначен ингибитор рецепторов ИЛ-6?
По словам профессора А.М. Лилы, это пациенты с очень высокой клинической и лабораторной активностью РА, риском жизнеугрожающих осложнений (амилоидоз), с неэффективностью базисных противовоспалительных препаратов, непереносимостью метотрексата, которым требуется монотерапия генно-инженерными биологическими препаратами, а также больные РА, у которых предшествующая биологическая терапия оказалась неэффективной.
Завершая выступление, докладчик подчеркнул, что сарилумаб уже включен в клинические рекомендации Швеции, Испании, Германии, Франции в качестве препарата для моно- и комбинированной терапии в случае неэффективности или непереносимости метотрексата или генно-инженерных биологических препаратов.
Создание препаратов, блокирующих эффекты ИЛ-6, имеет важное значение для совершенствования лечения ревматических болезней.
Сарилумаб (Кевзара), зарегистрированный для лечения РА, представляет собой человеческое моноклональное антитело к рецептору ИЛ-6, которое, связываясь с растворимыми и мембранными рецепторами ИЛ-6, ингибирует оба сигнальных пути ИЛ-6-зависимой клеточной активации.
В настоящее время сарилумаб (Кевзара) включен в клинические рекомендации Швеции, Испании, Германии и Франции в качестве препарата для моно- и комбинированной терапии в случае неэффективности или непереносимости метотрексата или других генно-инженерных биологических препаратов. Поэтому его можно рассматривать как перспективную опцию в клинической практике отечественных ревматологов.
Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование
Изучить эффективность более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в отделения реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки.
Материалы и методы
В ретроспективное когортное исследование включали пациентов с тяжелой COVID-19 пневмонией, госпитализированных в связи с ухудшением оксигенации в ОРИТ российских лечебных учреждений с 16 марта по 5 мая 2020 г. Всем пациентам проводилась стандартная терапия, а часть больных получили также тоцилизумаб внутривенно в дозе 400 мг. Госпитальную летальность от любых причин сравнивали между группами пациентов, которым вводили и не вводили тоцилизумаб, с помощью модели логистической регрессии с поправкой на возраст и пол.
В исследование были включены 328 пациентов (57,0% мужчин, медиана возраста 59 лет), 159 из которых получили по крайней мере одну инфузию тоцилизумаба. Препарат применяли у 83 (60,1%) из 137 больных, находившихся на оксигенотерапии или неинвазивной вентиляции легких (более раннее введение), и 76 (39,8%) из 191 интубированного пациента (позднее введение). Ни более раннее, ни позднее введение тоцилизумаба не привело к снижению риска смерти по сравнению с соответствующими контрольными группами больных, не получавших ингибитор интерлейкина-6 (скорректированные по возКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) расту и полу отношения шансов составили 2,370, 95% ДИ 0,969-5,798; р=0,059, и 0,996, 95% ДИ 0,539-1,839; р=0,989, соответственно).
Более раннее введение тоцилизумаба у неинтубированных пациентов с тяжелой COVID-19 пневмонией и поздняя инфузия препарата после начала ИВЛ не привели к снижению летальности от всех причин.
Число пациентов с COVID-19 во многих странах продолжает быстро увеличиваться, а общее число зарегистрированных в мире случаев инфекции в ноября 2020 г. превысило 60 млн. Хотя в большинстве случаев инфекция, вызванная SARSCoV-2, характеризуется благоприятным течением, у 5-10% госпитализированных больных с вирусной пневмонией развивается острый респираторный дистресс синдром (ОРДС), требующий респираторной поддержки в отделении реанимации и интенсивной терапии (ОРИТ) 1. В российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%, а основными предикторами неблагоприятного исхода были пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет 2 типа и коронарная болезнь сердца [4]. Летальность была достаточно низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно уве личивалась у больных, которых приходилось переводить на неинвазивную (36,8%) и особенно искусственную (76,5%) вентиляцию легких.
Причиной развития быстро прогрессирующего поражения легких при COVID-19 считают гипериммунный воспалительный ответ, сопровождающийся выбросом различных цитокинов [5]. Ранее синдром выделения цитокинов, или «цитокиновый шторм», был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [6]. Хотя «цитокиновый шторм» упоминается практически во всех статьях, посвященных COVID-19, общепринятые критерии его диагностики до сих пор отсутствуют. На практике синдром выброса цитокинов предполагают у пациентов с SARS-CoV-2 пневмонией 3-4 стадии (т.е. с поражением более 50% легочной ткани), сопровождающейся снижением SpO2≤93%, стойкой лихорадкой и повышением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, интерлейкина (ИЛ)-6, а также Dдимера. R. Caricchio и соавт. при анализе лабораторных показателей и клинических проявлений более чем у 500 пациентов c COVID-19 пришли к выводу, что существующие критерии синдрома выброса цитокинов, такие как HScore и др., не позволяют идентифицировать это осложнение SARS-CoV-2 инфекции, и предложили собственные критерии, отражающие (1) воспаление, (2) гибель клеток и повреждение ткани и (3) преренальные электролитные нарушения (табл. 1). Эти критерии позволяли с достаточной точностью предсказать более длительную госпитализацию и летальность [7]. Следует отметить, что к числу критериев синдрома выброса цитокинов авторы отнесли увеличение абсолютного количества нейтрофилов, которое, по-видимому, указывает на важную роль врожденного иммунитета в развитии «цитокинового шторма» при COVID-19 и во многих случаях не является признаком вторичной бактериальной инфекции, требующим назначения антибиотиков.
| Необходимые критерии (все) | Значения |
| Симптомы COVID-19 | + |
| ПЦР на SARS-CoV-2 | ± |
| Матовые стекла на КТ | + |
| Ферритин | >250 нг/мл |
| СРБ | >46 мг/л |
| И (один показатель из каждого кластера) | |
| Кластер I | |
| Альбумин | 11400 в мм 3 |
| Кластер II | |
| АЛТ | >60 Ед/л |
| АСТ | >87 Ед/л |
| D-димер | >4930 нг/мл |
| ЛДГ | >416 Ед/л |
| Тропонин I | >1,09 нг/мл |
| Кластер III | |
| Анионный разрыв | 106 ммоль/л |
| Калий | >4,9 ммоль/л |
| Азот мочевины/креатинин | >29 |
Предполагаемая роль синдрома выброса цитокинов в патогенезе тяжелого поражения легких и других органов при COVID-19 послужила основанием для изучения эффективности различных антицитокиновых средств, в том числе ингибиторов интерлейкина (ИЛ)-6 (тоцилизумаба, сарилумаба, олокизумаба), ИЛ-1 (канакинумаба, анакинры) и янус-киназ (тофацитиниба, барицитиниба). Хотя ни один из перечисленных препаратов официально не зарегистрирован для лечения СOVID-19, во многих странах ингибиторы ИЛ-6 применяют в клинической практике (off-label) у больных с наиболее тяжелым течением этого заболевания. Дополнительным доводом в пользу возможной эффективности ингибиторов ИЛ-6 при COVID-19 послужил и тот факт, что в 2017 г. тоцилизумаб был зарегистрирован для лечения угрожающего жизни синдрома высвобождения цитокинов, вызванного химерным антигенным рецептором (CAR) T-клеток у пациентов с гемобластозами [8].
Первые сообщения об успешном опыте применения тоцилизумаба у больных с тяжелым течением COVID19 были опубликованы китайскими исследователями уже вскоре после начала пандемии SARS-CoV-2 инфекции [14,15]. В последующем эффективность препарата была продемонстрирована в многочисленных наблюдательных исследованиях, которые проводились в разных странах, в том числе России [16,17]. По данным недавно опубликованного мета-анализа 10 исследований (n=1358), введение тоцилизумаба у пациентов с тяжелым течением COVID-19 ассоциировалось со снижением смертности по сравнению с таковой в контрольной группе больных, которым не вводили ингибитор ИЛ-6 [18]. В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 не была подтверждена в нескольких недавно завершенных рандомизированных контролируемых исследованиях [19].
Результаты терапии у пациентов с COVID-19 могут зависеть от сроков введения противовоспалительных препаратов [20]. Соответственно, целью ретроспективного когортного исследования было изучение эффективности более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в ОРИТ для респираторной поддержки.
Материал и методы
Дизайн исследования и критерии отбора пациентов. Ретро спективное когортное исследование проводилось в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых, созданном по приказу Минздрава РФ 16.03.2020 на базе Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). В центр по интернет поступают заявки на консультацию больных с тяжелым течением COVID-19, госпитализированных в ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В ретроспективное исследование включали пациентов, которым консультанты центра рекомендовали введение тоцилизумаба, учитывая наличие двусторонней пневмонии, поражающей более 50% легочной ткани (т.е. 3-4 стадии) и требующей респираторной поддержки, особенно при наличии повышенной концентрации СРБ. Окончательное решение о введении тоцилизумаба принимали лечащие врачи. Следует отметить, что консультанты центра не имели информации о доступности ингибиторов ИЛ-6 в соответствующих регионах Российской Федерации и лечебных учреждениях и, соответственно, не могли предсказать, будет ли пациенту введен тоцилизумаб или нет.
Пациенты, включенные в исследование, были распределены на две когорты с учетом уровня респираторной поддержки (оксигенотерапия/неинвазивная вентиляция легких или ИВЛ) на момент инфузии тоцилизумаба или получения заявки на консультацию, если ИЛ-6 в конечном итоге не вводился.
Все пациенты подписывали информированное согласие на применение тоцилизумаба и других «экспериментальных» препаратов для лечения COVID-19 в лечебном учреждении.
Процедуры и исходы. На основании полученных заявок на консультацию регистрировали демографические показатели и сопутствующие заболевания, диагностированные до развития COVID-19 (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт в анамнезе, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, ≥30,0 кг/м 2 – ожирение. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты.
Лечение COVID-19 проводилось в соответствии с временными рекомендациями Минздрава РФ. С марта по май 2020 г. в качестве противовирусных препаратов чаще всего применяли гидроксихлорохин/хлорохин, азитромицин и лопинавир/ритонавир, реже – интерферон-β, в то время как глюкокортикостероиды в начала вспышки инфекции не рекомендовались. Доза тоцилизумаба составляла 400 мг внутривенно. Допускалось введение второй дозы препарата по решению лечащих врачей.
Результаты
C 16 марта по 5 мая 2020 г. были получены заявки на консультацию 2066 пациентов с COVID-19, которые были госпитализированы в ОРИТ в связи с ухудшением оксигенации (рис. 1). В этой выборке 328 больным (57,0% мужчин, медиана возраста 59 лет) было рекомендовано введение тоцилизумаба. Относительно невысокая частота назначения ингибитора ИЛ-6 объяснялась тем, что в начале вспышки SARS-CoV-2 инфекции в Российской Федерации данных о возможной эффективности препарата было недостаточно.
159 из 328 пациентов получили по крайней мере одну дозу препарата 400 мг (у 21 была выполнена вторая инфузия в той же дозе с интервалом около 24 ч), в то время как оставшимся 169 больных не вводили ингибитор ИЛ-6, как правило, из-за отсутствия препарата в лечебном учреждении. Тоцилизумаб был введен 83 (60,1%) из 137 больных, которым проводились оксигенотерапия или неинвазивная вентиляция легких (НИВЛ) на момент инфузии или отправки заявки лечебным учреждением (более раннее введение тоцили зумаба), и 76 (39,8%) из 191 интубированного пациента (позднее введение тоцилизумаба) (рис. 1). В первой когорте тоцилизумаб был введен через 6 дней (интерквартильный размах 3-9) после госпитализации, а во второй – через 2 дня (интерквартильный размах 1-4) после начала ИВЛ.
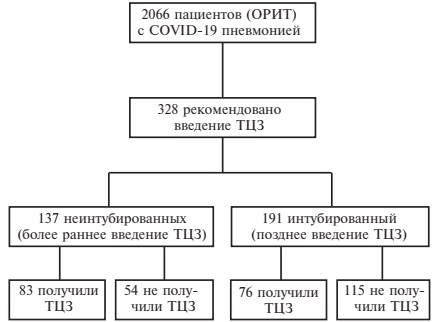
Группы больных, получивших или не получивших ингибитор ИЛ-6 на фоне оксигенотерапии или НИВЛ, были сопоставимы по возрасту и полу. У больных, которым вводили тоцилизумаб, частота некоторых заболеваний, которые могут ухудшить течение COVID-19, в том числе коронарной болезни сердца, инсульта в анамнезе и сахарного диабета 2 типа, была несколько выше, чем в группе сравнения, хотя разница не достигла статистической значимости (табл. 1). В когорте интубированных пациентов группы сравнения были сопоставимы как по демографическим показателям, так и по частоте всех сопутствующих заболеваний.
Во всей выборке летальность больных, получивших и не получивших тоцилизумаб, достоверно не отличалась (46,5% и 50,3%, соответственно, p=0,509). В обеих когортах основными причинами смерти были ОРДС (91,9% и 77,6%, соответственно), сердечно-сосудистые осложнения (5,4% и 12,9%) и тромбоэмболия легочной артерии (1,4% и 2,4%). Среди неинтубированных пациентов летальность была примерно в два раза ниже, чем среди больных, находившихся на ИВЛ (32,5% и 61,8%, соответственно; p
Обсуждение
В наблюдательном когортном исследовании у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ, внутривенное введение тоцилизумаба в фиксированной дозе 400 мг не сопровождалось снижением летальности. Тоцилизумаб не увеличивал выживаемость ни у больных, находившихся на оксигенотерапии или НИВЛ, ни у пациентов, которым ингибитор ИЛ-6 вводили после начала ИВЛ. Более того, введение тоцилизумаба у неинтубированных пациентов ассоциировалось с увеличением потребности в ИВЛ. Последний результат мог частично объясняться несколько более высокой частотой некоторых сопутствующих заболеваний, ухудшающих течение COVID-19, в группе тоцилизумаба. В то же время группы интубированных пациентов, получивших и не получивших тоцилизумаб, были сопоставимы по демографическим показателям и частоте сопутствующих заболеваний. Соответственно, различия между группами не могли объяснить негативные результаты исследования в этой выборке.
Наши данные контрастируют с результатами многочисленных наблюдательных исследований, которые показали, что введение тоцилизумаба может привести к снижению потребности в ИВЛ и летальности больных с тяжелым течением COVID-19 ассоциированной пневмонии 23. В ретроспективном исследовании, проводившемся в 13 американских больницах, эффективность тоцилизумаба изучали у 630 больных с COVID-19, госпитализированных в ОРИТ для респираторной поддержки [24]. Основную группу составили 210 пациентов, которым вводили тоцилизумаб в дозе 400 мг внутривенно, контрольную – 420 больных, не получавших ингибитор ИЛ-6 и подобранных по демографическим и клиническим показателям. Во всей когорте, как и в нашем исследовании, преобладали люди пожилого возраста (в основном мужчины), страдавшие различными сопутствующими заболеваниями. Около 45% больных получали глюкокортикостероиды. Летальность в целом составила 57%, в том числе 49% в группе тоцилизумаба и 61% в контрольной группе. По данным регрессионного анализа Кокса, введение тоцилизумаба ассоциировалось с достоверным снижением риска смерти (отношение рисков 0,64, 95% ДИ 0,47-0,87; p=0,0040). Сходная ассоциация была выявлена также в подгруппах больных, находившихся на ИВЛ, и пациентов с исходным уровнем СРБ ≥150 мг/л.
В другом крупном ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [25]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Больные группы тоцилизумаба были моложе пациентов группы сравнения (медианы 58 и 63 года, соответственно), чаще получали глюкокортикостероиды (18,7% и 12,6%) и чаще находились на ИВЛ (47,3% и 37,9%). Летальность во всей выборке составила 39,3%, в том числе 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92).
Статистически значимая ассоциация между введением тоцилизумаба (внутривенно в дозе 8 мг/кг в виде двух инфузий с интервалом 12 ч или подкожно в дозе 324 мг) и снижением риска перевода на ИВЛ или смерти (скорректированное отношение рисков 0,61, 95% ДИ 0,40–0,92; p=0,020) была выявлена и в итальянском исследовании у 544 больных с тяжелой COVID-19 ассоциированной пневмонией, 179 из которых получили ингибитор ИЛ-6 [21]. В этом исследовании доля больных, нуждавшихся в ИВЛ (18% и 16% в группах тоцилизумаба и сравнения, соответственно) и летальность (7% и 20%) были значительно ниже, чем в нашем исследовании, в том числе у пациентов, получивших более раннюю инфузию тоцилизумаба, и в описанных выше исследованиях. Таким образом, данные итальянских авторов позволяют судить об эффективности тоцилизумаба у пациентов с менее тяжелым течением COVID-19.
Заключение
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19 пневмонией, нуждавшихся в респираторной поддержке в ОРИТ, мы не выявили снижения летальности как при более раннем (до интубации), так и позднем (после начала ИВЛ) внутривенном введении тоцилизумаба в дозе 400 мг по сравнению с контрольными группами больных, получавших только стандартную терапию. Хотя полученные данные не позволяют отвергнуть эффективность тоцилизумаба, они согласуются с результатами нескольких рандомизированных клинических исследований, в которых изучался ингибитор ИЛ-6. В настоящее время продолжаются еще несколько рандомизированных контролируемых исследований, в частности RECOVERY, которые позволят оценить эффективность тоцилизумаба у пациентов с COVID-19 и возможные показания к его применению. Если по мнению врача больной с тяжелой COVID-19 пневмонией нуждается в противовоспалительной терапии, то лечение целесообразно начинать с дексаметазона, в то время как введение тоцилизумаба может обсуждаться при неэффективности глюкокортикостероидов.