Ионная связь между чем и чем
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
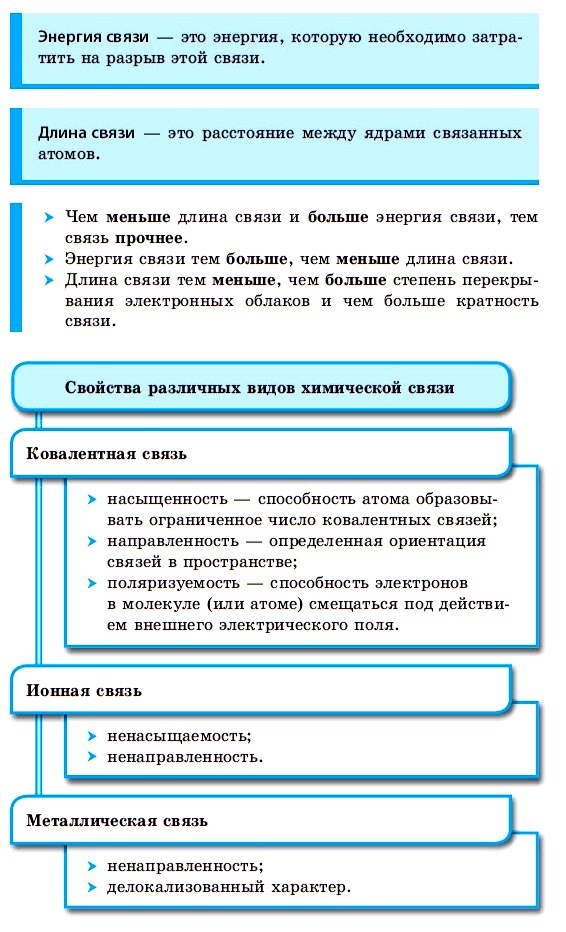
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
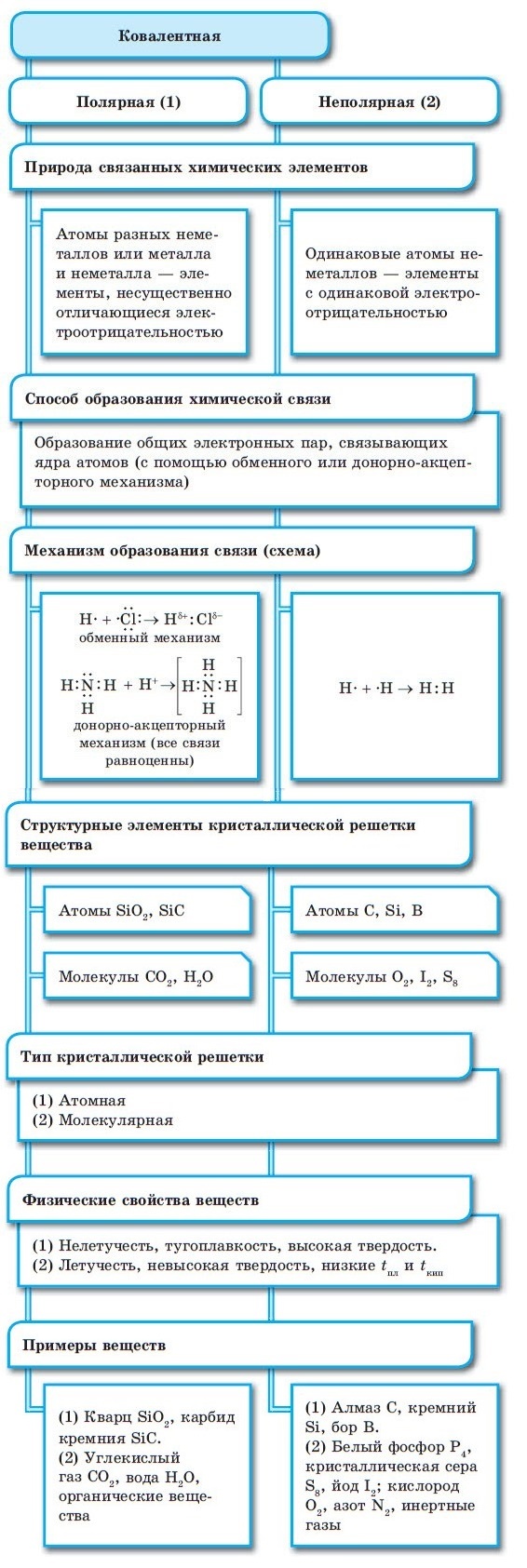
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
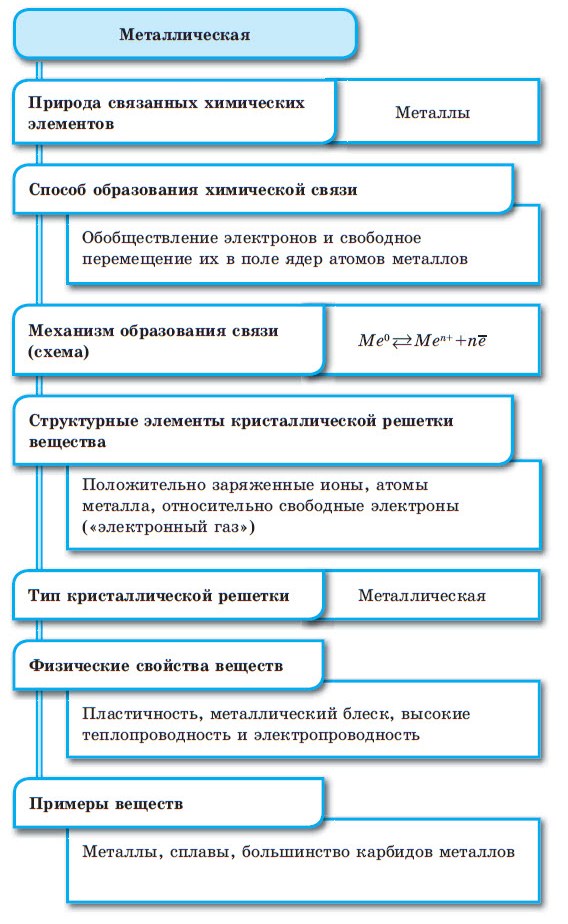
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Ионная связь между чем и чем
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».