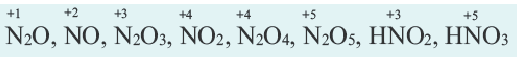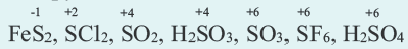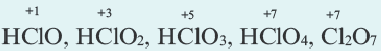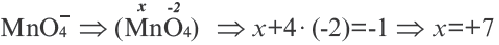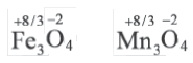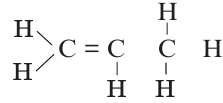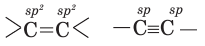Ионная связь между чем
Ионная связь.
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 



Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 



По значению заряда ионы подразделяются на:
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
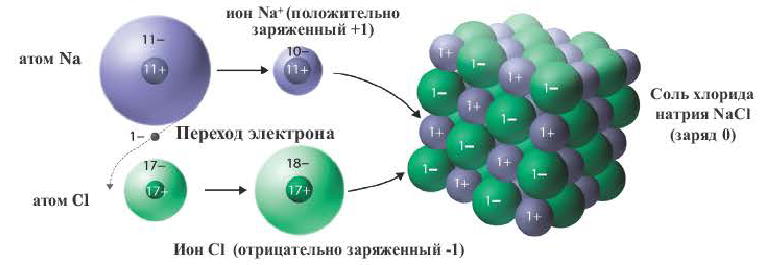
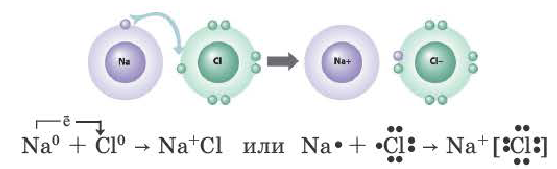
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.
Для ионной связи характерно:
Пример. Схема образования ионного соединения:



Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
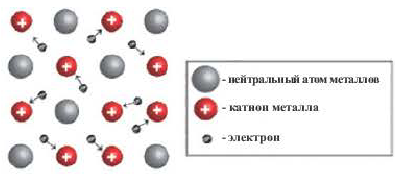
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
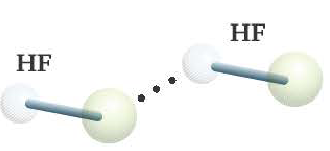
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
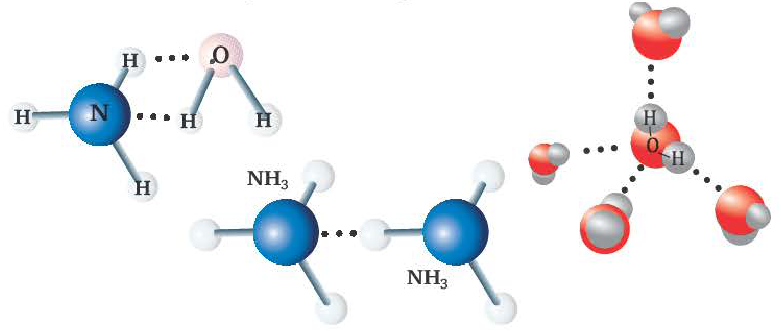
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание:
Ионная связь:
Ионы образуются в результате отдачи или присоединения электронов атомами. Атомы, отдающие свои валентные электроны, превращаются в положительно заряженные ионы, а атомы, принимающие эти электроны в отрицательно заряженные ионы. Ионы это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами. Катионы в основном образуются от металлов и ионов аммония. Неметаллы в одиночку не образуют катионов (кроме H + ). Из курса физики известно, что положительно и отрицательно заряженные ионы взаимно притягивают друг друга. Следовательно, между положительно и отрицательно заряженными ионами существуют взаимные силы притяжения.
Химическая связь, образованная между ионами в результате действия электростатических сил притяжения, называется ионной связью. Полученное при этом соединение носит название ионного или гетерополярного соединения. Ионная связь образуется между металлами и неметаллами, т.е. между атомами элементов с резко отличающимися электроотрицательностями. Самая сильная ионная связь возникает в солях кислородсодержащих и бескислородных кислот (например, между металлами (щелочные и щелочноземельные металлы) и галогенами), в основаниях. Следовательно, молекула хлорида натрия состоит из ионов натрия (Na + ) и хлорид-ионов (Cl).
Свойства ионной связи
Ионной связи присущ целый ряд характерных свойств:
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH 
В соединениях с ионной связью число ионных связей равно произведению числа катионов на валентность.
В солях, в составе которых содержится кислород и ион аммония, в том числе и в основаниях, имеются как ионная, так и полярная ковалентная связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению валентности центрального элемента на его индекс. В кислых же солях число полярных ковалентных связей равно произведению суммы валентности центрального элемента и количества H на индекс кислотного остатка.
| Вещества | Число ионных связей в молекуле | Число полярных ковалентных связей в молекуле |
 | 3 | 3-4=12 |
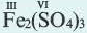 | 2- 3=6 | 3-6=18 |
| Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью. |
Металлическая связь
Химическая связь, образованная между положительно заряженными ионами металлов и относительно свободными электронами кристаллических решеток, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Огносительно свободные электроны, оторвавшись от атомов, движутся между положительными ионами металлов, образуя металлическую связь, те. электроны словно цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь обладает целым рядом характерных свойств:
Водородная связь
Химическая связь, образованная между атомом водорода одной молекулы и атомом более сильного электроотрицательного элемента (O,N,F) другой или же аналогичной молекулы, называется водородной связью.
Характерные свойства водородной связи:
Вода, HF, спирты, водные растворы спиртов образуют межмолекулярные водородные связи. Для белков и многих органических соединений характерна внутримолекулярная водородная связь.
Радиус атома водорода очень маленький и при перемещении или отдаче своего единственного электрона другому атому он становится положительно заряженным. За счет этого водород одной молекулы взаимодействует с находящимися в составе других молекул (HF, Н2О) атомами электроотрицательных элементов с частично отрицательным зарядом.
Образование водородной связи
За счет водородной связи действительная формула воды имеет следующий вид: (H2O)n
При переходе того или иного вещества, образующего водородную связь, из жидкого состояния в газообразное состояние, водородная связь разрывается, а в обратном процессе вновь восстанавливается.
Вода, находясь в твердом (лед) и жидком состояниях, образует водородную связь. При переходе же в газообразное состояние водородная связь разрывается.
Одна из причин того, что фтористая кислота является слабой кислотой, заключается в ассоциации друг с другом молекул HF посредством водородной связи. Вот почему действительная формула фтороводородной кислоты следующая: (HF)n.
Типы кристаллических решеток
Кристаллические и аморфные вещества:
При механическом раздроблении кусочка хлорида натрия или другого твердого вещества образуются кристаллы определенной формы. Такие вещества называют кристаллическими веществами. Однако существуют и такие твердые вещества (стекло, куски смолы), которые при раздроблении под действием удара образуют осколки неопределенной формы. Такие вещества называют аморфными, т.е. бесформенными веществами.
Частицы (атомы, ионы и т.д.) твердых веществ, располагаясь в строгом порядке, образуют различного типа кристаллические решетки. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В графите атомы углерода на одной плоскости расположены близко друг к другу, а на разных плоскостях на отдаленном расстоянии друг от друга. Расположение атомов углерода, находящихся на разных плоскостях, в отдалении друг от друга приводит к расслоению графита на чешуйки. Свидетельством тому являются оставленные карандашом следы на бумаге (чешуйки графита).
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллической решетки. 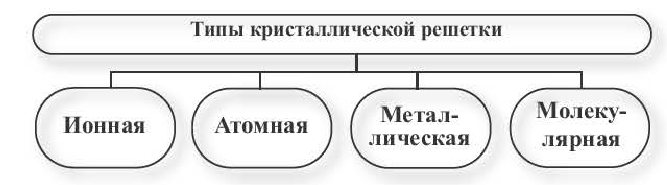
В отличие от кристаллических веществ, в аморфных веществах частицы расположены не в такой закономерности, а неупорядоченно.
 | Профессор Худу Мамедов (1927 1988) являлся член корреспондентом НАНА, доктором геолого минералогических наук, почетным членом Коралевской Академии Великобритании. Его основные научные труды от носятся к области ристаллохимии. Исследовал молекулярное и кристаллическое строения более 50 ти органических комплексных соединений слигандами. |
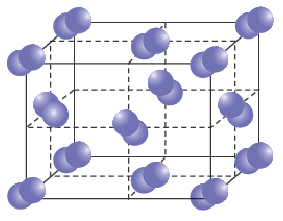
Ионная кристаллическая решетка. Кристаллические решетки, в узлах которых содержатся соединенные ионными связями положительно и отрицательно заряженные ионы, называются ионными кристаллическими решетками. Ионные кристаллические решетки характерны для оксидов металлов, оснований и солей: NaCl, KCl, NaBr, KBr, N2CO3, Na2SO4, Fe2O3, Ca(OH)2 и др.
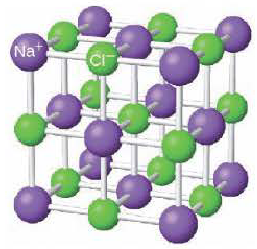
Строение кристаллической решетки поваренной соли
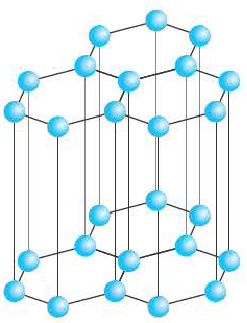
Строение кристаллической решетки графита
Из-за сильного притяжения между ионами веществ с ионной кристаллической решеткой, эти вещества отличаются относительной тугоплавкостью, малой летучестью и определенной твёрдостью.
Атомные кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы, связанные друг с другом ковалентной связью, называются атомными кристаллическими решетками.
В атомных кристаллических решетках атомы, как и ионы, располагаются в пространстве в различных положениях, образуя в результате различной формы кристаллы. Например, в узлах кристаллической решетки как алмаза, так и графита содержатся атомы углерода. Однако вследствие их различного расположения, кристаллы алмаза обладают формой тетраэдра, а кристаллы графита слоистой формой.
| Аллотропические видоизменения углерода | Состояния гибридизации углерода | Xимический cocтав | Тип кристаллической решетки | Cтроение кристаллической решетки |
| Алмаз | sp 3 | Одинаковый (C) | Атомный | тетраэдрическое |
| Графит | sp 2 | слоистое | ||
| Карбин | sp | линейное |
Хотя тип кристаллической решетки аллотропических видоизменений углерода и одинаковый, однако у них различное строение. Примерами веществ, образующих атомную кристаллическую решетку, являются В, С, Si, SiC (карборунд), SiO2, красный и черный фосфор.
Так как в атомных кристаллических решетках этих веществ ковалентные связи между атомами обладают прочностью, для них характерны большая твердость и высокая температура плавления.
| Хотя SiC и SiOi обладают атомной кристаллической решеткой, связь между их атомами образована посредством полярной ковалентной связи. |
Молекулярная кристаллическая решетка
Кристаллические решетки, в узлах которых содержатся полярные и неполярные молекулы, связанные между собой межмолекулярными силами, называются молекулярными кристаллическими решетками. Молекулярные вещества образуют кристаллические решетки молекулярного типа.
Строение кристаллической решетки йода
Вещества, находящиеся при комнатной температуре в твердом состоянии и образованные только посредством ковалентной связи, в обычных условиях имеют молекулярную кристаллическую решетку, а газообразные, жидкие вещества образуют молекулярную кристаллическую решетку лишь в определенных условиях. В качестве примера веществ с молекулярными кристаллическими решетками в обычных условиях можно привести белый фосфор (Р4), кристаллическую серу (S8), Н3РО4, иод (I2), НРО3, Р2О5, глюкозу (C6H12O6), сахарозу (C12H22O11) и др.
В молекулярных кристаллических решетках веществ с неполярными ковалентными связями (H2, N2, О2, О3, F2, Сl2, Вr2, l2, Р4, S8) связи между молекулами создаются лишь слабыми межмолекулярными силами. В веществах с неполярной ковалентной связью межмолекулярное притяжение слабое. Вследствие этого они обладают очень низкой температурой плавления.
В кристаллических решетках веществ с полярной ковалентной связью (кроме SiC и SiO2) действуют межмолекулярные и электростатические силы притяжения. Значит, только вещества, образованные посредством полярной ковалентной и неполярной ковалентной связи, создают молекулярную кристаллическую решетку. Например, H2O, HCl, HBr, HI, CO2, HNO3, H2SO4, большинство органических веществ и др.
Металлические кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы или ионы металлов, связанные общими электронами, называются металлическими кристаллическими решетками. Большинство металлов (Na, Ca, Fe, Al, Cu и др.), а также расплавов, образуют металлические кристаллические решетки.
Многие свойства металлов электрическая проводимость, теплопроводность, ковкость и др. объясняются свободным движением электронов, образующих металлическую связь.
Некоторые физические свойства веществ зависят от типов кристаллических решеток. В этой связи существует такая закономерность: при известном строении веществ можно заранее предсказать их свойства, и наоборот, если известны свойства веществ, то можно определить их строение.
Вещества, обладающие молекулярной кристаллической решеткой, называются молекулярными (состоят из молекул), а обладающие ионной, атомной и металлической кристаллическими решетками немолекулярными (состоят из атомов или ионов) веществами.
Валентность
Валентность элементов относится к основным понятиям химии.
Валентность — это свойство атомов элементов присоединять или замещать определенное число атомов других элементов. Понятие валентности было введено в науку в 1852 году Эдуардом Франклендом.
Данное определение валентности носит несколько формальный характер, так как не дает представления о природе, свойствах вещества. C развитием учения о химической связи содержание понятия «валентность» в настоящее время обычно выражается так:
Валентность это свойство атомов элементов создавать определенное число ковалентных химических связей.
Валентность определяется числам ковалентных связей, посредством которых в соединениях один атом связывается с другими атомами.
Согласно представлениям о ковалентной связи, независимо от способа образования общих электронных пар, валентность определяется числом общих электронных пар, связывающих атомы в молекуле.
Как вам известно, числовое значение валентности связано с положением элемента в периодической системе химических элементов Д.И.Менделеева. Высшая валентность элемента по числовому значению равна номеру его группы в периодической системе. Некоторые элементы не подчиняются этой закономерности (например, N, О, F). Это связано с тем, что из-за отсутствия в их атомах незаполненных орбиталей, они не могут возбуждаться. Максимальная валентность в соответствующем соединении того или иного элемента определяется числом орбиталей, участвующих в образовании связей в его атоме.
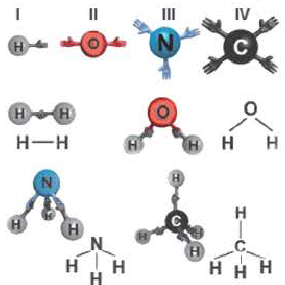
Образование связи в соответствии с валентностью элемента
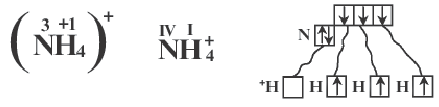
В образовании иона аммония (NH 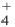
Степень окисления
Степень окисления это условный заряд, который приходится на долю каждого атома в молекуле. Степень окисления может принимать отрицательные, нулевые, положительные и дробные значения. Значение степени окисления определяется числом электронов, отданных атому другого элемента или полученных от атома данного элемента.
| Элементы | Степень окисления, проявляемая в соединениях |
| Li, Na, К, Rb, Cs | + 1 |
| Be, Mg, Ca, Sr, Ba, Ra, Zn | +2 |
| Al | +3 |
| F | -1 |
Для определения степени окисления каждого элемента в соединениях используются нижеприведенные данные. В таблице даны элементы с постоянной степенью окисления в соединениях.
Степень окисления у других элементов бывает переменной.
Степень окисления водорода в его соединениях с металлами и кремнием равна 1 (например: ВН3, SiH4, NaH, CaH2 и др.), а во всех других соединениях+1.
Вот почему в периодической таблице водород записан как в подгруппе 1А, так и в подгруппе VIIA.
Степень окисления кислорода в пероксидах равна 1 (H2O2, Na2O2, CaO2 и др), в супероксидах 1 /2 (КО2), фтористых соединениях (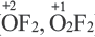
Из галогенов хлор, бром и йод только в соединениях с металлами проявляют степень окисления 1, а в кислородсодержащих соединениях +l÷+-7.
Степень окисления элементов в простых веществах всегда равна нулю.
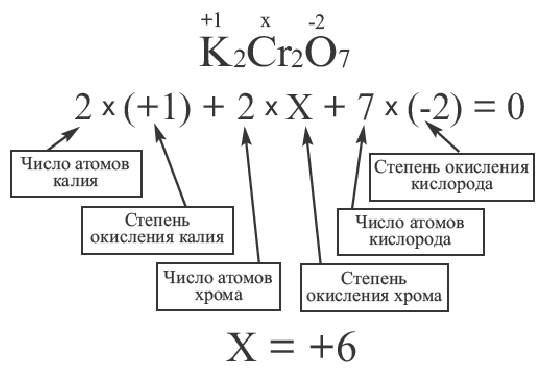
Алгебраическая сумма значений степени окисления элементов в сложных веществах всегда равна нулю. Следуя этому правилу, можно легко вычислить степень окисления любого химического элемента, если известны степень окисления других химических элементов в соединении. Неизвестная степень окисления элемента всегда принимается за х.
В сложных ионах алгебраическая сумма степеней окисления элементов равна заряду иона. Неизвестная степень окисления элемента в сложном ионе принимается за х. Записав в скобках формулу иона, за скобками (справа сверху) отмечают его заряд.
У большинства элементов самая высокая степень окисления соответствует номеру группы, в которой данный элемент размещается (кроме F, О, Fe, Си, Ag, Au). Самая низкая степень окисления любого неметалла (кроме H и В) определяется путем вычитания числа 8 от номера группы, где он расположен.
| Группа | VI | VII | V | IV |
| Элемент | S | Cl | N | C |
| Самая низкая степень окисления | 6 8=-2 | 7 8=-1 | 5 8=-3 | 4 8=-4 |
Металлы никогда не проявляют отрицательной степени окисления. Самая низкая степень окисления у них равна нулю.
В большинстве случаев степень окисления элемента по своему численному значению совпадает с его валентностью. Но такое бывает не всегда. Например: углерод трехвалентный только в угарном газе (СО), во всех остальных соединениях он четырехвалентный. Кислород трехвалентный только в ионе гидроксония (Н3О + ) и угарном газе, во всех остальных соединениях он двухвалентный. В таких соединениях, как Аl4С3, CO2, CCl4, CF4, CS2, численные значения степени окисления и валентности у углерода совпадают.
При определении степени окисления посредством общего баланса отданных и полученных электронов ее среднее значение иногда может быть выражено дробным числом.
При разных степенях окисления атомов одного элемента в соединении степени окисления выражаются дробными числами. Среднее значение вычисляется способом электронного баланса.
Значение степени окисления, в отличие от заряда иона, проставляется над химическим знаком элемента (вначале ставится знак заряда, а затем число).
| Степень окисления | +2 Fe | +3 Fe | -2 S | +6 S |
| Заряд иона | Fe 2+ | Fe 3+ | S 2- | S 6+ |
Сколько процентов от числа валентных электронов азота (7N 2s 2 2p 3 ) создают связь по механизму обмена?
Решение: В атоме азота из 5-ти валентных электронов 3 одиночные.
Значит, (3/5) ∙ 100%=60% участвуют в механизме обмена.
Каждая электронная пара, образующая химическую связь, обозначается по одной валентной линии, формулы молекул изображаются графически.
Определите отношения между а, b, с.
| Соли | Число донорно-акцепторных связен |
| (NH4)2SO4 | а |
| NH4Cl | b |
| (NH4)3PO4 | c |
Решение: Число донорноакцепторных связей в солях аммония равно числу ионов аммония.
Тогда: a=2; b=l; с=3
Ответ: b

Определите количество а) полярных ковалентных и b) неполярных ковалентных связей в молекуле соединения:
Решение: Полярная ковалентная связь образуется между атомами двух разных неметаллов. В таком случае, в данном соединении N(пол.ков.связь) N(C Н)связь N(H) 6
А неполярная ковалентная связь образуется между атомами одного вида (в представленном соединении это линии между атомами углерода). Тогда N(κeпoл.ков.связь.) = 3
Ответ: а=6; b=3
Определите общее число орбиталей, участвующих в образовании химических связей в соединении Н3С CH2 СН3.
Решение: Кроме угарного газа (СО), во всех соединениях углерода все 4 орбитали внешнего электронного слоя участвуют в образовании связи. Поскольку атом H имеет 1 орбиталь, его орбиталь тоже участвует в образовании связи. В таком случае, общее число орбиталей, участвующих в образовании связи: N(оpб.)o6щ. N(C) • 4 + N(H) 3•4 + 8 20
Определите в данном соединении гибридное состояние углерода. 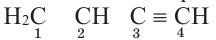
Решение:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.