Изотермической амплификации что это
Техника
Определение в пробирке амплификации ДНК LAMP возможно с использованием нагруженного марганцем кальцеина, который начинает флуоресцировать при комплексообразовании марганца с пирофосфатом во время синтеза ДНК in vitro.
Другой метод визуального обнаружения LAMP-ампликонов невооруженным глазом был основан на их способности гибридизоваться с комплементарной ss-ДНК, связанной с золотом, и, таким образом, предотвращать нормальное изменение цвета с красного на пурпурно-синий, которое в противном случае могло бы произойти во время индуцированной соли агрегации золотые частицы. Таким образом, метод LAMP в сочетании с обнаружением ампликона с помощью AuNP может иметь преимущества по сравнению с другими методами с точки зрения сокращения времени анализа, подтверждения ампликона гибридизацией и использования более простого оборудования (например, отсутствие необходимости в термоциклере, оборудовании для электрофореза или УФ-трансиллюминаторе. ).
Использование и преимущества
LAMP также используется для идентификации жидкостей организма. Благодаря своей простоте исследователи могут протестировать один или несколько образцов, не прикладывая усилий, что помогает сократить время, необходимое для получения результатов. Исследователи также смогли добавить факторы, чтобы сделать идентификацию еще более простой, включая краситель-индикатор металла и феноловый красный, чтобы иметь возможность использовать смартфон и невооруженный глаз соответственно для анализа результатов.
Ограничения
LAMP менее универсален, чем ПЦР, наиболее хорошо зарекомендовавший себя метод амплификации нуклеиновых кислот. LAMP полезен в первую очередь как метод диагностики или обнаружения, но не подходит для клонирования или многих других приложений молекулярной биологии, поддерживаемых ПЦР. Поскольку LAMP использует 4 (или 6) праймеров, нацеленных на 6 (или 8) областей в пределах довольно небольшого сегмента генома, и поскольку дизайн праймеров подвержен многочисленным ограничениям, сложно разработать наборы праймеров для LAMP «на глаз». Бесплатные пакеты программного обеспечения с открытым исходным кодом или коммерческие пакеты обычно используются для помощи в разработке праймера LAMP, хотя ограничения дизайна праймера означают, что свобода выбора целевого сайта меньше, чем при использовании ПЦР.
В диагностическом приложении это должно быть сбалансировано с необходимостью выбора подходящей мишени (например, консервативного сайта в очень вариабельном вирусном геноме или мишени, специфичной для определенного штамма патогена). Для охвата различных вариантных штаммов одного и того же вида может потребоваться несколько вырожденных последовательностей. Следствием наличия такого набора праймеров может быть неспецифическая амплификация на поздней стадии амплификации.
Подходы к мультиплексированию для LAMP менее развиты, чем для ПЦР. Большее количество праймеров на мишень в LAMP увеличивает вероятность взаимодействий праймер-праймер для мультиплексированных наборов мишеней. Продукт LAMP представляет собой серию конкатемеров целевой области, приводящую к появлению характерной «лестницы» или полосатого рисунка на геле, а не одной полосы, как в случае ПЦР. Хотя это не проблема при обнаружении одиночных мишеней с помощью LAMP, «традиционные» (конечные) приложения мультиплексной ПЦР, в которых идентичность цели подтверждается размером полосы на геле, невозможны с LAMP. Мультиплексирование в LAMP было достигнуто путем выбора целевой области с сайтом рестрикции и переваривания перед запуском в гель, так что каждый продукт дает определенный размер фрагмента, хотя этот подход усложняет экспериментальный план и протокол.
Зеленый краситель SYBR может быть добавлен для просмотра LAMP в режиме реального времени. Однако в поздней амплификации амплификация димера праймера может способствовать ложноположительному сигналу. Использование неорганической пирофосфатазы в реакционной смеси SYBR позволяет использовать анализ расплава для определения правильной амплификации.
Хотя были предложены различные стратегии смягчения ложноположительных результатов в анализах, основанных на этом методе, неспецифическая амплификация из-за различных факторов, включая отсутствие механизмов стробирования температуры, является одним из основных ограничений петлевой изотермической амплификации.
Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой
Многие молекулярно-биологические операции напоминают поиск иголки в стоге сена
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Современные биологи в большинстве своём работают с генами. Ген — участок молекулы ДНК, кодирующий белок или РНК. Изучая активность гена и изменения в его работе, чаще всего пользуются методом полимеразной цепной реакции (ПЦР) и различными её модификациями. Метод позволяет найти ген и сделать множество его копий. Однако прибор и реактивы для проведения ПЦР дóроги, а время, необходимое на реакцию, составляет около двух часов. В данной статье описывается аналог полимеразной реакции — LAMP (loop-mediated isothermal amplification), позволяющий провести то же исследование в 10 раз быстрее, дешевле и, что крайне важно, более специфично. Также рассмотрены перспективы применения LAMP в фундаментальных и клинических исследованиях.
Конкурс «био/мол/текст»-2014

Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Как это здорово звучит: я занимаюсь генетикой, работаю с ДНК, РНК, получаю ГМО. Как это странно выглядит: я добавляю прозрачные растворы к прозрачным растворам, ставлю в сложный прибор, который показывает, сколько у меня ДНК, или из каких нуклеотидов она состоит. Конечно, целая молекула ДНК, особенно в связи с белками, поддерживающими её структуру (aka хромосома), ещё видна в микроскоп, но представьте себе один ген, один небольшой участок хромосомы. Чтобы работать с одним геном, его нужно сначала найти. Представьте, найти определённый участок, состоящий из 10000 букв (нуклеотидов) среди 3 миллиардов таких же букв! Разница в пять порядков. Это действительно сравнимо с поиском иголки в стоге сена.
Первым механизм такого поиска в 1983 году запатентовал Кэри Мюллис (Kary Mullis) [1]. Он предложил наработать множество копий исследуемой ДНК. Чтобы понять метод Мюллиса, широко известный как полимеразная цепная реакция (ПЦР) [11] и используемый уже более 30 лет практически в каждой лаборатории мира, обратимся к истокам. Как происходит увеличение количества ДНК в живом организме в естественных условиях.
Репликация ДНК
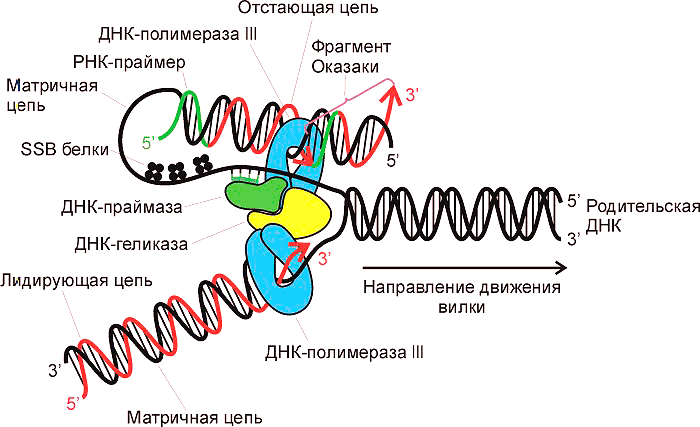
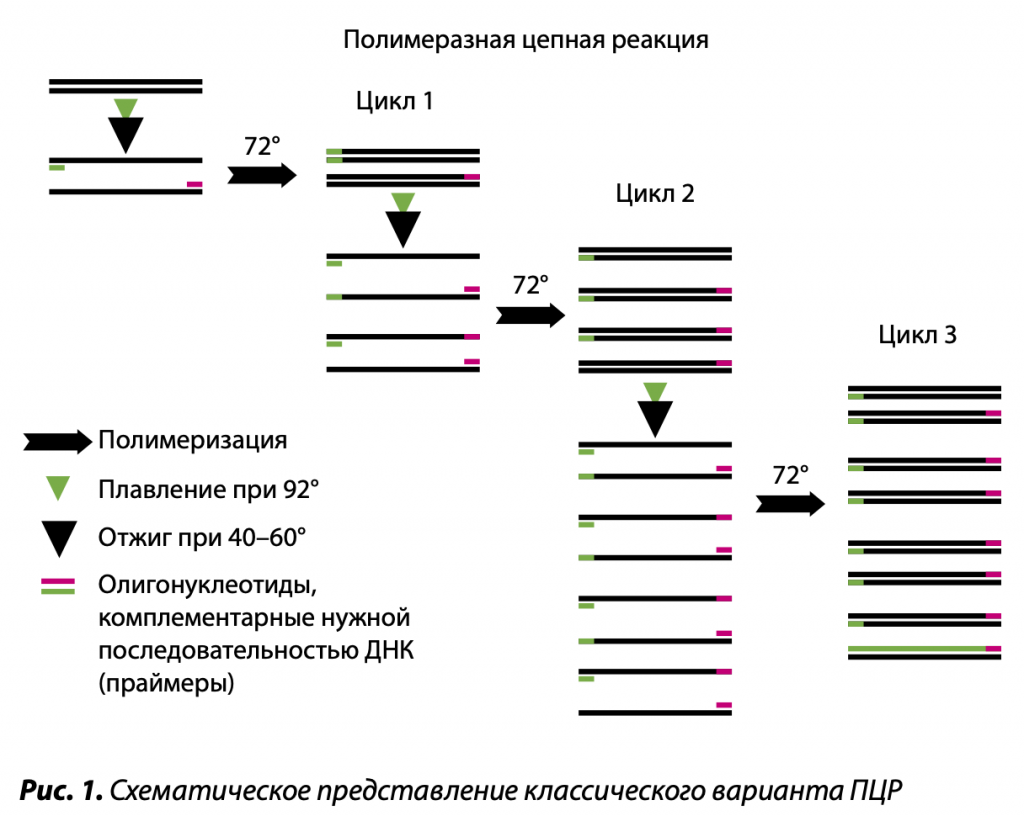
Природный механизм удвоения ДНК, который происходит перед делением каждой клетки, называется репликация (aka редупликация). Надо сказать, что до сих пор не все белки-участники данного процесса изучены, что говорит о его сложности. Главное, что происходит при репликации — сборка дочерней цепи ДНК на половине материнской. Напомню, что ДНК представляет собой двойную спираль, а информативная часть — азотистые основания — скрыта внутри спирали. Задача удвоения ДНК состоит в том, чтобы правильно собрать нуклеотиды в новую цепь и получить две идентичные молекулы. Собирает нуклеотиды фермент ДНК-полимераза. Но как ей добраться до азотистых оснований, скрытых в материнской цепи? Ответ прост — расплести цепи. Исполнение же трудно и требует участия целого ряда ферментов — гираз, лигаз, топоизомераз, белков, связывающих одиночную нить ДНК и препятствующих её повторному воссоединению (SSB белков). Тем не менее, ансамбль белков справляется с этой задачей (рис. 1). Итак, есть ДНК-полимераза, ей доступны азотистые основания матрицы, но что-то синтез не идёт.
Рисунок 1. Репликация ДНК. Обратите внимание, как много белков участвует в этом процессе.
Дело в том, что полимераза — фермент привередливый, синтез ДНК «с нуля» и не пойдёт: необходима затравка (праймер) — свободная OH-группа предыдущего нуклеотида или какого-либо белка. Теперь, присоединяя нуклеотиды к праймеру, ДНК-полимераза может копировать материнскую цепь.
Амплификация ДНК (ПЦР)
Амплификация — это искусственная многократная реплицкация. Итак, процесс репликации ДНК в клетке даже на настоящий момент изучен не до конца. Что же придумал Мюллис 30 лет назад? Как он смог скоординировать, по меньшей мере, десяток ферментов в один момент, о существовании части которых он даже и не знал? Представьте себе, никак. Он взял всего один фермент — ДНК-полимеразу. Доступ к азотистым основаниям обеспечил не белками, а плавлением. («Плавление» ДНК — неферментативное расхождение цепей при нагревании до 92–95 °C.)
Мы помним, что нужен праймер, чтобы «привередливая» полимераза начала работать. Добавляем 18—30-нуклеотидный фрагмент ДНК, комплементарный границе интересующей нас последовательности. Однако больших успехов все равно не получаем. Реакция идёт, но мы не можем сказать, что удваивается именно наш ген, потому что будут получаться фрагменты разной длины, зависящие от времени работы полимеразы и её активности. Как же понять, какой из образующихся продуктов — искомый?
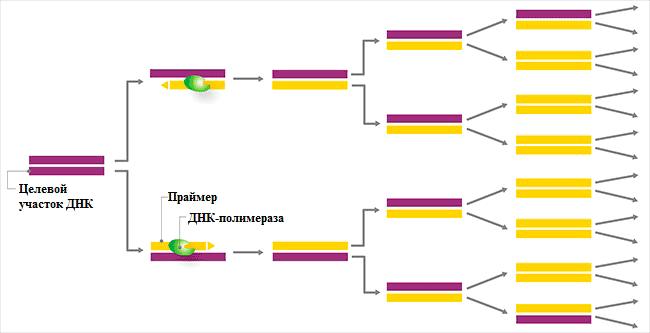
В ответе на этот вопрос и появилась гениальная идея Мюллиса — надо брать не один праймер, а два: прямой (F) и обратный (R). Тогда мы будем знать длину нашего фрагмента и быстро увеличим его количество. Также Мюллис предложил проводить реакцию не один раз, а циклом 30–45 повторов. Математический подсчёт показывает, что количество продукта будет расти как 2 n (рис. 2), где n — число циклов. (А если бы использовался один праймер, то число фрагментов увеличивалось бы просто как n.) То есть через 30 циклов мы получаем в 10 9 (в миллиард) раз больше продукта, чем содержалось в исходном образце (а не в 30 раз больше, как было бы при использовании одного праймера). Почему же такая огромная разница? Дело в том, что при использовании двух праймеров каждый образующийся фрагмент служит матрицей в ходе следующих циклов. В случае одного праймера продукт будет ему не комплементарен и не будет использоваться как матрица в дальнейшем.
Рисунок 2. Схематическое изображение процесса полимеразной цепной реакции. Фиолетовым цветом показана исходная молекула ДНК, жёлтым — образующиеся в ходе реакции молекулы ДНК, идентичные исходной. Видно, что уже после третьего цикла число молекул увеличивается в 8 раз.
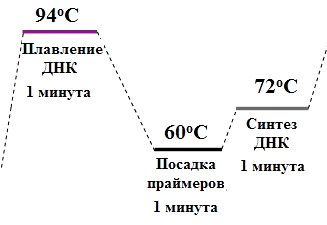
Рисунок 3. Цикл амплификации. Каждый цикл состоит из трёх ступеней: расхождение цепей ДНК, посадка праймеров и синтез новых цепей. Каждая ступень длится около 1 минуты. Таким образом, программа из 30 циклов будет длиться около 90 минут.
Сейчас проведение ПЦР занимает около 2 часов, благодаря использованию особой ДНК-полимеразы [2]. Дело в том, что каждый цикл ПЦР начинается с плавления ДНК на 95 °C (рис. 3), а «простая» полимераза — обычный белок — не выдерживала такой температуры и теряла функциональность, свернувшись, как белок варёного яйца. Поэтому по Мюллису после каждого цикла надо было добавлять новую порцию полимеразы. Рэнди Сайки (Randy Saiki) в 1986 году предложил использовать полимеразу из организма, живущего в термальных источниках — бактерии Thermophilus aquaticus (Taq-полимеразу), выдерживающую такой перегрев и работающую оптимально при 72 °C [3].
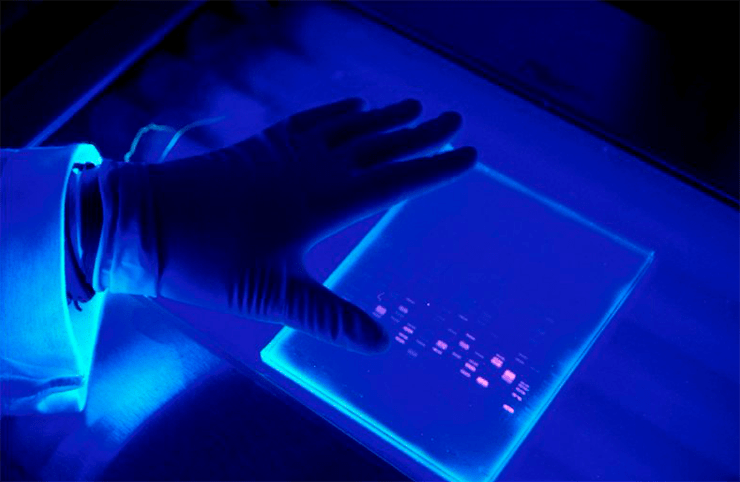
Как же теперь доказать, что, переливая прозрачные растворы, мы всё-таки не потеряли ДНК? Это можно увидеть глазами после 40-минутнтого разделения продуктов ПЦР в геле с помощью электрофореза. Гель — это, своего рода, молекулярное сито, сквозь которое под действием электрического тока идут молекулы: мелкие проходят быстро, крупные — медленно. Кроме того, фрагменты одинаковой длины концентрируются на одном уровне (а мы, следуя рекомендации Мюллиса, специально подбирали праймеры так, чтобы фрагменты были заданной длины). Всё это рассматривается в ультрафиолетовом (УФ) свете после добавления красителей, связывающихся с ДНК. В итоге мы увидим наш один ген или его фрагмент (или ничего не увидим, если искомой ДНК не было) (рис. 4).
Рисунок 4. Результат разделения продуктов ПЦР в агарозном геле. В качестве красителя, связывающего ДНК, использован бромистый этидий. Съёмка сделана в УФ-свете.
Итак, Мюллис предложил увеличить число иголок в разы, чтобы их блеск без труда можно было различить в сене не интересующей нас ДНК. В настоящее время существует множество модификаций ПЦР, применяемых для самых различных целей. Однако у этой реакции есть существенный минус — потребность в специализированном лабораторном оборудовании: термоциклере-амплификаторе (приборе, способном быстро менять температуру раствора столько раз, сколько нам нужно), камере для электрофореза и т.д. А если этого нет? Можно ли всё провести при одинаковой температуре — например, на водяной бане или в простом термостате? Оказалось, что это возможно, и есть целый ряд методов изотермической амплификации. Слово изотермическая означает, что реакция идёт при постоянной температуре. Наиболее быстрым, специфичным, дешёвым и часто используемым методом является опосредованная образованием петель изотермическая амплификация (loop-mediated isothermal amplification, LAMP). Итак, прольём свет этих LAMP.
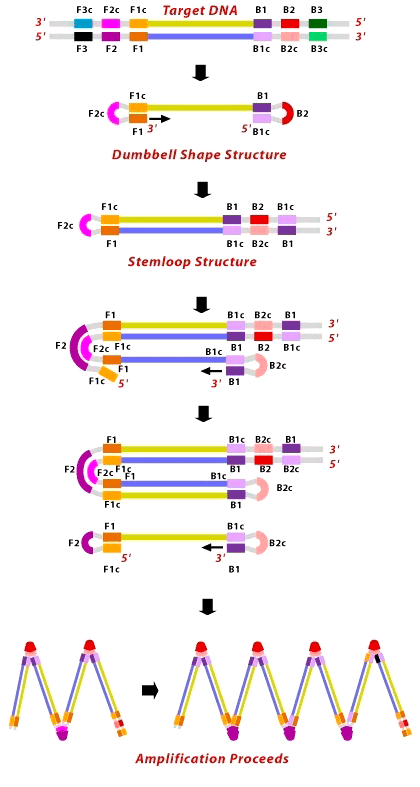
Рисунок 5. Схематическое изображение метода LAMP. Для понимания метода вспомните, что синтез идёт от 3′- к 5′-концу (маленькие горизонтальные стрелочки), а обратно — никогда.
Метод LAMP, как и ПЦР, использует термостабильную полимеразу. Примечательно, что, когда искали полимеразу для реакции Мюллиса, нашли две — Taq, которая используется и по сей день для ПЦР, и Bst (из Bacillus stearothermophilus). Было показано, что Bst-полимераза нестабильна и быстро выходит из строя при 95 °C, да и документация к Taq была лучше. Однако у Bst есть преимущество перед Taq: она вымещает вторую цепь ДНК сама, без участия ферментов или использования высоких температур. Использование Bst в методе LAMP позволило проводить реакцию на 30–40 минут быстрее, поскольку исчезает потребность в первом шаге цикла, но это ещё далеко не всё.
В названии метода, кроме постоянства температуры, упоминаются ещё некие петли. Давайте разберёмся. Метод LAMP, описанный японским учёным Цугунори Нотоми (Tsugunori Notomi) в 2000 году [4], подразумевал использование четырех праймеров (пары внутренних и пары внешних), узнающих шесть различных участков искомой ДНК. Внутренние праймеры подобраны таким образом, чтобы сформировать те самые петли на концах искомого фрагмента (рис. 5). Чтобы это удалось, к 5′-концу праймера F2 прикреплена вторая часть, комплементарная F1 части матрицы, — F1c, то есть фрагмент F1c—F2 — это и есть внешний праймер, длинной до 50 нуклеотидов (F от forward, «прямой»). В результате, как только новая цепь ДНК останется одна, из-за вымещающей активности Bst-полимеразы её конец тут же замкнётся в петлю. То же происходит и с праймерами, садящимися на противоположный конец матрицы (B от backward, «обратный»). В конечном итоге, появится одноцепочечный фрагмент ДНК с петлями с обеих сторон — гантелевидная структура (dumbbell structure). На этом завершается первый шаг LAMP.
После получения «гантельки» с одного из её концов (3′) полимераза продолжает синтез к другому (5′), образуя «рукоятку» (stemloop). Концы «рукоятки», оказавшись в одноцепочечном состоянии, замыкаются в петли, продолжая синтез. Так постепенно формируются загзагообразные продукты.
Внешние праймеры (F3 и B3) необходимы лишь в самом начале реакции для разделения двух материнских цепей.
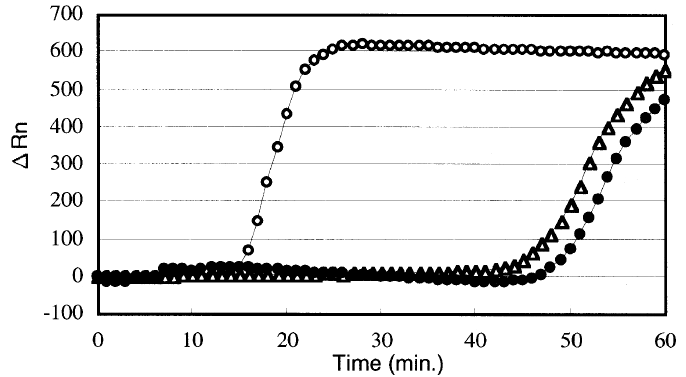
Такой метод позволяет быстрее нарабатывать продукт и длится от часа до получаса. Однако уже через два года этим же учёным удалось усовершенствовать свой метод, добавив ещё одну пару праймеров — петлевые праймеры [5]. При их использовании, предположительно, идёт наработка продукта с петель в обе стороны, а не в одну, как в оригинальном методе. Как показывает график из этой работы (рис. 6), уже через 10–20 минут можно было регистрировать продукт в достаточном количестве.
Рисунок 6. Сравнение эффективности LAMP с добавлением петлевых праймеров (пустые кружки) с классической LAMP (зачернённые кружки). По оси Х отложено время, по оси Y — изменение интенсивности флуоресценции (по нему можно судить об изменение количества ДНК в образце).
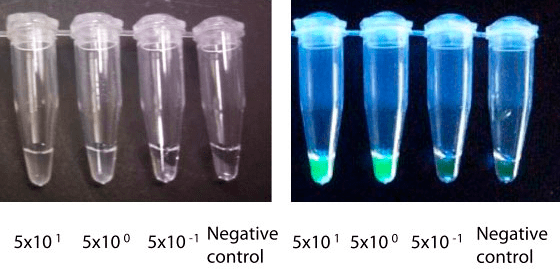
Да, как же регистрировать продукт в этой реакции? Представляете, просто взглянув на пробирку (не нужно ждать 40 минут), можно увидеть помутнение — это выпадает осадок пирофосфата магния. Ионы магния входят в состав реакционной среды, помогая работать Bst-полимеразе, а пирофосфат-ионы высвобождаются из нуклеотидов при синтезе цепи. Для верности можно также добавить краситель, связывающий ДНК и осветить УФ (рис. 7).
Рисунок 7. Визуализация результатов LAMP. Это одинаковые пробирки в естественном (слева) и УФ-свете (справа). В подписях указано исходное число молекул ДНК в пробе. Интересно, что даже 5 молекул ДНК в 25 мкл детектируются этим методом.
Сравнение ПЦР и LAMP
Таким образом, используя метод LAMP, можно ответить на вопрос «Присутствует ли интересующий нас ген в пробе?» за 5–20 минут [7], в то время как при использовании ПЦР ответа придётся ждать около двух часов, не считая времени на электрофоретическое разделение продуктов. Но, как известно, спешка хороша при ловле блох, а для научного исследования куда важнее точность и специфичность (то есть амплификация всегда и только той последовательности ДНК, которую мы задали, а не просто похожей).
Однако и тут LAMP опережает ПЦР. LAMP более специфичен, потому что ему необходимо узнать целых шесть участков в искомой молекуле ДНК, а ПЦР — только два (которые находятся непосредственно под праймерами). Но, что даже более важно, на LAMP не оказывает влияния присутствие биологических компонентов, зачастую не позволяющих провести ПЦР [8]. Исследуемый образец (например, слюну) можно заносить в реакционную смесь без очистки и искать гены вируса [6]. Благодаря этому свойству, LAMP используется в клинической практике для выявления патогенов человека и животных [9], определения пола коров до имплантации зародыша и даже нахождения метастазов прямо во время хирургической операции [10]. Метод прост в исполнении, дёшев (в отличие от других методов изотермической амплификации) и не требует ни сложной техники, ни обязательных биологических знаний.
| Критерий | ПЦР | LAMP |
|---|---|---|
| Необходимость плавления ДНК | + | − |
| Температура (°C) | 94; 55–60; 72 | 60–65 |
| Устойчивость к биологическим компонентам | − | + |
| Продолжительность (минут) | 90–120 | 5–20 |
| Регистрация продукта | электрофорез | невооружённым глазом |
Какой из методов лучше применять, зависит от эксперимента. Если исследователь постоянно меняет праймеры, условия или изучаемый ген, то ПЦР будет удобнее. Несмотря на то, что она занимает больше времени, на деле два часа едва хватает, чтобы приготовить смесь для следующей реакции и занести пробы в биохимический планшет. Если же речь идёт о предотвращении пандемии, и необходимо как можно быстрее определить присутствие известного вирусного агента, то, конечно, LAMP. Его можно применять, например, для мониторинга здоровья пассажиров в аэропортах стран, из которых возможно занесение вируса.
В заключение хочу отметить интересную тенденцию научных исследований, проявившуюся в эволюции методов амплификации нуклеиновых кислот. Как указано выше, во время создания ПЦР был выбор между двумя полимеразами: Taq и Bst. Мюллис выбрал Taq и построил свой метод на ней. А Нотоми спустя двадцать лет вернулся к Bst и придумал ещё более мощный метод LAMP.
Изотермическая ПЦР — обзор метода диагностики инфекций растений
Текст: Ю. Ф. Дрыгин, д-р хим. наук, доц., зав. лабораторией, НИИ физико-химической биологии им. А. Н. Белозерского Московского государственного университета имени М. В. Ломоносова; ФГУ «ФИЦ “Фундаментальные основы биотехнологии” РАН»
Технологии массовой диагностики инфекций высших организмов развиваются стремительно. Методики и оборудование, ранее доступные только специалистам в прогрессивных научных лабораториях, сегодня уже имеются в распоряжении сельхозпроизводителей, у которых появилась возможность проведения анализа на молекулярном уровне в полевых условиях.
Известно, что сельскохозяйственные культуры повсеместно заражаются микроорганизмами: вироидами, вирусами, бактериями и грибами. Поскольку заболевания растений на практике не лечатся, главными средствами борьбы с ними являются создание устойчивых к тем или иным инфекциям сортов, своевременная профилактика и точная диагностика с целью выбраковки больного материала, причем последняя считается наиболее экономически выгодной. Сегодня эффективной технологией установления наличия заболеваний считается метод полимеразной цепной реакции (ПЦР), из которого на основе сугубо лабораторных методов образовалась рутинная методика изотермической ПЦР.
НА МОЛЕКУЛЯРНОМ УРОВНЕ
Специфика диагностики инфекций широкого круга фитопатогенов, значительно различающихся по морфологии, структуре и физико-химическим свойствам, как в посадочном материале, так и непосредственно в поле определяет методы, которые применимы для массового анализа, то есть для десятков или сотен образцов одновременно. Данные способы должны сочетать в себе избирательность установления целевого патогена, чувствительность детекции, достаточную для его выявления в полевом материале, производительность, удовлетворяющую экономический аспект производства, скорость, необходимую в экстренных случаях при массовых инфекциях, а также ценовую и эксплуатационную доступность.
Как известно, даже самые простые патогены растений представляют собой молекулу рибонуклеиновой кислоты. Более сложные структуры, например вирусы и бактерии, обязательно содержат определенные мишени — специфические белок или нуклеиновую кислоту (НК). Молекулярная диагностика (МД) инфекций является частным случаем выявления целевых нуклеотидной последовательности и/или антигена патогенов. Она базируется на двух принципах молекулярного узнавания: нуклеиново-нуклеинового по правилам комплементарного спаривания гетероциклических оснований НК, а также белок-белкового — по формуле «белковый антиген — антитело» с использованием методов иммуноферментного анализа (ИФА) или иммунохроматографических тест-систем. Сегодня чувствительность такой диагностики достигла предела — в анализируемой пробе достоверно может быть обнаружена даже одна молекула НК патогена. Таким образом, исследование на молекулярном уровне ставит окончательный диагноз зараженности растений тем или иным микроорганизмом. При этом природа хозяина и патогена не имеет значения, поскольку методы детекции одинаковы — меняется только способ подготовки образца к изучению. Для проведения анализа нужны микроколичества материала — до нанограммов.
ВЫБОР МЕТОДА
Диагностический анализ на молекулярном уровне как НК, так и белкового антигена патогенов состоит из нескольких стадий. Первый этап подразумевает сбор материала и его хранение. Если не удается провести исследование свежесобранной пробы, то она замораживается и содержится при –20ºС или –70ºС, поскольку в зависимости от стадии роста и срока хранения при комнатной температуре в растениях накапливаются различные вещества, в частности продукты автолиза, полифенолы и другие, осложняющие проведение исследования. Вторая стадия предполагает выбор метода анализа. Диагностика значительно упрощается, если известна протяженная последовательность нуклеотидов НК патогена или его специфический антиген, а также доступны антитела к нему. В противном случае необходимо получение очищенных препаратов микроорганизма, выделение его НК и определение последовательности нуклеотидов протяженного участка или отбор и очистка специфического антигена.
Следует отметить, что наибольший вред злаковым зерновым культурам приносят инфекции, вызванные грибами, причем они представляют угрозу как для живого растения, так и для находящегося на хранении сырья. Некоторые из этих микроорганизмов выделяют токсины, опасные для здоровья млекопитающих. В данном случае метод обнаружения грибной инфекции упрощается: определение ядовитого вещества иммунометодами значительно легче, чем выявление самого патогена.
ПОЛУЧИТЬ РЕЗУЛЬТАТ
Следующая стадия представляет собой подготовку образца к анализу. Клеточные экстракты содержат множество веществ, которые мешают постановке диагноза, поэтому необходим препарат предварительно очищенного патогена. Для этого требуются лабораторное оборудование и квалифицированный персонал, причем получение целевого материала занимает часы и иногда дни. Множество компаний предлагает свои наборы для подготовки проб с целью проведения анализа, однако разнообразие объектов исследования так велико, что универсального способа до сих пор не существует. Для диагностики инфекций растений удобным материалом является свежая листовая ткань, так как получение препарата из коры, семян или полежавших клубней значительно сложнее. Явная инфекция в подготовленном образце может быть идентифицирована в течение 15–30 минут. При начальной стадии заражения, когда требуется определить малое число молекул патогенного организма, время анализа может составлять несколько часов. В сложных случаях требуется некоторое количество положительных и отрицательных контролей и дополнительное подтверждение достоверности диагностики независимым способом.
Заключительная стадия — обработка результатов. Поскольку МД претендует на постановку окончательного диагноза, важно проведение повторного исследования с последующей обработкой полученных сведений с помощью математической статистики или подтверждение итогов первого анализа независимым методом.
ВЫСОКАЯ ЧУВСТВИТЕЛЬНОСТЬ
Наиболее быстро адаптируемой к сельскохозяйственной практической диагностике технологией определения НК патогенов является полимеразная цепная реакция. Она содержит более десяти методов амплификации, то есть размножения, в десятки и сотни миллионов раз фрагмента нуклеиновой кислоты микроорганизма. Как известно, ДНК представляет собой спираль, состоящую из двух нитей полинуклеотидов. Они являются полярными, и у них различаются 5’- и 3’-концы, при этом синтез идет в направлении 5’g3’ навстречу друг другу. В классической ПЦР размножается фрагмент ДНК патогена длиной от ста до нескольких сот нуклеотидов, последовательность которых известна. В анализе к образцу, содержащему целевую ДНК, добавляются в молярном избытке по отношению к этой макромолекуле специфические праймеры — олигонуклеотиды, затравки синтеза, каждый из которых комплементарен определенным участкам одной из нитей ДНК патогена. Поскольку данные нити являются полярными и разнонаправленными, а копирование их происходит в противоположном направлении, выбранные праймеры определяют размер размножаемого между ними фрагмента ДНК. Комплементарное их спаривание с матричной ДНК определяет специфичность продукта ПЦР. Синтез дочерних макромолекул из 5’-дезоксинуклеозидтрифосфатов катализируется термоустойчивым ферментом — ДНК-полимеразой. Один цикл размножения состоит из нескольких стадий. Прежде всего, осуществляется плавление ДНК микроорганизма, а затем и дочерних ДНК, при температуре 90–95ºС, причем в этом случае комплементарные нити расходятся. После этого происходит отжиг при температуре, оптимальной для связывания праймеров, — 40–70ºС, а также синтез дочерней ДНК при 70ºС. В результате каждого цикла образуется копия фрагмента ДНК патогена, фланкированная праймерами.
ВАЖНЫЕ АСПЕКТЫ
В приборе для ПЦР циклы размножения повторяются 20–30 раз, в результате чего получается почти 220–230 образцов фрагмента макромолекулы в количествах, позволяющих использовать полную копию во многих приложениях лабораторной и практической диагностики. Данный продукт в варианте классической полимеразной цепной реакции определяется с помощью электрофореза в агарозном геле в присутствии флуоресцирующего красителя ДНК — бромистого этидия. В технологии ПЦР существует два аспекта, которые требуют особого внимания. Прежде всего, для проведения реакции необходимо предварительное получение препарата целевой нуклеиновой кислоты, очищенного от примесей, ингибирующих ДНК-полимеразы и обратные транскриптазы. Кроме того, классическая методика часто дает ложноположительные сигналы незараженного образца, поэтому для достоверности анализа необходима идентификация продукта ПЦР. Чаще ее проводят путем специфического комплементарного связывания материала с ДНК-зондом, меченным хромогенной или флуоресцентной меткой. Наиболее надежное доказательство так называемого родства продукта ПЦР с ДНК патогена дает метод определения последовательности нуклеотидов в целевой размноженной ДНК.
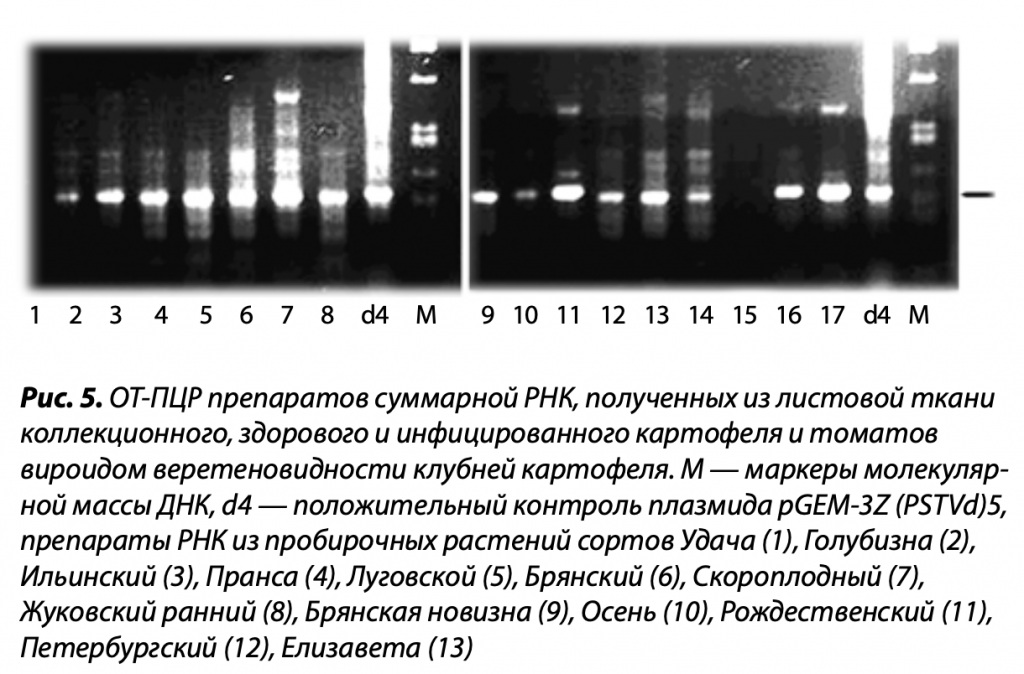
Известно, что большая часть вирусов высших организмов содержит РНК. В этом случае можно использовать технологию ОТ-ПЦР (RT-PCR) — полимеразную цепную реакцию, которой предшествует обратная транскрипция РНК патогена в комплементарную ДНК (кДНК). Данный процесс катализирует фермент под названием обратная транскриптаза. Сейчас реакции ОТ и ПЦР совмещают в одной пробирке. Продукты анализа определяются электрофорезом в геле агарозы или полиакриламида в присутствии флуоресцирующего красителя.
В РЕАЛЬНОМ ВРЕМЕНИ
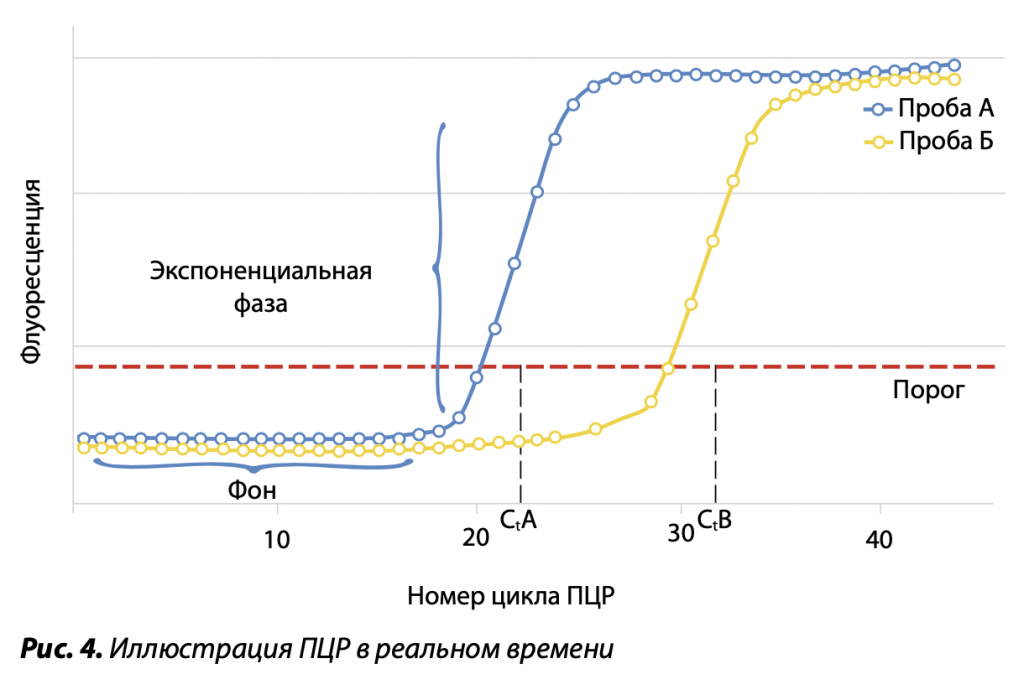
Широкое распространение получил метод ПЦР, в котором можно следить за динамикой накопления целевой кДНК в растворе в реальном времени. В продукты реакции включаются праймеры, которые помечены флуоресцентной меткой, либо ДНК-препараты окрашиваются красителем SYBR Green. Более высокая точность этого анализа в сравнении с классической ПЦР получается за счет использования флуоресцентных красителей с высоким квантовым выходом и чувствительного детектора флуоресценции в растворе. В рамках данного метода исследование продуктов синтеза электрофорезом в геле не требуется. Специфичность продуктов реакции определяется сравнением динамик трех результатов размножения: целевой ДНК и продукта кПЦР с праймером, гибридизующимся с внутренней частью фрагмента ДНК, с заданным количеством ДНК контрольного образца с его специфической парой праймеров. Сравнение кинетики реакции проводится в так называемой пороговой точке экспоненциального синтеза препаратов кПЦР, выбираемой в каждом анализе. Степень накопления продуктов амплификации связана с исходным количеством исследуемой ДНК, что дает возможность точно оценить ее количество. По этой причине данный метод называют количественной ПЦР (кПЦР, qPCR). Последующее изучение кривых плавлений продукта кПЦР позволяет оценить его гомогенность. Если он не оказывается таковым, необходимо оптимизировать условия ПЦР.
ОСОБЕННОСТИ РЕАКЦИЙ
Одновременная ПЦР множества образцов (PCR arrays) — вариант анализа в реальном времени, который проводится в 96, а иногда вплоть до 1536 луночных планшетах. Для количественного определения в положительный контроль добавляется известное количество ДНК и специфичные праймеры. Одновременно можно анализировать как множество образцов с одним фрагментом целевой ДНК, так и ряд частей разных макромолекул или генов, причем в последнем случае важен подбор оптимальных пар праймеров и условий проведения исследования. Продукты реакции определяются количественно по флуоресценции их с красителем SYBR green.
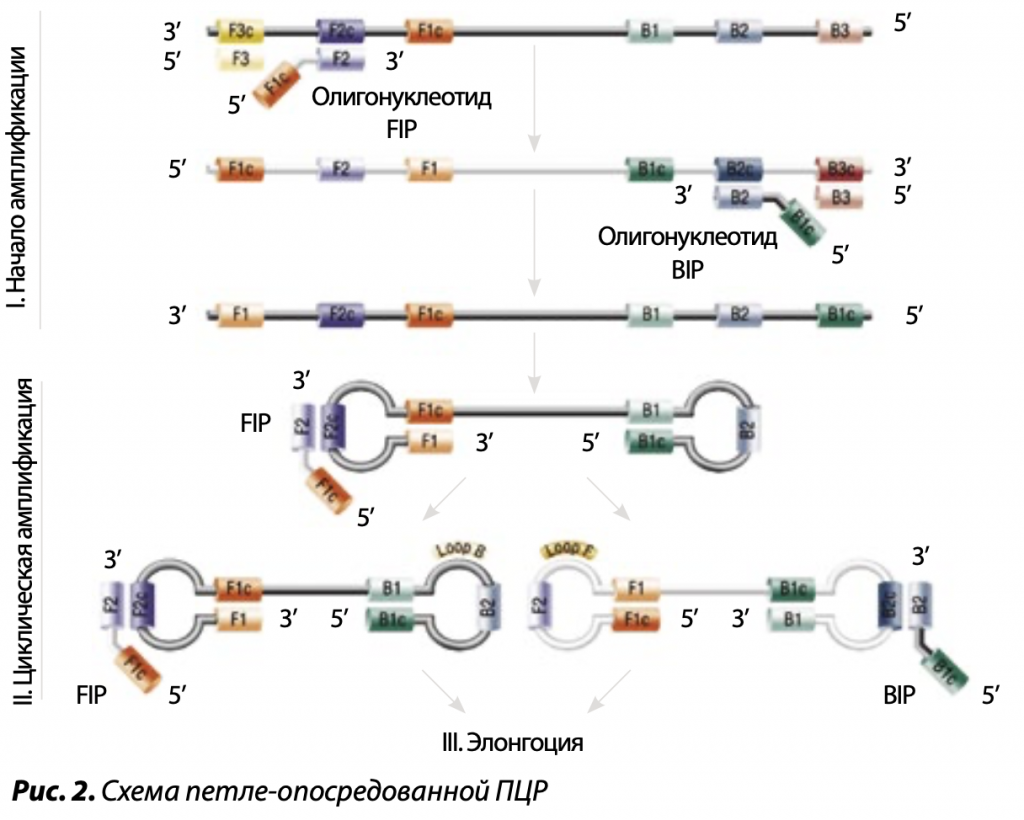
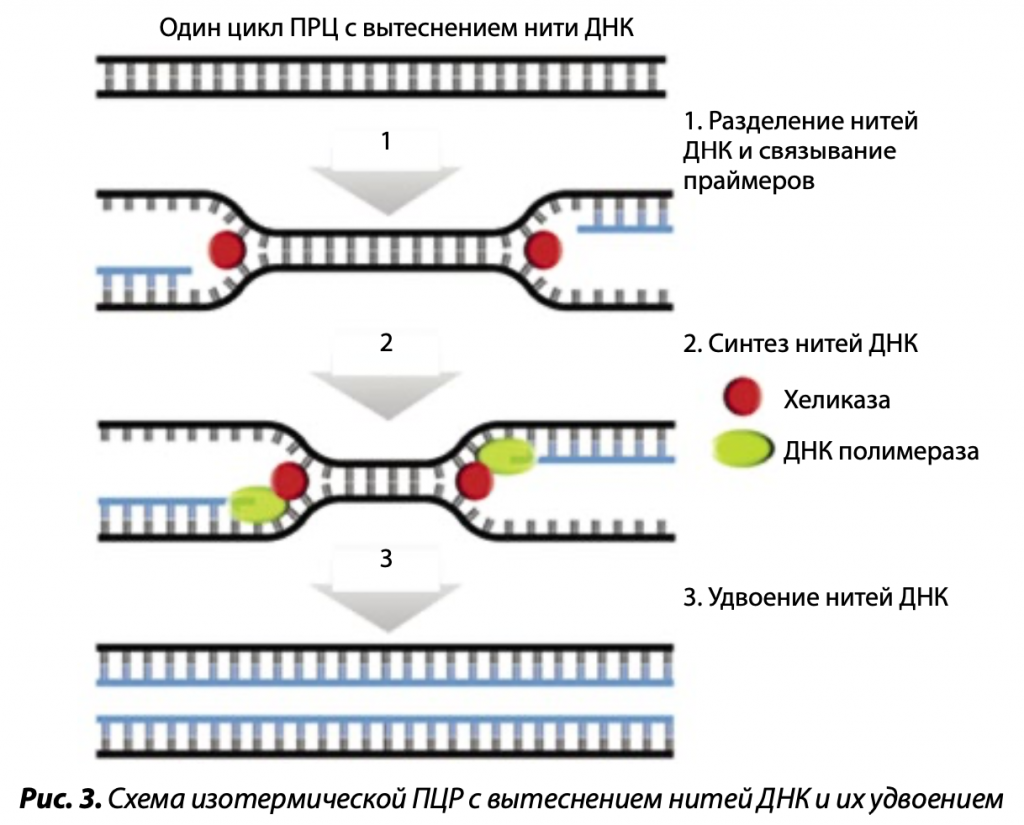
Изотермические ПЦР не требуют повторяющихся температурных циклов «плавление — отжиг — синтез цепи» и проходят при постоянной температуре, равной 37ºС или 60ºС. В этой реакции используются ДНК-полимеразы с высокой вытесняющей активностью, или дополнительно к ним добавляется фермент — ДНК-хеликаза, расплетающая двойную спираль макромолекулы. В связи с этим в изотермических ПЦР отпадает необходимость стадии термической денатурации ДНК. Такие ДНК-полимеразы, стартуя с праймера, связавшегося с матричной нитью, ведут синтез новой комплементарной нити, вытесняя старую. Различают несколько методов изотермической ПЦР: способ, в рамках которого подобранные праймеры образуют шпильки или петли, и технологию с вытеснением нити ДНК.
СОЗДАНИЕ ПЕТЕЛЬ
Ключевым ферментом петле-опосредованной изотермической ПЦР является термостабильная ДНК-полимераза Bst бациллы Bacillus stearothermophilus. Ее производное Bst 3.0, то есть улучшенный генетической инженерией вариант, обладает не только высокой эффективностью синтеза ДНК при 60ºС, но и хеликазной активностью, расплетающей двойные цепи ДНК — РНК и ДНК — ДНК и вытесняющей родительскую цепь дочерней. Более того, полимераза Bst 3.0 отличается действенностью обратной транскриптазы, что позволяет проводить две реакции ОТ и ПРР в одной пробирке. Этот фермент мало чувствителен к примесям, ингибирующим ДНК-полимеразы, и работает эффективно с грубо очищенными препаратами НК.
В петле-опосредованной ПЦР для образования петель на однонитевой ДНК используются две и более пар прямых и обратных праймеров, причем каждая из них специфически спаривается с несколькими комплементарными участками одной нити ДНК. В результате репликации продукт каждого цикла будет содержать петлю за счет внутримолекулярного взаимодействия в нити ДНК. Внутренние праймеры используются для изотермической ПЦР, а внешние подбираются таким образом, чтобы, спарившись с соседними участками с обоих концов этой же цепи макромолекулы, образовать петли. В этом случае их 3’-концы становятся затравками для комплементарной полимеризации навстречу друг другу дочерних ДНК. Полимераза эффективно вытесняет родительскую цепь, заменяя ее побочным фрагментом, при этом у дочерних цепочек также будут аналогичные петли.
ЭКОНОМИЯ И ДОСТОВЕРНОСТЬ
Изотермическая ПЦР обладает несколькими преимуществами в сравнении с классической полимерно-цепной реакцией. Прежде всего, отсутствует необходимость в амплификаторе, поскольку петле-опосредованная реакция проводится при постоянной температуре. Кроме того, при таком исследовании более высокую специфичность продукта реакции определяют несколько пар праймеров, при этом за счет внутримолекулярного праймирования возрастает специфичность и скорость синтеза дочерних ДНК на порядок. За 15–30 минут вырабатывается такое количество продукта, что за его образованием можно следить визуально как с помощью специального красителя, так и по появлению осадка пирофосфата магния — побочного явления полимеризации дезоксинуклеозидтрифосфатов. Для изотермических ПЦР доступны ДНК-полимеразы, более устойчивые к клеточным загрязнениям в препаратах макромолекулы.
Наиболее эффективным вариантом изотермической ПЦР при 37ºС, в котором используется ДНК-полимераза с высокой хеликазной активностью или хеликаза добавляется дополнительно, является тот, в котором реакции вытеснения родительской и синтезированных цепей ДНК совмещены с реакцией эндонуклеазы, вносящей одноцепочечные разрывы в ДНК с образованием 3’-концов – затравок для синтеза ДНК. Множество точек праймирования этого процесса приводит к быстрому экспоненциальному образованию фрагментов дочерних ДНК различной длины, комплементарных родительской цепочке. В результате время, необходимое для постановки диагноза о наличии инфекции этим вариантом ПЦР, может составлять 5–10 мин. Сегодня данное исследование как наиболее простой метод используется в практической молекулярной диагностике и может эффективно применяться в сельском хозяйстве.
Необходимость массового внедрения и использования доступных систем диагностики инфекций растений на молекулярном уровне в нашей стране сегодня вполне очевидна. Подобные технологии помогут не только повысить урожайность культур, возделываемых сельхозпроизводителями, но и сформировать отечественный рынок качественного и безвирусного семенного материала.