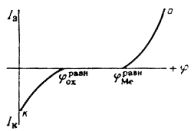
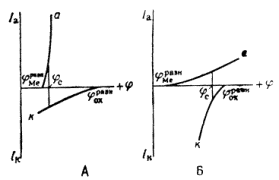
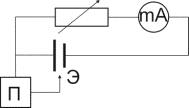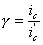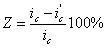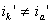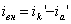какие катодные реакции представляют наибольший интерес для теории и практики коррозии
Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
анод (Fe): Fe 0 ® Fe 2+ + 2ē
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe 0 + 2H + ® Fe 2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 
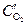
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 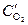
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al 0 ® Al 3+ + 3ē
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:
Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 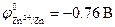
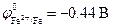
анод (Zn): Zn 0 ® Zn 2+ + 2ē
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
Примеры защиты металлов от коррозии
Решение задач по химии на покрытие металлов
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
Решение:
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Задание 285.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
Решение:
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Электрохимические методы защиты металлов от коррозии
кафедра физической химии
Курсовая работа по электрохимии
Тема : «Электрохимические методы защиты металлов от коррозии»
Выполнила студентка III курса
35-й группы ХБГ факультета
СОДЕРЖАНИЕ
Понятие коррозии. 3
Значение термина «коррозия». 3
Химическое и электрохимическое окисление металлов. 3
Общие положения электрохимической теории коррозии. 4
Другие способы изображения коррозионных диаграмм. 8
Методы защиты металлов от коррозии. 8
Явление пассивности. 12
Анодная защита. Использование пассивности в практике защиты от коррозии. 14
Покрытия, как метод защиты металлов от коррозии. 18
Понятие коррозии.
Значение термина «коррозия»
Самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий), называется коррозией[1]. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной, или агрессивной. При этом образуются продукты коррозии: химические соединения, содержащие металл в окисленной форме.
В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин «коррозия» употреблять не следует. Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окислятся, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется.
Следовательно, термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин «окисление», независимо от того вредно или полезно оно для нашей практики.
Коррозия является естественным процессом, обусловленным термодинамической нестойкостью металлов в условиях службы. Естественно поэтому, что изучение коррозии и разработка методов защиты металлов от нее представляют несомненный теоретический интерес и имеют большое народнохозяйственное значение.
Химическое и электрохимическое окисление металлов.
Кинетика процессов окисления зависит от природы среды, содержащий окислитель. Если среда представляет собой электролит (очень частый случай), окисление протекает по электрохимическому механизму:
n ox + z e à m red (2)
где ox-окислитель, а red- восстановленная форма его.
Реакции (1) и (2) протекают сопряженно на анодных и катодных участках, площадью 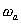
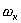
Если окислитель не является электролитом, то обмен электронами совершается непосредственно между металлом и окислителем:
Здесь окисление протекает по химическому механизму.
Таким образом, принято различать электрохимическую и химическую коррозию, хотя такое разделение в некоторой степени условно.
Общие положения электрохимической теории коррозии.
Рассмотрим схему коррозионного процесса. Сложность его заключается в том, что на одной и той же поверхности происходят одновременно два процесса, противоположные по своему химическому смыслу: окисление металла и восстановление окислителя. Оба процесса должны протекать сопряженно, чтобы сохранялось равенство числа электронов, отдаваемых металлом и присоединяющихся к окислителю в единицу времени. Только в этом случае может наступить стационарное состояние.
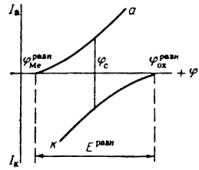
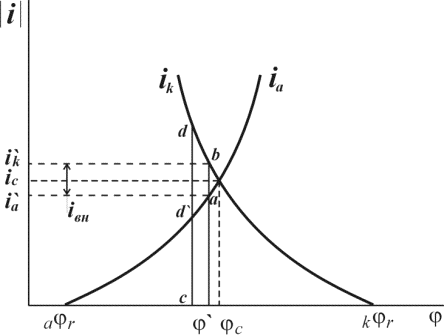
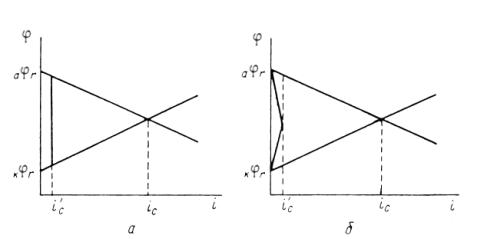
Независимое, но сопряженное протекание процессов окисления и восстановления позволяет рассматривать коррозию при помощи анодных и катодных поляризационных кривых. На рис.1 показана коррозионная диаграмма для металла и окислителя. Чтобы окисление металла окислителем могло иметь место, 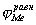
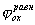
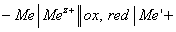
Для получения коррозионной диаграммы необходимо построить электрическую цепь, изображённую на рисунке 2. Проведя несколько измерений, изменяя величину сопротивления, и соответственно наблюдая за изменением силы тока, а также потенциала в цепи, строят зависимость 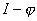
При разомкнутой цепи мы измерили бы э.д.с. 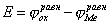
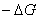
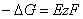
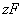
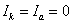
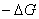
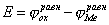
Если не пользоваться гальваническим элементом, а просто погрузить металл в раствор, содержащий окислитель, то стационарное состояние будет возможно только в том случае, если скорость реакции окисления металла (1) будет равна скорости восстановления окислителя (2).
Это означает, что при стационарном потенциале 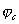
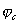
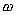
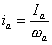
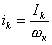
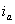
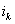
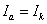
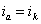

На рис.1 изображены анодная а и катодная к поляризационные кривые для данного металла в растворе определенного состава и для данного окислителя на поверхности того же металла. Наклон кривых а и к определяет кинетику процесса. Таким образом, рисунок содержит сведения о термодинамической возможности коррозии данного металла некоторым окислителем и о скорости этого процесса, определяемой кинетикой реакций (1) и (2), т.е. зависимостью их скоростей от смещения соответствующих потенциалов от равновесного значения. Коррозия возможна только в том случае, если 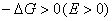
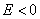
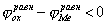
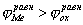
Рис. 3. Поляризационные кривые, отвечающие случаю, когда 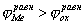
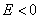
Легко понять, что при данном 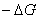
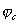
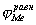

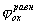
Рис. 4. Коррозионные диаграммы, отвечающие катодному контролю (А) и анодному контролю (Б).
Другие способы изображения коррозионных диаграмм
Применяемый в этой главе способ рассмотрения процессов коррозии при помощи поляризационных диаграмм весьма распространен. В том виде, в котором мы его использовали выше, он был предложен К. Вагнером и В. Траудом и подробно разработан А. М. Шультиным Способ этот характеризуется тем, что анодный и катодный токи, выражающие скорость противоположных по химическому смыслу процессов, откладываются в противоположные стороны от оси абсцисс. По оси абсцисс откладывается потенциал.
Однако весьма распространен и другой метод, предложенный Ю. Р. Эвансом, при котором ток, измеряющий скорость окисления и восстановления, откладывается в одном направлении и принимается за аргумент (абсцисса). Потенциал (ордината) откладывается так, что иногда вверх растет положительное значение, а иногда – отрицательное
Легко убедиться, что все способы изображения коррозионных диаграмм по существу равноценны. Дальше мы будем использовать различные способы изображения, для того чтобы научиться разбираться и в тех, и в других.
Методы защиты металлов от коррозии.
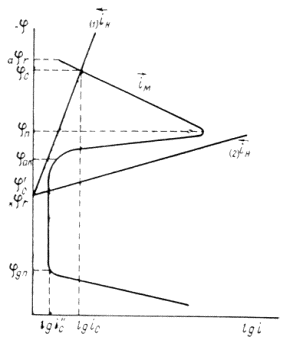
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Коррозионные диаграммы, наиболее полно характеризующие коррозионный процесс, должны отражать и те изменения в ходе протекания, какие наблюдаются в условиях защиты. Коррозионные диаграммы можно использовать, поэтому при разработке возможных путей предохранения металлов от коррозии. Они служат основой для выяснения принципиальных особенностей того или иного метода. В связи с этим при рассмотрении существующих методов защиты поляризационные диаграммы будут использованы в их несколько упрощенном виде (4). На таких диаграммах постулируется линейная зависимость между плотностью и потенциалом каждой частной реакции. Это упрощение оказывается вполне допустимым при качественной оценке особенностей большинства методов
где 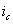
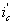
Катодная защита
Из всех методов защиты основанных на изменении электрохимических свойств металла под действием поляризующего тока, наибольшее распространение получила защита металлов при наложении на них катодной поляризации (катодная защита). При смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной реакции увеличивается, а скорость анодной падает (см. рис. 4). Если при стационарном потенциале 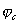
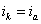
то при более отрицательном значении 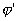
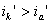
Рис. 5. Поляризационная диаграмма коррозионного процесса.
Уменьшение скорости анодной реакции при катодной поляризации эквивалентно уменьшению скорости коррозии. Коэффициент торможения при выбранном потенциале j / (см.рис.4) будет равен двум
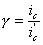
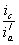
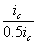
а степень защиты достигает 50%
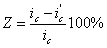
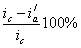
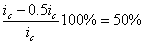
Внешний ток 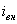

Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Она является экономически оправданной в тех случаях, когда коррозионная среда обладает достаточной электропроводностью, и потери напряжения (связанные с протеканием защитного тока), а следовательно, и расход электроэнергии сравнительно невелик. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет здесь роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита). Растворимый анод при протекторной защите часто называют “жертвенным анодом”.
Применение для катодной защиты метода приложения тока облегчает регулирование системы и часто дешевле, чем использование анодов – протекторов, которые, конечно, нуждаются в регулярных заменах.
На практике катодная защита редко применяется без дополнительных мероприятий. Требуемый для полной защиты ток обычно бывает чрезмерно велик, и помимо дорогостоящих электрических установок для его обеспечения следует иметь в виду, что такой ток часто будет вызывать вредный побочный эффект, например чрезмерное защелачивание. Поэтому катодная защита применяется в сочетании с некоторыми видами покрытий. Требуемый при этом ток мал и служит только для защиты обнаженных участков поверхности металла.
Явление пассивности.
Давно известно, что скорость коррозии многих металлов часто значительно меньше в растворах сильных окислителей, чем в растворах окислителей более слабых. Сюда относятся такие металлы, как железо, хром, никель, титан, цирконий, алюминий и многие другие. Резкое уменьшение скорости коррозии (на несколько порядков) в сильных окислителях, казалось бы противоречащее термодинамическим свойствам металла и окислителя, называется пассивацией, а состояние металла – пассивным.
Некоторые металлы находятся в пассивном (или близком к пассивному) состоянии даже в таких слабых окислителях, как вода. Это дает возможность практически использовать в качестве конструкционных материалов магний, титан, алюминий и многие другие.
М.В. Ломоносов был, по-видимому, первым исследователем, обратившим внимание на пассивность железа в концентрированной азотной кислоте. Железу посвящены наблюдения М. Фарадея и Х. Шенбейна. М. Фарадей сделал удивительную по научной дальновидности попытку объяснить пассивность железа образованием на поверхности слоя (пленки) окисла или же существованием поверхностных атомов металла в таком состоянии, которое равноценно окислению.
Очень большое практическое значение пассивности, часто определяющее возможность получения сплавов, химически стойких в агрессивных средах, вызвало огромное количество исследований, посвященных изучению пассивного состояния. Если отбросить некоторые несущественные различия, высказываемые на основании сопоставления экспериментальных данных, сказав, что пассивное состояние обусловлено образованием очень тонкой пленки окисла, представляющего собой отдельную фазу, или слоя хемисорбированного кислорода, а может быть и других частиц. Ограничимся представлением о некотором кислородном «барьере», образующемся на поверхности металла в подходящем окислителе и сильно тормозящем анодный процесс.
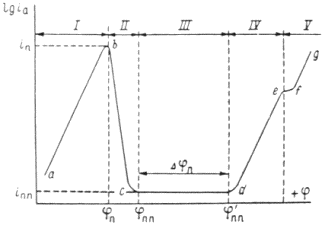
Рис. 6. Полная анодная поляризационная кривая: I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV – перепассивация; V – выделение кислорода.
При изменение потенциала в обратном направлении кривая, вообще говоря, имеет такой же ход. В таком случае 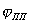
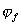
В настоящее время вопрос сводится к изучению природы защитных образований на металле, в которых обычно участвует кислород.
При более высоком потенциале становится возможным процесс выделения кислорода:
Зависимость времени запассивации от потенциала включения легко объяснима при помощи концепции фазового окисла (образуется более толстый слой окисла, растворение которого требует больше времени). Труднее объяснить это явление десорбцией пассивирующего кислорода. Конечно, с ростом положительного значения потенциала прочность связи в адсорбционном слое должна увеличиваться. Но при включении тока разряд двойного слоя происходит сравнительно быстро, хотя адсорбционный слой, возможно, сохраняется долго.
3. Если область пассивного состояния (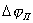
В настоящее время уже имеется ряд установок для анодной защиты, осуществленных в промышленном масштабе. Защищаются изделия и из обычной углеродистой стали. При анодной защите не только увеличивается срок службы аппаратуры, но также уменьшается загрязнение агрессивной среды продуктами коррозии. Например, в олеуме углеродистая сталь корродирует очень медленно и в этом смысле не нуждается в защите. Но в сосудах для хранения этого продукта происходит загрязнение его железом. Так, без анодной защиты в одной из промышленных установок содержание железа в олеуме составляло ≈ 0,12 %. После наложения защиты концентрация железа снизилась до ≈ 0,004 %, что соответствует его содержанию в исходном продукте. Загрязнение продуктов химической промышленности примесями соединений металлов, являющееся следствием коррозии аппаратуры, во многих случаях весьма нежелательно и даже недопустимо.
Однако, использование анодной защиты связано со значительными трудностями. В то время как катодная защита может употребляться для защиты многих металлов, погруженных в любую электропроводящую среду, например твердую или жидкую, анодная защита применяется только для защиты целых секций химических установок, которые изготовлены из металла, способного пассивироваться в рабочей среде. Именно это и ограничивает ее применение. Кроме того, анодная защита потенциально опасна, поскольку при перерывах подачи тока без немедленного восстановления защиты на рассматриваемом участке начнется очень быстрое растворение, так как разрыв в пленке образует путь с низким сопротивлением в условиях анодной поляризации металла.
Использование анодной защиты требует тщательного проектирования химической установки. Последняя должна иметь такую систему контроля, чтобы любая потеря защиты немедленно привлекала внимание оператора. Для этого может быть достаточным только локальное повышение анодного тока, однако в наихудшем случае может потребоваться немедленное опорожнение всей установки.
Анодная защита не обеспечивает стойкости в присутствии агрессивных ионов. Так, хлоридные ионы разрушают пассивную пленку, а потому их концентрация должна поддерживаться низкой, за исключением защиты титана, который может пассивироваться в хлористоводородной кислоте. В условиях анодной защиты имеет место хорошая рассеивающая способность электролитов и поэтому для поддержания ее установленной защиты требуется сравнительно небольшое количество электродов. Однако при проектировании установок анодной защиты следует учитывать, что в условиях, предшествующих пассивации, рассеивающая способность хуже.
Анодная защита потребляет очень мало энергии и может применяться для защиты обычных конструкционных металлов, способных пассивироваться, например углеродистой и нержавеющей стали, во многих средах. Эта защита легко подвергается контролю и измерениям и не требует дорогостоящей обработки поверхности металла, так как использует самопроизвольный эффект реакции между стенками емкостей и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля.
Покрытия, как метод защиты металлов от коррозии.
Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним из следующих способов: покрытием металла поверхностными пассивирующими пленками из его трудно растворимых соединений (окислы, фосфаты, сульфаты, вольфраматы или их комбинации), созданием защитных слоев из смазок, битумов, красок, эмалей и т.п. и нанесением покрытий из других металлов, более стойких в данных конкретных условиях, чем защищаемый металл (лужение, цинкование, меднение, никелирование, хромирование, свинцование, родирование и т.д.).
Защитное действие большинства поверхностных пленок можно отнести за счет вызванной ими механической изоляции металла от окружающей среды. По теории локальных элементов, их эффект следует рассматривать как результат увеличения электрического сопротивления (рис. 8).
Рис. 7. Коррозионная диаграмма, показывающая, что уменьшение скорости коррозии при нанесении поверхностных защитных слоёв может быть объяснено как увеличением омического сопротивления (а), так и повышением частных коррозионных реакций (б).
Повышение устойчивости железных и стальных изделий при покрытии их поверхности осадками других металлов обусловлено и механической изоляцией поверхности, и изменением ее электрохимических свойств. При этом может наблюдаться или смещение обратимого потенциала анодной реакции в сторону более положительных значений (покрытия медью, никелем, родием), или увеличение поляризации катодной реакции – повышение водородного перенапряжения (цинк, олово, свинец). Как следует из диаграмм (рис.8), все эти изменения уменьшают скорость коррозии.
Обработку поверхности металлов применяют для предохранения машин, оборудования, аппаратов и предметов домашнего обихода при временной защите в условиях транспортировки, хранения и консервации (смазка, пассивирующие пленки) и для более длительной защиты при их эксплуатации (лаки, краски, эмали, металлические покрытия). Общим недостатком этих металлов является то, что при удалении (например, вследствие износа или повреждения) поверхностного слоя скорость коррозии на поврежденном месте резко возрастает, а повторное нанесение защитного покрытия не всегда бывает возможно.
В этом отношении легирование является значительно более эффективным (хотя и более дорогим) методом повышения коррозионной стойкости металлов. Примером повышения коррозийной стойкости металла легированием являются сплавы меди с золотом. Для надежной защиты меди необходимо добавлять к ней значительное количество золота (не менее 52,2 ат.%). Атомы золота механически защищают атомы меди от их взаимодействия с окружающей средой. Несравненно меньше количество легирующих компонентов требуется для повышения устойчивости металла, если эти компоненты способны образовывать с кислородом защитные пассивирующие пленки. Так, введение хрома в количестве нескольких процентов резко увеличивает коррозионную стойкость сталей. Теоретический и практический интерес представляет повышение коррозионной стойкости легированием катодными добавками (Томашов). Для выяснения принципов, на которых основан этот метод, можно, следуя Колотыркину, рассмотреть потенциостатические кривые. В отсутствие внешнего поляризующего тока металл находится при стационарном потенциале 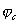
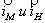
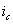
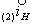
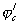
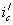
Рис. 8. Поляризационная диаграмма, показывающая возможность защиты пассивирующегося металла от коррозии при увеличении скорости катодного процесса.
Ингибиторы.
Скорость коррозии можно снизить также изменением свойств коррозионной среды. Это достигается или соответствующей обработкой среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок специальных веществ, так называемых замедлителей или ингибиторов коррозии.
Обработка среды включает в себя все способы, уменьшающие концентрацию ее компонентов, особенно опасных в коррозионном отношении. Так, например, в нейтральных солевых средах и пресной воде одним из самых агрессивных компонентов является кислород. Его удаляют деаэрацией (кипячение, дистилляция, барботаж инертного газа) или смазывают при помощи соответствующих реагентов (сульфиты, гидразин и т.п.). Уменьшение концентрации кислорода должно почти линейно снижать предельный ток его восстановления, а следовательно, и скорость коррозии металла. Агрессивность среды уменьшается также при ее подщелачивании, снижение общего содержания солей и замене более агрессивных ионов менее агрессивными. При противокоррозионной подготовке воды для уменьшения накипеобразования широко применяется ее очистка ионнообменными смолами.
Ингибиторы коррозии разделяют, в зависимости от условий их применения, на жидкофазные и парофазные или летучие. Жидкофазные ингибиторы делят в свою очередь на ингибиторы коррозии в нейтральных, щелочных и кислых средах. В качестве ингибиторов для нейтральных растворов чаще всего применяются неорганические вещества анионного типа. Их тормозящее действие связано, по-видимому, или с окислением поверхности металла (нитриты, хроматы), или с образованием пленки труднорастворимого соединения между металлом, данным анионом и, возможно, кислородом (фосфаты, гидрофосфаты). Исключение представляют в этом отношении соли бензойной кислоты, ингибирующий эффект которых связан, главным образом, с адсорбционными явлениями. Все ингибиторы для нейтральных сред тормозят преимущественно анодную реакцию, смещая стационарный потенциал в положительную сторону. До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. Некоторым тормозящим действием обладают лишь высокомолекулярные соединения.
В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород в виде амино-, имино-, тиогрупп, а также в виде карбоксильных, карбонильных и некоторых других групп. Согласно наиболее распространенному мнению, действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл – кислота. В результате адсорбции ингибиторов наблюдается торможение катодного и анодного процессов, снижающие скорость коррозии.
В связи с преобладающим адсорбционным эффектом органических ингибиторов кислотной коррозии особое значение для понимания механизма их действия и для рационального подхода к созданию новых ингибиторов приобретает величина заряда поверхности корродирующего металла, т.е. величина его 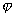
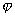
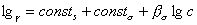
где 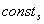
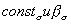
Адсорбция, однако, является лишь необходимым условием проявления ингибирующего действия органических веществ, но не определяет полностью фактического эффекта ингибиторов. Последний зависит также от многих других факторов – электрохимических особенностей протекания данного коррозионного процесса, характера катодной реакции, величины и природы перенапряжения водорода (при коррозии с водородной деполяризацией), возможных химических превращений ингибитора в ходе коррозии и т.д.
Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно – активных анионов: галогенидов, сульфидов и роданидов.
Ингибирование – сложный способ защиты, и его успешное применение в различных условиях требует широких познаний.
[1] От латинского corrodere-разъедать.