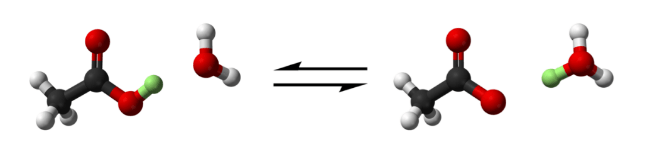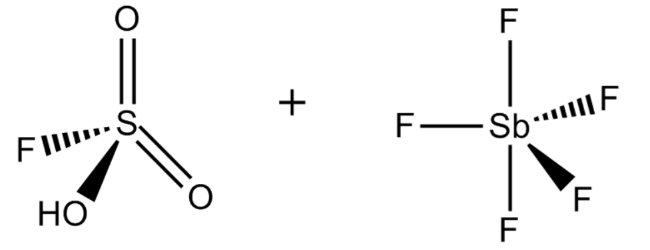какие кислоты ты знаешь
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
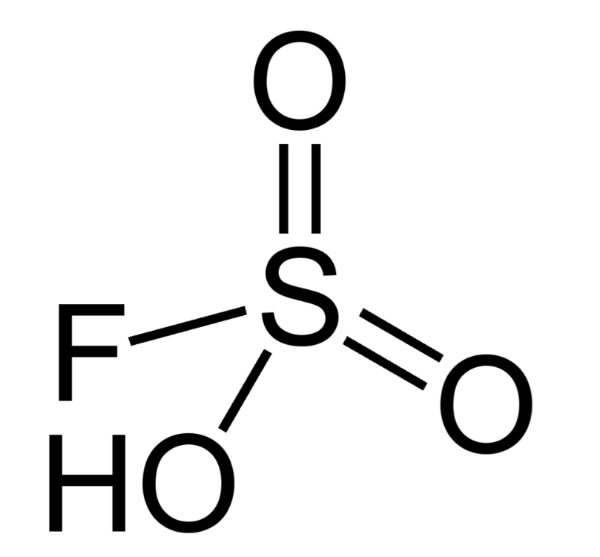
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Урок 23. Понятие о кислотах
В уроке 23 «Понятие о кислотах» из курса «Химия для чайников» познакомимся со сложными веществами — кислотами; узнаем об индикаторах и как они помогают человеку.
В тексте нашего учебника вам уже неоднократно встречалось слово «кислота». Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторы автомашин заливают серную кислоту и т. д. Отметим, что и в быту, и в производственной деятельности людей используются в основном водные растворы кислот. Познакомимся поближе с этими веществами.
Состав кислот
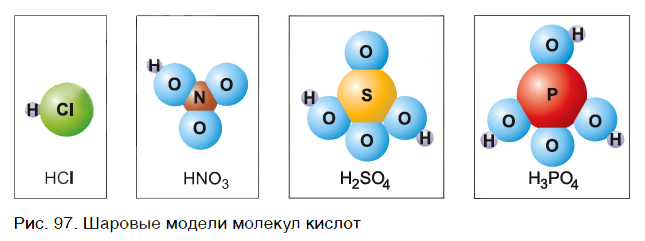
В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4.
Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками.
Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем.
При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки.
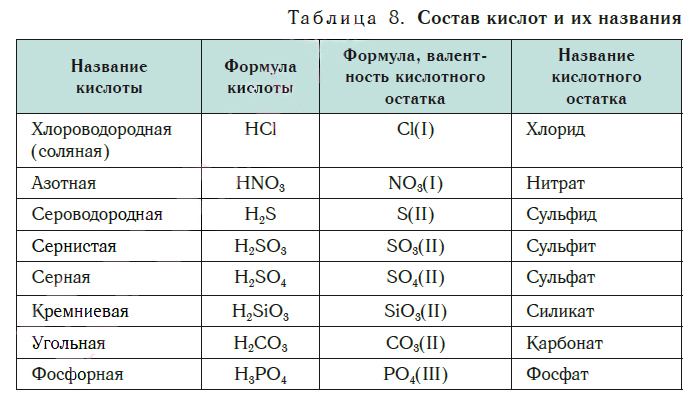
В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы.
Меры предосторожности при работе с кислотами
Кислоты — едкие вещества. Попадание кислот на кожу или в глаза может привести к болезненным химическим ожогам. Обращаться с кислотами нужно очень осторожно. При работе с ними следует надевать специальные халаты, перчатки, очки. При попадании кислоты на кожу или в глаза ее необ ходимо немедленно смыть большим количеством воды, а затем пораженный участок промыть раствором питьевой соды. В случае необходимости следует обратиться в медпункт.
Понятие об индикаторах
Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель».
Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др.
Краткие выводы урока:
Надеюсь урок 23 «Понятие о кислотах» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.