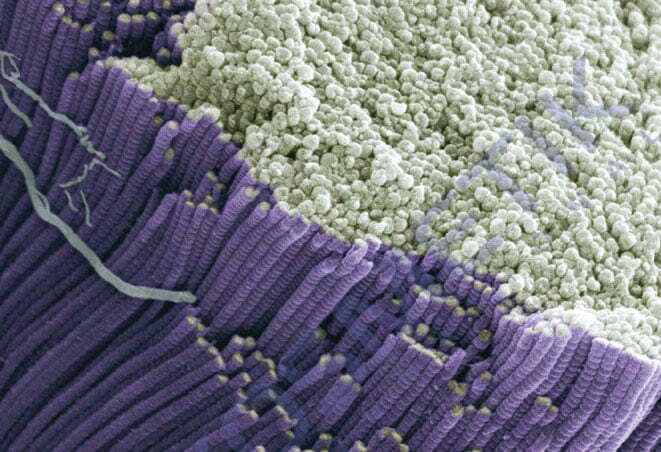
какие клетки кожи синтезируют эластин
Какие клетки кожи синтезируют эластин
• Основная функция эластина состоит в обеспечении эластических свойств тканей
• Мономеры эластина (известные как тропоэластиновые субъединицы) организованы в волокна, настолько прочные и устойчивые, что функционируют в течение всей жизни организмов
• Прочность этих волокон обусловлена образованием ковалентных сшивок между боковыми цепями лизина, находящегося в соседних мономерах эластина
• Эластичность волокон связана с наличием гидрофобных областей, которые при приложении силы растягиваются, а при снятии нагрузки спонтанно сокращаются
• Сборка волокон тропоэластина происходит во внеклеточном пространстве и находится под контролем трехступенчатого процесса
• Мутации в гене эластина являются причиной развития разнообразных патологических состояний, начиная от образования морщин на коже и заканчивая ранней детской смертностью
Как следует из названия, эластин представляет собой белок внеклеточного матрикса, главным образом, обеспечивающий эластические свойства тканей. Благодаря эластину, ткань может растягиваться и возвращаться к исходному размеру, дополнительно не расходуя энергию. Эластина особенного много в таких тканях, как кровеносные сосуды, кожа и легкие, где эластичность является критическим фактором, обеспечивающим правильное функционирование органа.
Например, эластичность кровеносных сосудов играет важную роль в поддержании надлежащего уровня кровяного давления, а эластичность легких с каждым вдохом обеспечивает их заполнение воздухом и последующее опорожнение.
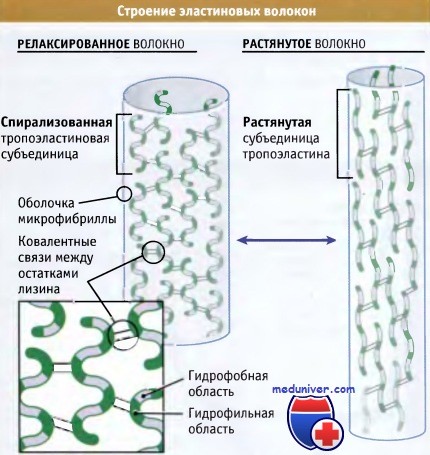
Отметьте выраженные различия в структуре эластиновых субъединиц в каждом случае.
Детали строения субъединиц пока неизвестны.
Эластин синтезируется и секретируется фибробластами, представляющими собой один из наиболее распространенных типов клеток у животных, а также клетками гладкой мускулатуры. Эти клетки также секретируют коллагены, которые противостоят растяжению. В результате внеклеточный матрикс каждого органа характеризуется комбинацией свойств эластичности и прочности. Изменяя соотношение эластина и коллагена во внеклеточном матриксе, клетки могут регулировать эластические свойства органов.
Как следует из рисунка ниже, эластин организован в волокна, которые состоят из основной области эластиновых белков, окруженной оболочкой микрофибриллярных белков диаметром 10-12 нм. Основным компонентом этой оболочки является гликопротеин, связанный с микрофибриллами, который ассоциирован с мономером эластина и способствует его включению в более крупные эластиновые волокна. Эти волокна настолько прочны и стабильны, что функционируют на протяжении всей жизни организмов (т. е. не деградируя и не замещаясь). Присутствующий в этих волокнах эластин является наименее растворимым белком позвоночных.
Каким образом, эластин, обладая высокой прочностью и стабильностью, тем не менее, проявляет высокую эластичность? Ответ лежит в особенностях его структуры. Ген эластина содержит 36 экзонов, которые кодируют две совершенно разных последовательности аминокислот: некоторые из них проявляют гидрофильные свойства и содержат много остатков лизина, в то время, как другие обогащены гидрофобными аминокислотами, особенно глицином, пролином, аланином и валином.
Гидрофобные последовательности вкраплены среди гидрофильных областей, что обусловливает существование большого по размеру белка, обладающего двумя различными свойствами. Прочность эластиновых волокон, в основном определяется ковалентными связями, возникающими между боковыми цепями лизина в примыкающих друг к другу белках, подобно тому как это имеет место в коллагене. Наоборот, гидрофобные области обеспечивают эластичность за счет сворачивания молекулы в спираль в нерастянутом состоянии, и ее растяжения при приложении силы. При снятии напряжения эти области снова спонтанно сворачиваются. Даже после многолетних исследований биологи не пришли к заключению о точной конформации эластиновых белков в волокнах.
Сборка таких нерастворимых белков ставит перед клеткой особые проблемы. Если эти белки, до момента их секреции из клетки, спонтанно агрегируют, они могут повлиять на секрецию других белков, «закупоривая» секреторные пути, а также вызывать разрыв органелл или плазматической мембраны. Клетки синтезируют и секретируют эластиновые белки в виде мономеров, однако собирают волокна только во внеклеточном пространстве, после того как белки вышли из клетки, не нарушив ее внутреннюю среду.
Как иллюстрирует рисунок ниже, образование эластина включает три основных этапа:
• Вскоре после образования эластиновых мономеров (известных под названием тропоэластина) они связываются в ЭПР с белком-шапероном мол. массы 67 кДа. В течение всего процесса секреции этот шаперон остается связанным с тропоэластином и предотвращает агрегацию эластина в клетке.
• После завершения секреции комплекс с помощью шаперона удерживается на поверхности клетки до тех пор, пока он не вступит в контакт с оболочкой эластинового волокна. После этого вновь секрети-рованный тропоэластин встраивается в эластиновое волокно с участием сахарных компонентов его оболочки, которые замещают шапероны.
• Большая часть боковых цепей лизина, присутствующего в мономере тропоэластина, дезаминируется при действии фермента лизилоксидазы. При этом образуются аллизины, которые ковалентно связываются с аллизинами или немодифицированными лизинами, присутствующими в других эластиновых белках волокна. Название зрелый эластин используют для обозначения эластиновых белков, которые были модифицированы лизилоксидазой и образовали полимер.
Таким образом, трехэтапный метод обеспечивает полную сборку эластина только в тех местах клетки, где это является необходимым.
Как можно ожидать, изменения, наступающие в процессе сборки или функционировании эластина и эластиновых волокон, могут иметь серьезные последствия для клетки. Дряблость кожи, заболевание, которое выражается в утрате эластиновых волокон в коже и соединительной ткани, по тяжести проявления может варьировать от незначительного разрушения волокон и возникновения морщин до практически полной утраты волокон. У больных, в клетках которых мало эластиновых волокон или они вообще отсутствуют, не поддерживается целостность тканей, и они умирают в раннем детстве.
У больных с синдромом Вильямса образуются укороченные формы эластина, в которых отсутствуют некоторые домены связывания, и нарушен процесс организации в волокна. У этих больных развивается сильное сужение крупных артерий, по-видимому, обусловленное аномальным ростом вокруг артерий клеток гладкой мускулатуры. Это служит компенсаторной реакцией в ответ на утрату эластиновых волокон, обычно присутствующих в стенке артерий.
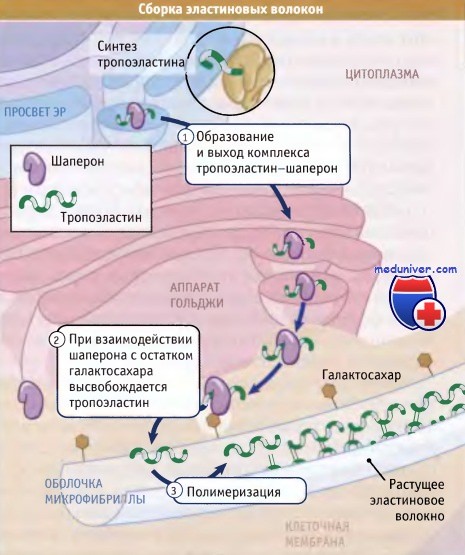
Связывание шаперонов с оболочкой микроволокна приводит к высвобождению мономеров эластина.
Полимеризация катализируется поперечными сшивками тропоэластинов, которые образуются при действии лизилоксидазы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эластин и эластокины
В организме человека присутствует два вида белков: коллаген и эластин, которые отвечают за целостность, структуру и динамическое движение всех тканей. В данной статье обсудим именно эластин, его формирование и роль в организме.
Образование эластина происходит в межклеточном матриксе в несколько этапов.
Данный процесс называется эластогенез. Сначала формируются мономерные молекулы тропоэластина, далее они подвергаются продольной сшивке лизилоксидазой (LOX). При связывании с фибулином, молекулы тропоэластина образовывают водонерастворимый клубок. Процесс связывания десятков таких аморфных клубков приводит к образованию волокон полимерных молекул эластина, в которых хаотичным образом создаются поперечные сшивки лизин-пролина и лизин-аланина, благодаря которым волокна зрелого эластина легко подвергаются растяжению, а затем способны быстро принимать прежнюю форму.
Активный синтез эластина у млекопитающих происходит в период формирования плода в утробе матери, с рождением синтез эластина начинает постепенно замедляться и к 50 годам полностью прекращает свою активность. Локальная активация синтеза эластина обнаружена при повреждении соединительной ткани или кожи, а также при патологиях, например, при онкологии. Важнейшую роль в синтезе эластина играют цитокины, которые способоны, как активировать, так и подавлять данный процесс. Доказано, что стимулирующее воздействие на формирование эластина оказывают факторы: TGFβ1 и IGF-I. Одновременно им противодействуют bFGF/FGF-2, HBEGF,EGF, PDGF-BB, TGFα, TNF-α и IL-1β факторы.
Говоря о деградации волокон эластина, данный процесс осуществляется под действием трех ферментов эластазы:
При этом в случае повреждения глубокой дермы происходит стимуляция синтеза эластаза ММР-12, который при нормальных условия производится макрофагами.
Огромное влияние на состояние и изменение внеклеточного матрикса оказывает ультрафиолет. Было выявлено, что УФ-излучение снижает содержание гомолога 1 лизилоксидазы (LOXL1) и активирует элафин. Как результат, накапливается нефункциональный эластин, который представляет собой агрегаты с элафином, при этом количество полноценных фибрилл значительно снижается. Кроме этого, с возрастом активируется эластаза неприлизин, производимый фибробластами. Он разрушает волокна эластина, которые уже ранее пострадали от эластаз ММР-7,9 и 12, что в итоге приводит к упадку эластиновых структур и общему ухудшению показателей кожи: упругости и эластичности.
Эластокины
Информация о способности фибрилл эластина взаимодействовать с клетками, дала возможность определить рецепторы эластина. Было установлено, что контакт производится через белок-медиатор эластонектин. Формирование эластонектина стимулируется фрагментами волокон эластина.
Главным рецептором для VGVAPG и других пептидов эластина является белок ЕВР.
Выявлено, что продолжительная активация данного белка приводит, например, к утолщению сосудистой ткани и пролиферации мускольной ткани.
У белка ЕВР отсутствует ферментативная функция, но он обладает двумя функциональными областями:
Среди ученых есть предположение, что до сих пор не выявлены все белки, с которыми происходит контакт эластокинов. При некоторых видах онкологии связывание VGVAPG с рецепторами коррелируется с активностью протеинкиназы С, но пока эмпирически выявлено этого не было. Также на сегодняшний день нет данных о «странствующих» рецепторах эластина, несмотря на то, что фрагменты эластины были найдены в кровотоке и эластин может влиять на эндотелий.
В заключении необходимо добавить, что сегодня эластин является крайне популярным объектом для изучения. Уже сейчас были выделены эластиноподобные полипептиды (ЭПП), которые по своим характеристикам не устапают естественному эластину. Однако, для выведения их в повсеместное использование они должны зарекомендовать себя, как безопасные и не вызывающие воспалительные реакции субстанции.
Аминокислотно-заместительная терапия. Кому. Когда. Зачем.
Что такое коллаген
Кожа, как известно, состоит из нескольких слоев: эпидермиса, дермы и подкожно-жировой клетчатки.
Основной компонент дермы – это коллаген, органическое соединение из группы фибриллярных белков. Сосочковый слой дермы образован более мелкими пучками волокон коллагена, в нем преобладает большое количество клеток (фибробласты, фиброциты, тучные клетки, Т-лимфоциты), в то время как сетчатый слой характеризуется более крупными пучками, формирующими характерную сеть, обеспечивающую прочность кожи, отсюда и название слоя – сетчатый.
Синтез коллагена
Фибробласты – основные клетки дермы, которые производят как коллаген, так и другие белки и некоторые энзимы. В разные периоды жизни человека дерма претерпевает изменения. Так, в юном возрасте она характеризуется высокой активностью фибробластов и состоит из небольших ярко-красных пучков коллагеновых волокон. С возрастом активность фибробластов снижается, уменьшается их количество, пучки коллагеновых волокон утолщаются и приобретают бледно-розовую окраску.
Молекула коллагена состоит из трех полипептидных цепей, скрученных в виде правой тройной спирали и состоящих из аминокислотных остатков (как правило, это остатки глицина, пролина и лизина). Трёхспиральная структура коллагена придает молекуле прочность.
На одном из концов молекула «сшита» поперечными связями из остатков лизина, что придает волокнам высокую степень упругости.
Особую роль в регуляции синтеза коллагена играют гормоны. Глюкокортикоиды тормозят синтез коллагена, что проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного введения этих гормонов (Zöller et al.).
На синтез коллагена влияют также половые гормоны, рецепторы к которым обнаружены в фибробластах. Синтез коллагена зависит от содержания эстрогенов, что подтверждает тот факт, что у женщин в менопаузе снижается содержание коллагена в дерме (Calleja-Agius et al.).
Основные типы коллагена в дерме
Существует 19 типов коллагена, в разных тканях преобладают разные его типы, что в свою очередь определяется той ролью, которую коллаген играет в конкретном органе или ткани.
В дерме, в основном, содержится коллаген I (сетчатый слой) и III (сосочковый слой) типов. Тип I составляет от 80 до 85 % матрикса дермы и отвечает за эластичность. Коллаген типа I является главным «союзником» старения. Как было установлено Nelson et al., в результате фотостарения содержание коллагена в коже снижается. Тип III второй по важности, составляет от 10 до 15 % матрикса. Волокна отличаются меньшим диаметром в сравнении с волокнами коллагена типа I и формируют более мелкие пучки, обеспечивая коже гибкость.
Тип IV является структурной составляющей базальной мембраны.
Тип V диффузно распространен в дерме и составляет от 4 до 5 % матрикса.
Тип VII участвует в образовании заякоренных фибриллов.
Тип XVII локализуется в гемидесмосомах, которые связывают клетки эпителия с лежащей под ними базальной мембраной.
В молодой коже преобладают волокна коллагена типов I (80 %) и III (15 %), что составляет 6:1. С возрастом происходит уменьшение содержания коллагена типа I, что ведет к утолщению и нарушению связей между волокнами.
Коллаген и старение
Старение характеризуется такими изменениями кожи, как появление морщин и потеря упругости. Это связано с уменьшением количества волокон коллагена в дерме. Поскольку коллаген является важнейшей «опорой» кожи, неудивительно, что если уровень его снижается, то кожа начинает «проседать», терять эластичность, а взамен приобретать морщины. Установлено, что каждый год происходит снижение уровня коллагена в тканях на 2 % (Fenske et al.).
Важную роль играет и гликация, процесс, в ходе которого лишняя молекула сахара (глюкоза) присоединяется к белковой молекуле (в частности, к молекуле коллагена), как бы склеивая ее. «Склеенные» волокна коллагена теряют способность к сокращению, что затрудняет их способность к регенерации и снижает упругость.
Как мы можем контролировать процессы синтеза и распада коллагена?
В настоящее время эстетическая медицина может предложить современные и эффективные методики созданию пула веществ для наиболее эффективного и контролируемого синтеза коллагена. В первую очередь это аминокислотно-заместительная терапия (АЗТ) и PRP-терапия (плазмотерапия).
Аминокислотно-заместительная терапия
АЗТ представляет собой инъекционное введение аминокислот (глицин, L-пролин, L-лизин моногидрохлорид, L-лейцин), которые ответственны за выработку коллагена.
Недавнее исследование Avantaggiato et al. показало, что совместное инъекционное введение ацетилцистеина и аминокислот привело к улучшению внешнего вида кожи, замедлило ее старение и обезвоживание.
На российском рынке хорошо зарекомендовал себя препарат JALUPRO® (Италия).
Практические аспекты использования AЗТ мы выяснили у Дианы Юдиной, доктора-косметолога, которая давно и очень успешно использует аминокислотно-заместительную терапию в своих комплексных программах.
Каким пациентам Вы назначаете АЗТ? Почему?
В первую очередь применение АЗТ показано при:
На сегодняшний день известно о множестве механизмов старения кожного покрова. Большинство из них связаны со снижением функциональной активности фибробластов: с возрастом замедляется продукция и обновление компонентов межклеточного матрикса (коллагена, эластина, фибронектина, гликозамингликанов, протеогликанов), ухудшается его организация и заживление ран.
По данным последних исследований, особенность первичной структуры α-цепей коллагена заключается в том, что 33,7 % всех аминокислотных остатков в молекуле коллагена приходится на глицин, 13,3 % – на пролин, 9,7 % – на гидроксипролин, 11,6 % – на аланин. В полипептидной цепи коллагена доминируют характерные триплеты гли-X-Y, где в положении «X» и «Y» могут быть любые аминокислоты, но чаще в положении «X» находится пролин, а в положении «Y» – гидроксипролин или гидроксилизин.
Клинически доказано, что АЗТ обеспечивает хемотаксис и деление фибробластов, имеет синергический эффект, усиливая функциональную активность кератиноцитов и фибробластов, оптимизирует процессы рубцевания, сокращает реабилитационный период (до 40 %) после эстетических процедур, увеличивает толщину и эластичность, снижает рельефность кожи.
Может ли АЗТ стать заменой классической биоревитализации?
С моей точки зрения, эти две процедуры дополняют друг друга, классическая ревитализация обеспечивает максимальную среду для функциональной активности фибробластов, для их синтеза, хемотаксиса, миграции и пролиферации.
АЗТ стимулирует неоколлагенез, усиливает активность кератиноцитов, процессы метаболизма, восстанавливает структуру коллагена.
PRP-терапия
Плазмолифтинг™ – методика, которую разработали отечественные ученые Ренат Ахмеров и Роман Зарудий. Во всем мире метод известен, как PRP-терапия (platelet rich plasma) или плазмотерапия, и основан он на использовании плазмы крови пациента.
Богатая тромбоцитами плазма вводится в проблемные зоны и активизирует механизм обновления клеток.
После введения плазмы фибробласты начинают синтезировать коллаген, эластин и гиалуроновую кислоту, за счет чего улучшается состояние и внешний вид кожи. Для получения плазмы осуществляется забор крови у пациента в специальную пробирку. Затем кровь очищается и помещается в центрифугу, где разделяется на три фракции, из которых выбирается наиболее обогащенная активированными тромбоцитами плазма. Вся процедура занимает около часа и требует лишь местного обезболивания (при необходимости).
Основным преимуществом плазмотерапии является безопасность и патогенетическая обоснованность метода.
Показания к терапии:
Мы задали несколько вопросов ведущему специалисту по аутологичной плазме Олесе Алексеевне Чирковой.
Может ли PRP-терапия считаться аминокислотно-заместительной в полной мере?
Вопрос невероятно сложный, потому как имеет не один ракурс рассмотрения. Если диагноз АК-недостаточности установлен, определены кислоты в дефиците, процент их дефицита и форма, то в данном случае мы можем предположить, что введение плазмы не будет являться вариантом первого выбора, а станет лишь сопутствующей терапией при введении АК в составе мезо- или фармпрепарата, так как является источником транспортных белков. Это обеспечит более рациональный подход, так как эффективность при местном введении плазмы и прочих веществ повышает их биодоступность.
Однако если мы возьмем в качестве примера обратившегося к врачу эстетической медицины среднестатистического пациента с признаками старения, но без четкого диагноза и цифр по аминокислотам, то в данном случае PRP-терапия будет самым быстрым, простым и беспроигрышным вариантом по компенсации витальных потребностей.
Какой группе пациентов однозначно нужна аминокислотно-заместительная терапия?
Учитывая данные диетологов о том, что на планете проживает до 80 % белково-дефицитных людей, то – всем. Совершенно серьезно стоит подойти к аминокислотной коррекции большинству пациентов, так как это обеспечит фундамент для последующих процедур, эффективность которых возрастет на фоне предварительной коррекции.
Краткий обзор некоторых кофакторов, участвующих в синтезе коллагена
Качественные коллагеновые волокна — одна из
основных составляющих здоровой кожи. Поэтому
большое количество косметологических методов
направлено на восстановление ее коллагенового каркаса.
Как витамины и микроэлементы могут влиять на синтез
коллагена? И почему для достижения стойкого эффекта
необходимо учитывать их количественный состав
в организме?
Ежегодно создаются новые методики и препараты для улучшения синтеза коллагена с целью профилактики инволюционных процессов в организме и уменьшения выраженности возрастных изменений.
Но за стремлением повлиять на коллагеногенез извне порой забывают о тех веществах, без достаточного количества которых в самом
организме синтез коллагена крайне затруднен. Никто не будет отрицать, что продукция этого жизненно важного белка зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов; и эту цепочку можно продолжать долго, тем более что она замкнутая. Осветить все нюансы в одной статье не представляется возможным, но сделать шаг навстречу пониманию некоторых процессов — в наших силах.
Синтез и процессинг (созревание) коллагена включает в себя несколько этапов:
Всем известно об участии магния и кальция в синтезе соединительной ткани и коллагена, но о железе, цинке, меди, витаминах С и D часто забывают. Именно эти кофакторы рассмотрим в статье.
Железо
Железодефицитная анемия в той или иной степени присутствует у 40–60 % женщин детородного возраста по всему миру [2, 26]. И это при том, что железо — один из важнейших микроэлементов, необходимых для нормального функционирования биологических систем организма. Оно требуется для осуществления функции дыхания, кроветворения, участвует в иммунобиологических и окислительно-восстановительных реакциях.
Причины дефицита железа:
Учитывая высокую распространенность дефицита железа в популяции, сложно говорить о нормальном синтезе коллагена при таких состояниях.
Цинк — единственный металл, представленный в небелковой части ферментов каждого класса, и никаким другим металлом цинк не может быть заменен. Несмотря на малую концентрацию цинка в крови, стабильные связи с макромолекулами делают его доступным для всех тканей организма, что в дальнейшем позволяет удовлетворять потребности в нем белков и ферментов, выполняющих различные биологические функции [28].
Распространенность дефицита цинка в мире не менее значительная, чем железа и витамина С, и составляет до 60% [29].
Для транспорта эритроцитами кислорода и углекислого газа абсолютно необходим цинк, и большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов — карбоангидраз. Карбоангидразы катализируют превращения углекислого газа в угольную кислоту (угольная кислота участвует в поддержании pH крови в физиологическом диапазоне (7,25–7,35). В капиллярах легких эти процессы идут в обратном направлении: угольная кислота распадается на углекислый газ и воду, и углекислый газ удаляется наружу [18].
Без нормального дыхания ни одна клетка не способна осуществлять свои функции.
В мире распространенность дефицита меди в организме, приводящего, наряду с железом, к анемии, составляет до 30%. А ведь этот микроэлемент крайне необходим для нормальной физиологии организма.
Если говорить о коже, то медь играет ключевую роль в ангиогенезе, синтезе и стабилизации белков внеклеточного матрикса [3].
В физиологически значимых концентрациях (2 мг — средняя суточная потребность) медь ускоряет заживление ран [16].
Ионы меди, которые являются кофакторами лизилоксидазы, принимают участие в последнем этапе синтеза коллагена. Медь имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене, а соответственно, и прочности коллагеновых и эластиновых фибрилл [8, 13,
15]. Недостаток меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы [12].
Компенсация дефицита этого микроэлемента, бесспорно, улучшает синтез коллагена, в том числе в коже (рис. 4) [7, 10].
Аскорбиновая кислота (витамин С)
Аскорбиновая кислота играет в организме фундаментальную роль — нет фактически ни одного физиологического процесса, в котором бы она не принимала участия.
Роль витамина С в организме
Аскорбиновая кислота в организме человека оказывает влияние на множество важнейших биологических процессов:
Распространенность дефицита витамина С в мире по разным данным составляет 20–40% [14, 15].
В последнее время много исследований посвящено аскорбиновой кислоте и ее биодоступности для кожи [9]. При недостатке витамина С в организме его нанесение на кожу не будет иметь ожидаемого эффекта, так как не сможет восполнить нутритивный дефицит. В ходе проведенных исследований выяснилось, что витамин С ускоряет заживление ран, участвует в активизации синтеза коллагена I типа (рис. 5) и снижении параметров
окислительного стресса. Никаких значимых побочных эффектов при добавлении витамина С в питание в ходе проведенных исследований выявлено не было [5, 6].
Синтез коллагена зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов, и эту цепочку можно продолжать долго, тем более что она замкнутая.
Витамин D
Распространенность дефицита витамина D в российской популяции составляет более 90% (в мире 50–60%) [19]. Этот витамин стимулирует увеличение синтеза секретируемых белков TGF-β (регулируют деление
и дифференцировку различных типов клеток, включая фибробласты и кератиноциты) и их связывание с рецепторами на мембране клеток. Поэтому при его дефиците происходит нарушение активности сигнальных каскадов TGF-β, что ухудшает заживление кожи после любой травмы (включая косметологические манипуляции). Например, во время термолифтинга часть коллагеновых волокон дермы сжимается и уменьшается в объеме. Это приводит к повышению зернистости базального слоя и при достаточном количестве витамина D создает благоприятные условия для воздействия его активных форм на экспрессию TGF-β1, который и способствует обновлению соединительной ткани [11].
Выводы
Мы кратко обсудили лишь некоторые кофакторы, участвующие в синтезе коллагена. Но даже этот незначительный пласт информации позволяет судить о зависимости синтеза коллагена от нутритивного статуса организма, чем не следует пренебрегать, решая многие эстетические задачи. Изменение синтеза
коллагена происходит постепенно и усугубляется нутритивным дефицитом [19].