какие клетки являются иммунокомпетентными
Какие клетки являются иммунокомпетентными
Иммунокомпетентные клетки (лимфоциты, макрофаги и дендритные клетки) по функциям подразделяют на эффекторные и регуляторные (табл. 10-6). Взаимодействие иммунокомпетентных клеток с другими регулируют цитокины (табл. 10-7), известные также как медиаторы иммунного ответа.
Лимфоциты выполняют основную функцию иммунной системы — высокоспецифичное распознавание чужеродных и измененных собственных Аг. В организме лимфоциты постоянно рециркулируют между зонами скопления лимфоидной ткани.
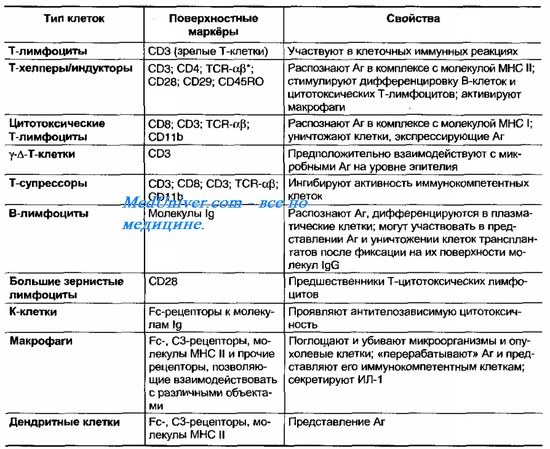
Таблица 10-6. Популяции иммунокомпетентных клеток
Распределение лимфоцитов в лимфоидных органах и их миграция по кровеносному и лимфатическому руслам упорядочены и отражают функции конкретных клеток. При изучении в световом микроскопе лимфоциты имеют одинаковую морфологию, но их функции, поверхностно-клеточные маркёры, индивидуальное (клональное) развитие и судьба различны.
Все лимфоциты происходят из единой стволовой клетки костного мозга, но популяции лимфоцитов и других клеток крови развиваются под влиянием различных дифференцирующих факторов. По наличию специфических поверхностных маркёров лимфоциты разделяют на функционально различные популяции и субпопуляции.
У млекопитающих основные популяции: Т-лимфоциты, созревающие в вилочковой железе [лат. thymus]; В-лимфоциты, созревающие в аналоге сумки [лат. bursa] Фабрициуса у птиц (у человека — костный мозг или лимфоидная ткань кишечника).
ИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ
ИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ (лат. immunis свободный, избавленный от чего-либо + competens, competent[is] подходящий, соответствующий) — клетки, способные специфически распознавать антиген и отвечать на него иммунной реакцией. Такими клетками являются T- и B-лимфоциты (тимусзависимые и костномозговые лимфоциты), которые под влиянием чужеродных антигенов (см.) дифференцируются в сенсибилизированный лимфоцит и плазматическую клетку.
Интенсивное изучение генеза и физиологии иммунокомпетентных клеток относится к 70-м гг. 20 в. Термин «иммунокомпетентная клетка» был предложен Ф. Бернетом в 1961 г. как основное понятие клональноселекционной теории иммунитета (см.). Символы T- и B-лимфоциты введены Ройттом (I. М. Roitt) в 1969 г.
Морфологически T- и B-клетки являются лимфоцитами, неразличимыми в световом микроскопе, однако в сканирующем электронном микроскопе на B-лимфоцитах выявляются микроворсинки, отсутствующие на T-лимфоцитах (рис. 1 и 2). Т- и B-лимфоциты различаются специфическими антигенами. И. к. имеют антигенраспознающие рецепторы, плотность которых на В-клетках в 100—200 раз выше, чем на Т-клетках.
На поверхности В-лимфоцитов рецепторами являются иммуноглобулиновые молекулы; природа рецепторов на Т-лимфоцитах остается недостаточно изученной. На B-лимфоцитах имеются рецепторы для Fc-фрагмента иммуноглобулинов и третьего компонента комплемента (СЗ). Небольшая часть лимфоцитов не имеет поверхностных рецепторов; эти клетки называются О-клетками. Возможно, это ранние этапы дифференцировки Т- и В-клеток из предшественников или дифференцированные, но физиологически неполноценные Т- и В-клетки.
Т- и B-клетки обладают способностью образовывать розетки (образование, в центре которого находится лимфоцит, а вокруг не менее 3—5 эритроцитов), что может служить тестом для их дифференцировки.
Суть розеткообразования состоит в присоединении к поверхности лимфоцита гетерологичных эритроцитов. До 85% Т-лимфоцитов человека дают образование спонтанных розеток с эритроцитами барана, тогда как количество РОК с эритроцитами среди B-клеток не превышает 2%. В свою очередь B-клетки образуют розетки с эритроцитами барана, к поверхности которых были присоединены комплексы антиген — антитело или антиген — антитело — комплемент.
Предшественником И. к. является мультипотентная стволовая кроветворная клетка, самоподдерживающаяся в костном мозге взрослых животных. В костном же мозге происходит первый этап ее дифференцировки в полустволовую клетку, предшественницу И. к. Выявлены субпопуляции этой клетки, дифференцирующиеся в В- или Т-лимфоциты, однако специфических Т- и B-антигенов и поверхностных рецепторов у этих клеток, по-видимому, еще нет. Полустволовые клетки, попадая в тимус, под влиянием специфического индуктора (тимозина) превращаются в Т-лимфоциты, которые мигрируют в периферические лимфоидные органы. B-лимфоциты дифференцируются в сумке Фабриция у птиц и в лимфоидном органе мле-копитающих. Предполагается, что им являются пейеровы бляшки. Популяция B-клеток поддерживается в костном мозге. Т- и B-клетки располагаются в различных участках периферических лимфоидных органов (см. Лимфоидная ткань) и постоянно циркулируют по кровеносным и лимф, сосудам. Под влиянием чужеродного антигена Т-лимфоциты дифференцируются в сенсибилизированные лимфоциты, а В-лимфоциты — в плазматические клетки (см.), которые и осуществляют специфические иммунные реакции клеточного и гуморального типа.
Для процесса дифференцировки B-клеток в антителопродуцирующие под влиянием большинства антигенов необходимо взаимодействие Т- и B-клеток при участии макрофагов, а также стромальных клеток, создающих необходимое микроокружение. При этом взаимодействии T-клетки передают В-клеткам неспецифический фактор, активирующий пролиферацию, а антиген становится более активным для индукции в клетках синтеза антител. T-клетки, участвующие во взаимодействии с B-клетками и усиливающие антителообразование, названы клетками-помощниками (хелперами), а T-клетки, вызывающие торможение антителообразования и участвующие в формировании иммунол. толерантности (см. Толерантность иммунологическая),— клетками-супрессорами. Супрессорная функция усиливается под влиянием антигена, но сама по себе неспецифична. После воздействия антигена и процесса кооперации И. к. дифференцируются в плазматические и эффекторные лимфоциты. Регуляция этого процесса также осуществляется путем взаимодействия дифференцирующихся популяций Т- и В-клеток. Часть Т- и В-клеток после контакта с антигеном и начальной активации не проходит конечной дифференцировки, а длительно сохраняется в организме. Такие Т- и B-лимфоциты названы клетками иммунологической памяти. Они обеспечивают при повторном попадании в организм антигена более быстрый, интенсивный вторичный иммунный ответ.
Среди специфически сенсибилизированных Т-лимфоцитов по их функциям различают клетки-киллеры, обладающие цитотоксическими свойствами, осуществляющие разрушение генетически чужеродных клеток, Т-клетки, активирующие большое число несенсибилизированных Т-лимфоцитов, а также Т-клетки— активаторы макрофагов, усиливающие фагоцитоз.
Интенсивно изучается вопрос о том, являются ли функциональные группы И. к. обособленными гистогенетическими субпопуляциями Т- и B-клеток или же каждая Т- и B-клетка может выполнять хотя бы часть этих функций на разных этапах своей активации и дифференцировки.
Взаимодействие Т- и В-клеток, действие на чужеродные клетки осуществляются за счет продукции активных веществ, называемых гуморальными эффекторами, или лимфокинами.
Методы выявления Т- и В-клеток дают возможность определить уровень нарушения иммунол, реакций на той или иной стадии дифференцировки Т- и В-клеток, нарушения физиол, характеристик при ряде врожденных и приобретенных иммунодефицитных заболеваний (см. Иммунологическая недостаточность).
Библиография: Бернeт Ф. М. Клеточная иммунология, пер. с англ., М., 1971, библиогр.; Петров Р. В. Иммунология и иммуногенетика, М., 1976, библиогр.; Чертков И. Л. и Фриденштейн А. Я. Клеточные основы кроветворения, М., 1977.
Д. Р. Каулен, К. А. Лебедев.
Как работает иммунитет. Основные понятия
Механизм иммунного ответа и иммунные клетки. Основные понятия.

(краткий обзорный материал)
СОДЕРЖАНИЕ:
Цитокины
«Азбука Морзе» организма
Подробнее о цитокинах см. по кнопке-ссылке:
Упомянутая выше условность классификации означает, что цитокин, входящий в одну из перечисленных групп, при определенных условиях в организме может сыграть диаметрально противоположную роль — например, из провоспалительного превратиться в противовоспалительный.
Без налаженной связи между видами войск любая хитроумная военная операция обречена на провал, поэтому клеткам иммунной системы очень важно, принимая и отдавая приказы в виде цитокинов, правильно их интерпретировать и слаженно действовать. Если цитокиновые сигналы начинают вырабатываться в очень большом количестве, то в клеточных рядах наступает паника, что может привести к повреждению собственного организма. Это называется цитокиновым штормом: в ответ на поступающие цитокиновые сигналы клетки иммунной системы начинают продуцировать всё больше и больше собственных цитокинов, которые, в свою очередь, действуют на клетки и усиливают секрецию самих себя. Формируется замкнутый круг, который приводит к разрушению окружающих клеток, а позже и соседних тканей.
Иммунные клетки
По порядку расчитайсь!
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы.
Врожденный иммунитет
Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркерам — так называемым образам патогенности [4]. Эти маркеры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с чужаками. Для нашего организма подобными маркерами могут служить фрагменты клеточной стенки и жгутиков бактерий, двухцепочечная РНК и одноцепочечная ДНК вирусов, и т.д. При помощи специальных рецепторов врожденного иммунитета, таких как TLR (Toll-like receptors, Толл-подобные рецепторы) и NLR (Nod-like receptors, Nod-подобные рецепторы), клетки взаимодействуют с образами патогенности и приступают к реализации своей защитной стратегии.
Теперь подробнее рассмотрим некоторые клетки врожденного иммунитета.
Адаптивный иммунитет
«спецподразделения вооруженных сил организма»
Видео 2. Кратковременные взаимодействия Т-клеток с дендритной клеткой ( ДК ) (обозначена зеленым ). Видео снято при помощи прижизненной двухфотонной микроскопии. →
T-лимфоциты
Видео 3. Движение Т-хелперов ( красные ) и Т-киллеров ( зеленые ) в лимфоузле. Видео снято при помощи прижизненной двухфотонной микроскопии. →
Всё вышесказанное относится к αβ-Т-лимфоцитам, однако существует еще один тип Т-клеток — γδ-T-лимфоциты (название определяет состав белковых молекул, образующих TCR) [7]. Они относительно малочисленны и в основном заселяют слизистую оболочку кишечника и другие барьерные ткани, играя важнейшую роль в регуляции состава обитающих там микробов. У γδ-T-клеток механизм распознавания антигенов отличается от αβ-Т-лимфоцитарного и не зависит от TCR [8].
B-лимфоциты
Схема иммунного ответа
Когда организм атакуют патогены, в бой в первую очередь вступают клетки врожденного иммунитета — нейтрофилы, базофилы и эозинофилы. Они выделяют вовне содержимое своих гранул, способное повредить клеточную стенку бактерий, а также, например, усилить кровоток, чтобы как можно больше клеток поспешило в очаг инфекции.
Одновременно с этим дендритная клетка, поглотившая патоген, спешит в ближайший лимфоузел, где передает информацию о нём находящимся там Т- и В-лимфоцитам. Те активируются и путешествуют до местонахождения патогена (рис. 2). Битва разгорается: Т-киллеры при контакте с зараженной клеткой убивают ее, Т-хелперы помогают макрофагам и В-лимфоцитам осуществлять их механизмы защиты. В итоге патоген гибнет, а победившие клетки отправляются на покой. Бόльшая их часть погибает, но некоторые становятся клетками памяти, которые поселяются в костном мозге и ждут, когда их помощь снова понадобится организму.
Так выглядит схема любого иммунного ответа, однако она может заметно видоизменяться в зависимости от того, какой именно патоген проник в организм. Если мы имеем дело с внеклеточными бактериями, грибами или, скажем, глистами, то основными вооруженными силами в этом случае будут эозинофилы, В-клетки, продуцирующие антитела, и Th2-лимфоциты, помогающие им в этом. Если же в организме поселились внутриклеточные бактерии, то на помощь в первую очередь спешат макрофаги, которые могут поглотить инфицированную клетку, и Th1-лимфоциты, помогающие им в этом. Ну а в случае вирусной инфекции в бой вступают NK-клетки и Т-киллеры, которые уничтожают зараженные клетки методом контактного киллинга.
Как мы видим, многообразие типов иммунный клеток и механизмов их действия неслучайно: на каждую разновидность патогена у организма припасен свой эффективный способ борьбы (рис. 3).
Рисунок 3. Основные типы патогенов и клетки, принимающие участие в их уничтожении.
А теперь все вышеописанные иммунные перипетии — в коротком видео.
Видео 5. Механизм иммунного ответа. →
Аутоиммунитет
громыхает «гражданская война».
К сожалению, ни одна война не обходится без потерь среди гражданского населения. Долгая и интенсивная защита может дорого стоить организму, если агрессивные высокоспециализированные войска выйдут из-под контроля. Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом [2]. Заболеваниями этого типа страдает около 5% человечества.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани в соответствии со своей специфичностью.
За аутоиммунные поражения организма могут быть ответственны как Т-, так и В-клетки. Первые осуществляют непосредственное убийство безвинных клеток, несущих на себе соответствующий антиген, а также помогают аутореактивным В-клеткам в продукции антител. Т-клеточный аутоиммунитет хорошо изучен при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
В-лимфоциты действуют куда более изощренно. Во-первых, аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги. Во-вторых, мишенями для антител могут стать рецепторы на поверхности клетки. При связывании такого антитела с рецептором тот может или блокироваться, или же активироваться без реального гормонального сигнала. Так происходит при болезни Грейвса : В-лимфоциты производят антитела против рецептора к ТТГ (тиреотропному гормону), мимикрируя действие гормона и, соответственно, усиливая продукцию тиреоидных гормонов. При миастении гравис антитела против рецептора к ацетилхолину блокируют его действие, что приводит к нарушению нейромышечной проводимости. В-третьих, аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность — наличие определенного варианта какого-либо гена.
Кроме того, на развитие болезни может влиять уровень экспрессии аутоантигена в тимусе. Например, продукция инсулина и, соответственно, частота презентации его антигенов Т-клеткам различается от человека к человеку. Чем она выше, тем ниже риск развития сахарного диабета первого типа, так как это позволяет удалить специфичные к инсулину Т-лимфоциты.
Заключение
Как мы уже убедились, иммунитет — это сложнейшая сеть взаимодействий как на клеточном, так и на молекулярном уровнях. Создать идеальную систему, надежно защищающую организм от атак патогенов и одновременно ни при каких условиях не повреждающую собственные органы, не смогла даже природа. Аутоиммунные заболевания — побочный эффект высокой специфичности работы системы адаптивного иммунитета, те издержки, которыми нам приходится платить за возможность успешно существовать в мире, кишащем бактериями, вирусами и другими патогенами.
Гемопоэтическая стволовая клетка
Кем быть? Как гемопоэтическая стволовая клетка «выбирает профессию «
Часть ГСК находится в состоянии покоя: такие клетки неактивны и не участвуют в клеточном цикле. Но проснувшись, гемопоэтическая стволовая клетка делает очень важный выбор. Уникальным свойством всех стволовых клеток является способность к самообновлению — так называют симметричное деление с образованием идентичных копий материнской клетки. Так гемопоэтическая стволовая клетка может практически бесконечно продлять свое детство.
* — По современным данным, гемопоэтическая стволовая клетка «взрослеет», постепенно теряя способность к самообновлению и приобретая способность к дифференцировке. А решение выбрать «рабочую специальность», то есть мегакариоцитарное и эритроцитарное направление дифференцировки, клетка принимает еще до того, как рассмотрит варианты с «учебой» и «армией» (миелоидным или лимфоидным ростками) [11].
Общие лимфоидные предшественники дают начало клеткам иммунной системы — NK-клеткам, T- и B-лимфоцитам, — которые защищают организм от вторжения. NK-клетки (большие гранулярные лимфоциты) убивают чужаков, T-лимфоциты могут распознавать эпитоп (участок антигена ) врага и организовывать наступление (T-хелперы) или атаковать самостоятельно (цитотоксические лимфоциты), а B-лимфоциты, тоже после знакомства с антигеном, могут превращаться в плазматические клетки, вырабатывать специфические антитела и поражать ими врага на расстоянии.
Каким же образом гемопоэтическая стволовая клетка решает, оставаться ей вечно юной или встать на путь дифференцировки и превратиться в зрелую клетку крови? И как она выбирает свою будущую профессию? Результаты большого количества исследований доказывают, что важную роль играет окружение гемопоэтической стволовой клетки*. В первую очередь, это различные виды клеток, формирующие гемопоэтическую нишу костного мозга.
Однако выбор профессии — непростой процесс. И огромную роль в нём, помимо внешнего воздействия, играют личные предпочтения и склонности. Как и у человека, у гемопоэтической стволовой клетки богатый и сложный внутренний мир, который представлен транскрипционными факторами. Именно их взаимодействия приводят в конечном итоге к принятию решения, кем же ей быть [17, 18].
Конечно, представление работы транскрипционных факторов в виде механических блоков — чрезвычайное упрощение. Кроме того, описанные взаимодействия — лишь малая часть огромной сети транскрипционных факторов. В настоящее время ведутся масштабные исследования, чтобы составить представление о внутренних факторах, участвующих в регуляции дифференцировки гемопоэтической стволовой клетки, и об их взаимосвязи с внешними факторами, такими как влияние других клеток и растворимых факторов. Все эти знания помогут лучше понять процессы, лежащие в основе кроветворения в норме и при различных заболеваниях, разработать подходы к лечению этих заболеваний, а также научиться управлять судьбой гемопоэтических стволовых клеток in vitro и in vivo.
Дополнительная информация:
К разделу:
Дополнительно см.:
Источник (по материалам): А. Боголюбова. Иммунитет: борьба с чужими и… своими. / Спецпроект: аутоиммунные заболевания / biomolecula 26.01.2017
Литература:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Иммунная система Часть 3 Иммунные клетки
Иммунная система Часть 3 Иммунные клетки
В костном мозге основные иммунные клетки рождаются из кроветворной стволовой клетки. Процесс называется гемопоэз – рождение клеток крови. Часть иммунных клеток известна всем как белые клетки крови – лейкоциты. Это большая группа клеток, разделяющаяся во время гемопоэза. Иммунные клетки врожденного иммунитета образовываются непосредственно в тканях и в костном мозге как из стволовых клеток, так и из клеток крови, других клеток кожи и слизистых оболочек.
Гранулоциты
Имеют такое название, поскольку содержат гранулы. Процесс выхода содержимого гранул называется дегрануляция. Вещества гранул обладают токсическим действием, являются регуляторами острого воспаления, приводя к развитию клинических симптомов (отек, зуд, спазм сосудов и т.п.). Составляют основу лейкоцитарной формулы крови.
Нейтрофилы
Эозинофилы
Базофилы
Лейкоцитарная формула (циркуляция в крови)
Во время острого воспалительного процесса нейтрофилы выходят в ткани. Их цель – фагоцитировать и разрушать антигены.
Атакуют крупные микроорганизмы, которые не могут быть поглощены. Источник регуляторов острого воспаления
Работают как тучные клетки тканей, обуславливая аллергическую воспалительную реакцию. Источник регуляторов острого воспаления
Повышаются в крови
При острых бактериальных и грибковых инфекциях; при системных воспалительных заболеваниях; при онкологии костного мозга
При аллергических заболеваниях; при паразитарных заболеваниях; при системных воспалительных заболеваниях.
При аллергических заболеваниях; при онкологических заболеваниях костного мозга
При тяжелой инфекции с развитием сепсиса; при многих вирусных инфекциях; при иммунодефиците и повреждении костного мозга.
При острых бактериальных инфекциях; при болезнях надпочечников.
При острых бактериальных инфекциях.
Тучные клетки
Ранее предполагалось, что образуются из базофилов крови, но выявлены их различия. Тучные клетки постоянно живут в тканях, как и базофилы играют ведущую роль в остром аллергическом воспалении.
Естественные клетки-киллеры
Моноциты крови как часть лейкоцитарной формулы (до 8%) коротко циркулируют в крови и в основном преобразуются в тканевые макрофаги (фагоцитирующие клетки), но от 5 до 15% моноцитов лейкоцитарной формулы на самом деле – естественные клетки-киллеры (ЕК-клетки). Они созревают в костном мозге и имеют колоссальное значение в уничтожении зараженных, отработанных и опухолевых клеток, умея распознавать их и участвуя в процессе апоптоза. Это важный компонент безопасной гибели клеток, ограничивающий выход ее содержимого. Также они являются источником некоторых молекулярных компонентов (ИФН-гамма, ИЛ-1, ФНО-альфа).
Антиген-презентирующие клетки
Не являются какой-то одной группой клеток. Скорее это способность многих клеток, обладающих фагоцитозом – процессом поглощения и переваривания антигенов. К ним относят тканевые макрофаги (образующиеся из моноцитов крови), клетки Лангерганса в коже, дендритные клетки, интердигитальные клетки, являющиеся клетками врожденного иммунитета. Для реализации приобретенного иммунитета требуется специальная обработка антигенов и представление их на поверхности клетки в связке с особыми рецепторами – презентация антигена.
Клетки, способные это делать, называют антиген-презентирующие. После поглощения антигена они устремляются в лимфатические узлы для встречи с Т-лимфоцитами. Именно для них нужна презентация антигена, чтобы информацию о нем передать В-лимфоцитам для синтеза антител. Кроме того, антиген-презентирующие клетки выделяют особые молекулы, необходимые для формирования популяций Т-лимфоцитов, определяющих направление иммунного ответа – клеточный или гуморальный.