какие коррозионные среды не проводят электрический ток
Введение в коррозию
Коррозия начинается с поверхности металла и при дальнейшем развитии процесса распространяется вглубь. Металл при этом может частично или полностью растворяться, или могут образовываться продукты коррозии в виде осадка на металле.
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций вследствие действия внешней среды.
1. К химической коррозии относятся процессы, которые протекают при непосредственном химическом взаимодействии металла и агрессивной среды и не сопровождающиеся возникновением электрического тока. Этот вид коррозии является гетерогенной химической реакцией жидкой или газообразной среды с поверхностью металла.
По химическому механизму на металлическую поверхность действуют:
а) сухие газы и пары при невозможности конденсации влаги на поверхности металла (газовая коррозия);
б) жидкие неэлектролиты, т.е. не проводящие электрический ток жидкости (спирты, минеральные масла и различные органические соединения).
Газовая коррозия обычно наблюдается при высоких температурах (окисление металлов кислородом при высокой температуре). В большинстве случаев при газовой коррозии на поверхности металлов образуется слой окислов. Механизм газовой коррозии сводится к двусторонней диффузии действующей среды и атомов металла через этот слой окислов.
2. К электрохимической коррозии, являющейся гетерогенной электрохимической реакцией, относятся коррозионные процессы, протекающие в водных растворах электролитов, влажных газах, расплавленных солях и щелочах. При электрохимической коррозии процесс растворения металла сопровождается появлением электрического тока, то есть упорядоченным передвижением электронов и ионов от одного участка метала к другому. При этом электрический ток возникает вследствие протекания процесса коррозии, а не за счет его подвода от внешнего источника.
Одно из принципиальных различий между этими двумя механизмами коррозии металлов заключается в том, что при электрохимической коррозии одновременно происходят два процесса окислительный (растворение металла на одном участке) и восстановительный (выделение катиона из раствора, восстановление кислорода и других окислителей на другом участке металла). Например, в результате растворения цинка в серной кислоте образуются ионы цинка и выделяется газообразный водород; при действии воды железо переходит в окисное или гидроокисное состояние и восстанавливается кислород с образованием гидроксильных ионов.
Электрохимическая коррозия, в зависимости от характера агрессивной среды и условий протекания, может быть: кислотная (в растворах кислот); щелочная (в растворах щелочей); солевая (в водных растворах солей); в расплавленных солях и щелочах; атмосферная (в атмосфере воздуха или любого другого газа); почвенная (под воздействием на металл почвы или фунта), коррозия внешним током или электрокоррозия (под влиянием тока от внешнего источника); контактная (вызываемая контактом двух разнородных металлов, имеющих различные потенциалы).
При этих условиях возможные также следующие виды коррозии:
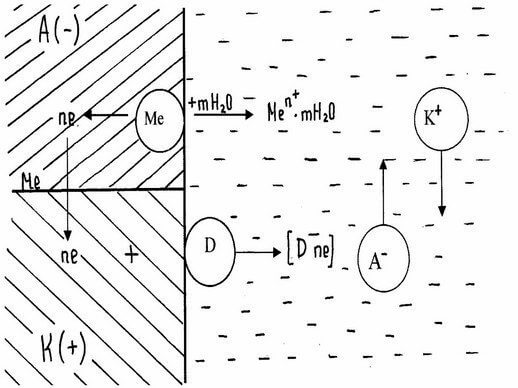
Рассмотрим явление, которое наблюдается на границе металл – электролит. Эти явление вытекают из способности металла переходить из металлического состояния в ионное и гидратации ионов в водном растворе. Когда ионы металлов переходят в раствор (энергия гидратации ионов достаточна для разрыва связей между ион-атомами и электронами), на поверхности металла остается эквивалентное количество электронов, которые в раствор не переходят и сообщают металлу отрицательный заряд. Этот заряд вызывает электростатическое притяжение между положительно заряженными ионами метала, перешедшими в раствор, и поверхностью металла.
Схематическое изображение гидратации и перехода в раствор ионов металла (линия ab показывает поверхность метала).
Если энергия гидратации не достаточна для разрыва связи между ион-атомами и электронами, т.е. энергия связи в кристаллической решетке превышает энергию гидратации, то на поверхности металла могут разряжаться катионы из раствора. Поверхность металла при этом приобретает положительные заряды, которые с анионами раствора также образуют двойной электрический слой (рисунок б).
Механизм электрохимической коррозии. Коррозионный процесс возникает вследствие работы множества коротко замкнутых гальванических элементов, образующихся вследствие неоднородности металла или окружающей среды. При этом одновременно протекают два электродных процесса:
Сопряженность анодной и катодной электрохимических реакций при растворении металлов, и протекание их на различных участках корродирующей поверхности, напоминает работу гальванических элементов. Принципиальная схема электрохимического растворения металлов приведена на рисунке выше. Разность потенциалов, возникающая между поверхностью металла и электролитом, называется потенциалом электрода. Причиной возникновения электродных потенциалов является перенос ионов из металла в раствор и обратно.
Процесс коррозии можно выразить с помощью химических реакций;
— анодная: Fe → Fe 2+ + 2e-,
Для образования гальванического элемента необходимо, чтобы одновременно протекали катодная и анодная реакции. В случае прекращения одной из них прекращается и развитие коррозии. Одной из причин прекращения этих реакций является переход металла в пассивное состояние из-за образования поверхностной пленки, предотвращающей окисление (анодная поляризация). С повышением окислительных свойств раствора коррозия металла достигает максимальной активности, затем активность резко снижается вплоть до почти полного прекращения коррозии.
Существует две основные теории пассивности металла. Согласно первой, пленочной теории пассивного состояния, торможение процесса растворения металла наступает вследствие образования на его поверхности фазовой пленки (защитного окисла или слоя) из кислородосодержащих соединений металлов (толщиной от 2 до 10 нм).
Согласно второй, адсорбционной теории, для пассивации достаточно образования мономолекулярного слоя или заполнение лишь части поверхности метала атомами О2 или кислородосодержащих соединений.
Возникновение пассивного состояния зависит от природы металла, его свойств, характера агрессивной среды, концентрации раствора электролита, температуры, движения раствора и целого ряда других факторов. Легко пассивирующимися металлами являются алюминий, хром, никель, титан, вольфрам, молибден, и др.
Легко пассивирующиеся металлы при легировании ими слабо пассивирующихся металлов, как, например, железа, могут передать свою склонность к пассивации этим металлам при условии образования сплавов типа твердых растворов. На этом принципе основано, в частности, получение нержавеющих сталей и чугунов при их легировании кремнием или хромом. Наступление пассивного состояния при этом имеет место при определенном содержании легко пассивирующихся элементов в сплаве, часто сравнительно небольшом.
Равномерная коррозия наблюдается в тех случаях, когда агрессивные среды не образуют защитных пленок на металле или когда сплав состоит из равномерно распределенных мелкозернистых анодных и катодных участков. Это наименее опасный вид коррозии, при условии, что скорость растворения металла не превышает норм, определяемых шкалой коррозионной стойкости.
Если коррозия вызывает разрушение только некоторых отдельных участков поверхности металла, а остальная часть поверхности не подвергается разрушению, то такой вид коррозии называют местным. Местная коррозия бывает различных типов, из которых наиболее характерны следующие:
1) коррозия пятнами, если разрушение на отдельных участках распространяется сравнительно неглубоко и занимает относительно большие участки поверхности металла;
2) язвенная коррозия, характеризуется довольно глубокими сосредоточенными поражениями металла на сравнительно ограниченных участках поверхности;
5) Избирательная коррозия известна двух видов. Если разрушается один компонент сплава, то такой вид разрушения носит название компонентно избирательной коррозии; если же в раствор переходит только одна структурная составляющая гетерогенного сплава коррозия называется структурно избирательной.
Катодные металлические покрытия, электродный потенциал которых более электроположителен, чем потенциал основного металла, могут служить надежной защитой от коррозии только при условии отсутствии в них пор, трещин и других дефектов, т.е. при условии их сплошности, так как они механически препятствуют проникновению агрессивной среды к основному металлу. Примерами катодных защитных покрытий является покрытие железа медью, никелем, хромом и другими более электроположительными металлами.
Испытания на коррозионную стойкость должны учитывать механизм коррозионного разрушения. Испытания на стойкость к МКК проводят погружением в горячую кислоту с последующим взвешиванием через фиксированные интервалы времени образцов до и после испытания. Испытания на стойкость к общей коррозии проводят потенциодинамическими методами со снятием анодных поляризационных кривых без внешней поляризации в агрессивной среде.
Испытания на коррозию регламентируются DIN 50 905: Коррозионные испытания. Рекомендации по проведению и оценке.
Электрохимическая коррозия
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
— поверхностный слой мет. рассматривается как гомогенный и однородный;
— причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
— К и А участки мигрируют по поверхности во времени;
— скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
— однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
— у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
— гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
— неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
— неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
— наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
— область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
— температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
При работе гальванического элемента одновременно протекает два электродных процесса:
Происходит реакция окисления.
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
— электрохимическая (при замедлении анодного или катодного процессов);
— концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
— фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
Химия. 11 класс
Конспект урока
Урок № 9. Коррозия металлов и её предупреждение
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению видов коррозии, особенностям химической и электрохимической коррозии, методам защиты металлических изделий от коррозионного разрушения.
Анодное покрытие – способ защиты металлического изделия от коррозии, когда защищаемый металл покрывается металлическим покрытием из более активного металла.
Газовая коррозия – разрушение металла в среде агрессивных газов (кислорода, оксида серы, хлороводорода) обычно при высоких температурах.
Гальванокоррозия – вид электрохимической коррозии, при которой два контактирующих металла в среде электролита образуют коррозионный гальванический элемент с возникновением электрического тока между металлами.
Жидкостная коррозия – разрушение металла в жидкостях, не проводящих электрический ток (органические растворители, нефтепродукты).
Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
Катодная защита – способ защиты металла от коррозии, когда защищаемое металлическое изделие подсоединяется к отрицательному полюсу внешнего источника электрического тока.
Катодное покрытие – способ защиты металла от коррозии, когда металлическое изделие покрывается тонким слоем из менее активного металла.
Коррозия – разрушение металла в результате окислительно-восстановительных реакций между металлом и окружающей средой
Осушение – удаление из окружающей среды влаги для предотвращения возникновения коррозии.
Протекторная защита – способ защиты металла от коррозии, когда к защищаемому металлическому изделию присоединяют кусок другого, более активного металла.
Химическая коррозия – разрушение металла в среде, не проводящей электрический ток.
Электрокоррозия – вид электрохимической коррозии, возникающей в среде электролита под действием внешнего электрического поля.
Электрохимическая коррозия – разрушение металла в среде электролита при контакте двух металлов с образованием коррозионного элемента и возникновением электрического тока.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Коррозия и её виды
Коррозия металлов – процесс разрушения металлического изделия в результате окислительно-восстановительной реакции металла с окружающей средой. В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток. К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах. Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
Электрохимическая коррозия происходит в среде электролитов, которые хорошо проводят электрический ток. Различают два вида электрохимической коррозии: гальванокоррозия и электрокоррозия. Гальванокоррозия возникает в месте контакта двух металлов, наличия в металле примесей, разной температуры на соседних участках металлов, разной концентрации электролитов в среде, контактирующей с металлом и в случае разной концентрации кислорода на соседних участках металла. Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
4Fe(ОН)2↓ + 2Н2О + О2 → 4Fe(ОН)3↓, Fe(OH)3 + nH2O → Fe2O3·xH2O (ржавчина).
Если в атмосфере присутствует большое количество кислых газов (СО2, SO2, NO2), то при растворении их в воде образуются кислоты. В кислой среде коррозия идет ещё интенсивнее. В присутствии кислорода на катоде образуется вода, а в бескислородной среде выделяется водород.
На аноде: Fe0 – 2е → Fe2+;
На катоде: О2 + 4Н+ + 4е → 2Н2О
или в бескислородной среде: 2Н+ + 2е → Н20↑.
Ионы железа образуют соли с кислотными остатками образовавшихся при растворении газов кислот. В дальнейшем под действием кислорода воздуха, соли двухвалентного железа окисляются до солей трёхвалентного железа.
Электрокоррозия возникает под действием на металл электрического тока от внешнего источника постоянного тока. Часто она происходит под действием блуждающих токов от рельсов электротранспорта, от плохо изолированных опор линий электропередач. Участок, на который попадает ток от внешнего источника, заряжается отрицательно и становится катодом. На нём происходит восстановление элементов среды. А соседний участок становится анодом, на нём металл окисляется.
Факторы, увеличивающие скорость коррозии
Возникновение коррозионного гальванического элемента увеличивает скорость коррозии. При контакте двух металлов более активный металл отдает электроны менее активному. Возникает электрический ток. Активный металл растворяется и в результате реакции со средой, и за счет передачи электронов менее активному металлу. Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом. Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде. В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Методы защиты металлов от коррозии
Одним из распространённых методов защиты металлов от коррозии является нанесение защитных покрытий. Покрытия бывают металлическими и неметаллическими. Если металлическое изделие покрыто слоем более активного металла, покрытие называют анодным. Если покрытие изготовлено из менее активного металла, оно называется катодным. Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин. Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото. Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться. Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Эффективным, но дорогим методом защиты металлов от коррозии является введение в сплав антикоррозионных легирующих добавок: хрома, никеля, молибдена, титана. Для повышения стойкости к коррозии в кислой среде в сплав добавляют кремний.
К методам электрохимической защиты относятся протекторная и катодная защита. Протекторная защита предусматривает закрепление на защищаемом изделии пластин из активного металла: цинка, алюминия, магния. Попадая в агрессивную среду, протектор становится анодом, начинает разрушаться, а металлическое изделие, являясь катодом, не разрушается до полного разрушения протектора. Катодная защита производится путём подсоединения защищаемого металлического изделия к отрицательному полюсу внешнего источника постоянного электрического тока. В результате защищаемый металл приобретает отрицательный заряд и становится катодом. В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
Важным направлением предотвращения коррозии металлов является снижение агрессивности окружающей среды. Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
Предотвращение потерь металла от коррозии позволит не только сберечь тонны металла, но и предотвратить аварии на производстве и транспорте, сберечь человеческие жизни.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчёт массы металла, предохраняемого от разрушения за счёт нанесения защитных покрытий
Условие задачи: В результате атмосферной коррозии толщина стального изделия уменьшается на 0,12 мм/год. Потерю какой массы стального изделия плотностью 7750 кг/м 3 и площадью 10 м 2 можно предотвратить путем нанесения лакокрасочного покрытия, которое сохраняет свои защитные свойства в течение 4 лет? Ответ запишите в виде целого числа в килограммах.
Шаг первый: необходимо перевести скорость коррозии из мм/год в м/год.
Шаг второй: Найдём объём слоя металла, который может быть разрушен коррозией за 1 год. Для этого толщину слоя разрушенного в течение года металла умножим на площадь стального изделия:
Шаг третий: Найдём массу вычисленного объёма металла.
Для этого объём металла умножим на его плотность:
Шаг четвёртый: Найдём массу металла, которая могла бы разрушиться за 4 года. Для этого массу сохранённого за год металла умножим за 4 года:
9,3·4 = 37,2 (кг). Округляем до целого числа, получаем 37 (кг).
2. Расчёт массы металла, разрушенного в результате коррозии
Условие задачи: Через железную решётку, предохраняющую от попадания в канализацию крупного мусора, проходит 20 м 3 воды в сутки. Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
Шаг первый: найдём объём кислорода, который содержится в 20 м 3 воды.
Для этого разделим 20 м 3 на 100:
20 : 100 = 0,2 (м 3 /сутки) = 200 (л/сутки)
Шаг второй: Найдём объём кислорода, который проходит в воде через решётку в течение 6 месяцев.
Для этого объём кислорода, проходящий через решетку в сутки, умножим на 30 дней и на 6 месяцев:
Шаг третий: Найдём объём кислорода, который расходуется на окисление железа. Для этого умножим найденный объём кислорода на 60 и разделим на 100:
(36000·60) : 100 = 21600 (л).
Шаг четвёртый: Запишем уравнение реакции взаимодействия железа с кислородом в нейтральной среде:
Шаг пятый: Найдём массу железа, окисленного 21600 л кислорода.
Для этого составим пропорцию с учётом того, что масса 1 моль железа равна 56 г/моль, а 1 моль газа в нормальных условиях занимает 22,4 л.
2·56 г железа реагирует с 22,4 л кислорода;
х г железа реагирует с 21600 л кислорода.
х = (2·56·21600) : 22,4 = 108000 (г) = 108 кг.