какие кости у кролика трубчатые или
Скелет кролика
Внутреннее строение кролика имеет много общего с другими млекопитающими, однако, имеются некоторые отличия. Знание биологических особенностей этих зверьков поможет кролиководам для успешного выращивания и получении здорового потомства, приносящего прибыль. Внешний вид у различных пород имеет свои характерные признаки, но внутренняя структура соответствует общим характеристикам.
Роль скелета в организме кролика
Скелет в организме кролика выполняет ряд важных функций:
Как соединяются кости между собой
Костью называется орган, являющийся частью скелета. В состав кости входят тканевые элементы разного характера. Кость состоит из шести компонентов. Одним из самых главных является красный костный мозг, представляющий собой орган кроветворения.
Существует несколько способов, с помощью которых осуществляется соединение между собой различных костей:
Каждый сустав обладает суставной капсулой, которая состоит из наружного и внутреннего слоев. Наружный слой срастается с надкостницей кости, а внутренний слой выделяет в полость сустава специальную жидкость, которая не дает костям сустава тереться друг об друга, что является профилактикой артроза, которому подвержены некоторые породы кроликов.
Аппарат движения животного подвергается частым заболеваниям. Этому способствует ситуация, когда массивное тело вынуждены выдерживать небольшие лапы. Наиболее часто патологические процессы возникают в местах, где находится соединение костей, например, в суставах конечностей. Такая патология, образующаяся в местах соединения костей, представляет собой такую серьезную опасность, как потеря подвижности. Это предполагает отсутствие возможности нормально передвигаться и совершать прыжки. Также возможно возникновение сильных болевых симптомов.
Скелет является основой костной системы. У грызуна он содержит кости в количестве 212. Они соединяются между собой двумя способами – как подвижным, так и неподвижным. Сочленение отдельных косточек осуществляется связками, суставами, хрящами, мускулами.
Главная функция скелета – опорная. Помимо этого он осуществляет защиту от повреждений таких внутренних органов, как сердце, мозг, легкие и многие иные. Строение косточек является типичным для других мелких животных, используемых в сельском хозяйстве. Внутри этой части скелета кролика распложен костный мозг красного цвета. Кость является организмом, в котором регулярно осуществляются разрушительные и восстановительные процессы.
Скелет кролика, который только что появился на свет, имеет вес, составляющий 15% от общей массы тела. У взрослого кролика это значение снижается и составляет приблизительно 10%. Если сравнить зверьков разных сельскохозяйственных направлений, то можно увидеть, что скелеты кроликов мясных пород имеют меньший вес.
Типы конституции кроликов
Селекционная многолетняя работа привела к созданию пород, отличающихся друг от друга анатомическим строением и конституцией. Классификация в современном кролиководстве различает четыре основных типов:
В зависимости от типа строения зверьков относят к различным направлениям – мясному, мясошкурковому, декоративному. Более грубая анатомия – кролика мясного направления, поскольку мощные кости передних и нижних конечностей должны выдерживать тяжелую нагрузку.
Части скелета
Скелет кролика подразделяется на две части – осевую и периферическую. Составные части осевого скелета: кости туловища, головы, хвоста. К составным частям периферической части относятся кости груди и тазовых конечностей.
Структура осевой части состоит из следующих компонентов:
В структуру периферической части входят следующие конечности:
Лопатки и грудные кости связываются между собой ключицами. Это позволяет кроликам совершать прыжки. Кости конечностей кроликов полые, обладают небольшой толщиной. Из-за этого кролики подвержены частым переломам ног. При неосторожных движениях могут произойти травмы позвоночника. Особенностью зверьков является возможность высоко прыгать, что обеспечивается строением его скелета.
Основа скелетной системы – позвоночный столб большой протяженности. К нему с помощью хрящей и соединительных тканей прикреплены череп, грудные кости, включающие ребра, передние и задние конечности.
Основные части скелета кролика:
Кости разных частей скелета несут неодинаковую нагрузку. Отдельной составляющей являются зубы, имеющие большой размер.
Череп кролика
Череп кролика состоит из лицевого и мозгового отделов. Мозговой отдел является, соответственно его названию, вместилищем мозга. Он состоит их трех парных и четырех непарных костей. К парным относятся лобные, височные и теменные кости. Непарные – межтеменная, клиновидная, решетчатая.
Лицевой отдел является сильно развитым и составляет ¾ от общего количества костей черепа. Он является основой для носовой полости, содержащей дыхательную систему, и для ротовой полости, в которой расположены отдельные органы пищеварительной системы.
Лицевой отдел также делится на парные и непарные кости. К парным относятся семь пластинчатых костей. Они носят название – носовые, небные, верхнечелюстные, скуловые, резцовые, слезные, крыловидные. Непарных костей черепа всего две – подъязычная и сошник. У разных пород кроликов развитие и размер отдельных частей черепа является неодинаковыми.
На рисунке можно наглядно увидеть расположение различных частей, из которых состоит череп зверька. Показан вид с левой стороны.
Разные породы имеют некоторые различия в строении черепа, прежде всего касающиеся их размеров.
Кости туловища
Хребет делится на пять частей, имеющих разное количество позвонков: грудь, шея, поясничный отдел, крестец и, наконец, хвост. В хвостовой части содержится наибольшее количество позвонков, а наименьшее – в поясничной. Это объясняется тем, что, хотя поясница имеет большую протяженность, но и позвонки у нее длинные.
Отличие периферического отдела от аналогичной области у других домашних зверьков состоит в наличии у кроликов ключиц. Их функция – соединение грудных костей и лопаток, что дает возможность совершать зверькам энергичные прыжки.
Скелет кролика содержит следующие кости туловища:
Каждый позвонок позвоночного столба имеет отверстие, через которое проходит спинной мозг. Между собой позвонки соединены хрящевыми пластинами, которые обычно называют дисками. Это обеспечивает позвоночнику необходимую зверькам гибкость.
Позвоночный столб разделяется на пять отсеков с разным количеством позвонков:
Порядка 15,7% от длины тела грызуна составляет шейный отдел. В нем имеется 7 позвонков. Своеобразное строение первых двух позвонков в области шеи дает возможность кролику свободно «крутить» головой.
Грудной отдел содержит 12-13 сегментов. В позвонке имеется тело, нервная дужка и отростки. Каждый грудной позвонок соединяется с помощью суставов с ребрами, представляющими собой дугообразные кости. Соединение образует грудную клетку, в которой находятся сердце и легкие.
Поясничный отдел – самый длинный отдел в позвоночном столбе. Он составляет 32% от всей длины тела. Поясничные позвонки в количестве 6-7 продолговатые, имеющие большие нижние гребни. Интересно, что ширина поясничных позвонков свидетельствует о мясистости зверьков, что позволяет производить по этому параметру отбор.
Крестцовый отдел является относительно коротким. В нем имеется всего четыре позвонка. Причем они все сливаются в одну общую крестцовую кость. Хвостовой отдел составляет 13% от длины позвоночного столба. В нем находится 14-16 позвонков.
В периферическом скелете находятся кости грудной части и тазовых конечностей. Грудную часть составляют: лопатка, кости плеча и предплечья, кисти. В свою очередь кисти включают в себя девять запястных и пять пястных костей, а также пять пальцев. В каждом пальце находится несколько фаланг. В первом пальце находятся две фаланги, а в остальных по три.
В тазовый пояс входят кости, которые соединены неподвижно между собой. Конечность включает в себя бедренную кость, голень и лапы.
Зубы кролика
Черта, которая выделяет семейства зайцевых, это их зубы. Они представляют собой костные образования, постоянно растущие независимо от возраста. Молочные зубы формируются еще в утробе матери. На свет они появляются, имея во рту 16 зубов, из которых 6 являются резцами. Четыре из них находятся сверху, хотя обычно их два. К месячному возрасту количество зубов достигает максимального количества – 28. Это меньше, чем у других млекопитающихся, зато каждую неделю они увеличиваются на 2-3 мм.
Все зубы кролика разделяются на резцы и коренные. Строение зубов кроликов объясняется тем, что они являются травоядными животными. Функцию срезания травы выполняют резцы, а пережевывание еды осуществляется коренными зубами. Такие физиологические особенности определяют строение черепа кролика.
Скелетно-мышечная система кролика
Мускулатура кролика имеет неплохое развитие. Ее вес составляет половину всей массы животного. Это превышает аналогичное значение, которое имеется у других домашних обитателей. Основная масса имеющейся мускулатуры кролика приходится на туловище. Мускулатура конечностей зверька не слишком большая, даже в тех местах, где они имеют непосредственное соединение с туловищем. Самая сильно развитая мускулатура находится в районе вытянутой и сильной поясницы.
Скелетные мышцы закрепляются на скелете кроликов. Они выполняют двойную функцию – осуществляют необходимые движения и способствуют укреплению скелета, находящегося в определенной позе.
Скелетные мышцы кролика имеют различие в области интенсивности окраски. В связи с этим имеются белые и красные мышцы. Примером белых мышц является большой приводящий мускул, а к типичным красным относятся икроножный, наружный жевательный, полусухожильный. Существуют мышцы, имеющие смешанные волокна.
Скелет конечностей кролика
Скелет кролика и его мускулатура, касающиеся задних конечностей, развиты значительно лучше передних. Этому есть объяснение – задние конечности выполняют более тяжелую работу, связанную с осуществлением прыжков, рытьем нор.
В состав задних конечностей входят бедренные кости, большая и малая кости колени и стопы с пятью пальцами. Ноги зверьков присоединяются к основной части скелета с помощью специальных поясов. Величина размера между передними конечностями определяет ширину пояса плечевого. Соответственно, между задними конечностями – размер тазового пояса.
Как разделать кролика
Разделывать кролика на части умеет не каждая хозяйка. Просто порубить на куски, сложить в кастрюлю и тушить все вместе – не вариант. На тушке этого пушистого зверька есть очень ценные фрагменты мяса, а приготовленные из них блюда в ресторанах стоят немалых денег. Не поленитесь правильно разделать кролика в домашних условиях и вы сможете сотворить из его нежного мяса свой кулинарный шедевр.
Сохранить этот рецепт:
Хотите сохранить себе этот рецепт?
Выберите, куда:
Как разделать кролика
Ингредиенты:
Приготовление: Шаг 1
Если задуматься о том, как живет кролик, то легко можно догадаться, где у него самое жесткое мясо, а где нежное. Зная это, разделать кролика будет просто. Он бегает и прыгает, и поэтому на лапах мясо жестче всего.
Передние лапы (1) содержат мускулы и сухожилья, здесь мяса не так много и оно довольно жесткое. А вот на задних лапах (2) мяса вдоволь, вот почему именно эту часть чаще всего тушат с овощами или в сметане. Получается очень вкусно.
Центральный кусок (3) кролика самый ленивый, он не работает. Здесь мясо нежнее и чем оно нежнее, тем меньше времени тратится на его приготовление.
В процессе разделки кролика я буду рассказывать, из какой части лучше всего приготовить первое блюдо, а что лучше потушить.
А еще можно убрать кости, нафаршировать и запечь в духовке с чесноком, травами и прочими вкусными вещами.
Шаг 2
Когда разделываете тушку – не торопитесь, делайте это аккуратно. Кости кролика лучше не рубить, так как при разламывании они имеют свойство сильно дробиться, поэтому если кость повреждена лезвием ножа – старайтесь тщательно выбирать мелкие осколки из мяса, чтобы в готовом блюде такой “сюрприз” не попался на зуб. Лучше всего разделывать кролика на кусочки с целыми косточками.
Если тушка кролика мороженная, то ее нужно разморозить перед разделкой. Срезать с тушки лишний жир, его можно будет использовать при жарке мяса.
Мясо кролика должно быть бледно-розовое на цвет, без запаха.
Шаг 3
Отделить по суставам задние лапы. Сделать это довольно сложно, нужно приложить как можно больше силы. Попросите сделать этот процесс своего мужа, крепкие руки быстрее отделят ноги кролика от тушки. Если мужа рядом нет, то вам на помощь придет топорик.
Шаг 4
Если ноги большие, разрежьте их еще раз по суставу. Из одной ноги получиться 2 хороших кусочка.
Шаг 5
Чтобы отделить передние лапы нужно пройтись ножом по сухожилиям и соединениям. Отделяются они очень легко.
Шаг 6
Передние лапы можно разделить еще на части и использовать для приготовления первых блюд те куски, где мяса меньше, а часть потолще – тушить.
Шаг 7
Начиная с области таза, острым ножом отделить филе вдоль ребер и спины. Не торопитесь, потихоньку подрезайте мясо и получите шикарный цельный фрагмент.
Филе кролика это ценная его часть. Если зверек был большого размера, то можно вырезать 300 граммов филе – поверьте, это очень много. Если кролик маленький, то филе можно не отделять, тогда кусочки со спины и ребер будут более мясистыми.
Из такого филе можно сделать рулет, нафаршировав его луком и грибами, курагой или сухофруктами. Филе кролика можно тушить в сметане или в вине с розмарином.
Шаг 8
Из тушки достать почки, печень, легкое и сердце.
Эти субпродукты можно добавить в суп или измельчить, обжарить с луком и заправить кашу (рисовую или гречневую).
Шаг 9
Разделить тушку пополам в области поясницы. Там, где заканчиваются ребра, подрезать ножом сухожилья и разделить или переломить руками тушку на две части.
Шаг 10
Спинку кролика разделить на 3-4 или более частей (ширина кусочков 4-5 см).
Шаг 11
У меня кролик домашний, поэтому у него осталась довольно большая часть шеи. Чаще всего у покупных зверьков такой длинной шеи нет. Если на вашей тушке она присутствует – вырежьте ее ножом.
Шаг 12
Разрезать грудину ножом или ножницами, распластать ее на доске и разрезать на 4 части. Можно кухонными ножницами аккуратно срезать ребрышки, а спинку разделить на части.
Эти кусочки очень нежные и требуют минимум времени на приготовление.
Шаг 13
Так как мой кролик был очень большой, я приготовила из него пару блюд, а остальные кусочки заморозила. Советую сложить разделанного кролика в несколько пакетов и не слишком долго держать его в морозильной камере. Мясо очень нежное, и длительное пребывание в морозилке доведет его до высыхания, а замерзшая жидкость порвет ценное мясо на волокна, от чего пострадает не только вкус, но и вид готового блюда.
Теперь вы знаете, как просто разделать кролика.
Разделка кролика с фото и рекомендациями
Перед тем как разделать кролика, внимательно изучите основные схемы и правила – от этого зависит качество и целостность кусков, вкусовые показатели (это больше касается процесса забоя). Но в целом, технология не сильно отличается от способов потрошения курицы.
Забой и потрошение
Чтобы мясо было вкусным, сочным и имело товарный вид, необходимо правильно забить животное. В отличие от курицы и другой птицы, кролям не перерезают горло, а умерщвляют при помощи удара тупым предметом. Этот метод называется бескровным.
В мире существует множество и других способов. Например, в мусульманских странах кроликов убивают путём разреза, в Европе – электрическим током и т. д., но бескровный метод считается наиболее оптимальным.
Пошаговая инструкция забоя:
После этого необходимо снять шкурку так, чтобы она осталась целой. Для этого существует стандартная схема:
О том, как правильно шкурковать кролика и обустроить место забоя, смотрите в нашем небольшом видео:
После этого переходите к процессу потрошения:
Тушку осталось тщательно промыть, удалив все загрязнения.
Какой инвентарь понадобится?
Для того чтобы быстро, удобно и качественно разделать кролика, заранее приготовьте следующие инструменты:
Технология разделки тушки
Некоторые новички для облегчения работы используют кухонные топорики, но специалисты не рекомендуют разрубать тушку, так как трубчатые кости раскалываются на множество мелких осколков.
На порционные части
Чаще всего кролика готовят в виде порционных кусков. Есть 2 универсальные технологии. Первая предполагает следующие действия:
Существует упрощенная технология разделки кролика:
Разделка на филе
Филейная часть срезается исключительно у крупных кролей, так как с мелких особей получится не филе, а обычные порционные куски.
Чтобы правильно отделить кусок, необходимо действовать поэтапно:
О том, как ещё можно сделать филе кролика, смотрите в видеоролике:
Цельная тушка
Если вы забиваете одновременно нескольких кролей и не планируете их сразу приготовить, то сохранить тушки можно в морозильной камере. Лучше всего замораживать кролей целиком – так у вас будет возможность приготовить в будущем любое блюдо, вплоть до запекания целой тушки в духовке.
Перед замораживанием подготовьте мясо следующим образом:
Опытные кролиководы советуют перед заморозкой смазать мясо растительным маслом (исключительно рафинированным), что позволит увеличить длительность сохранности и улучшить внешние показатели тушки после размораживания.
Утилизация и санитарная обработка
На шкуре кроликов и в их крови длительное время сохраняются болезнетворные микроорганизмы, поэтому во избежание развития инфекций, после забоя проводится санитарная обработка помещения, инструментов, одежды и пр. В обязательном порядке утилизируются остатки от кроля.
В домашних условиях придётся сделать следующее:
Патогенные микроорганизму стремительно распространяются по всей территории, поэтому если своевременно не обеззаразить помещение, повышается риск инфицирования других кролей, домашних животных, скота и человека.
Разделывать кролика несложно, главное – освоить одну из техник, подготовить острые инструменты, соблюдать правила санитарно-гигиенических норм и действовать уверенно. Даже если в первый раз у вас получится это плохо, то в следующий – обязательно лучше.
Какие кости у кролика трубчатые или
Восстановление костной ткани человека после перенесенной тяжелой травмы и устранение массивных дефектов костей остается актуальной проблемой современной медицины [1, 10].
В нормальных условиях репарация костной ткани происходит за счет остеобластов надкостницы, которые проникают в зону перелома и восстанавливают целостность кости [4, 6]. Несмотря на достаточно активную способность к репарации, костная и хрящевая ткань иногда не в состоянии полностью устранить дефицит тканей, возникший в результате действия повреждающего фактора, что является серьезной проблемой в реконструктивной хирургии и ортопедии. Попытки восстановить утраченную часть кости или хряща предпринимались с давних пор и сводились, прежде всего, к аллотрансплантации или использованию синтетических материалов [11, 17]. Однако у этих широко применяемых, и ставших уже рутинными технологий есть множество недостатков: от наличия иммунологического барьера и дефицита пластического материала до остаточного ограничения качества жизни даже после установки синтетических протезов).
Основную часть биоматериалов для восстановления костных дефектов до недавнего времени получали из хрящевой и/или костной тканей человека и животных, а также компонентов кожи, сухожилий, мозговой оболочки [3, 8, 12]. Однако такие материалы должны готовиться непосредственно перед трансплантацией, либо клиника должна иметь банк для хранения такого материала, что доступно крупным специализированным медицинским центрам; возможности получения значительных количеств аутоматериала весьма ограничены. Все это существенно ограничивает широкое применение аутотрансплантатов.
Значительную роль в ортопедии и травматологии играют металлы [2, 5, 16]. Однако применение при лечении переломов трубчатых костей металлических аппаратов внешней фиксации (АВФ), крепежных элементов в виде винтов, спиц и стержней требует повторного хирургического вмешательства для удаления конструкции и часто сопровождается возникновением эндопротез-ассоциированных осложнений (металлозы, аутоиммунные реакции, асептическое воспаление), а также выделением из металлической конструкции токсических компонентов (никель, хром и др.) [7, 13]. Несмотря на широкое распространение биокерамики, в основном гидроксиапатита, в хирургической стоматологии, ортопедии и травматологии, недостатками такого материала являются его низкая резорбция, что порой приводит к «замуровыванию» имплантированного материала на стадиях in vivo или очень длительному процессу восстановления костной ткани – более 1–2 года, а также низкие остеоиндуктивные свойства материала [9, 15].
В настоящее время наиболее перспективными являются биоразрушаемые полиэфиры монокарбоновых кислот, таких как полилактиды, полигликолиды, полигидроксиалканоаты и т.д. Эти полиэфиры, при свойственном им высоком уровне биосовместимости, распадаются в организме и в окружающей среде на безвредные фрагменты, метаболизирующиеся в конечном случае до воды и углекислого газа, а в некоторых случаях сами являются естественными метаболитами организма [14].
Полигидроксиалканоаты (ПГА) представляют огромный интерес для восстановительной хирургии кости в силу их медленной биорезорбции и высокой биосовместимости. Перспективность ПГА для реконструктивного остеогенеза связана также с наличием у ПГА пьезоэлектрического эффекта.
Цель настоящей работы: исследование остеопластических свойств пористого имплантата на основе поли-3-гидроксибутирата в экспериментальной модели дефекта трубчатой кости кролика.
Материалы и методы исследования
Конструирование ПГБ имплантатов
Для исследований был использован высокоочищенный, измельченный до порошкообразного состояния гомополимер 3-гидроксимасляной кислоты (П3ГБ). Пористые полимерные объемные матриксы получали с использованием техники выщелачивания. Кусочки сахарозы, предварительно спрессованные до размера (1×1×1 см) на лабораторном автоматизированном прессе Carver Auto Pellet 3887, пропитывали раствором полимера в хлороформе, затем сушили при температуре 30 °С. После испарения растворителя матриксы промывали в дистиллированной воде для растворения и удаления сахарозы. Полученный пористый каркас из полимера обрезали до нужных размеров (0,5×0,5×0,5 см 3 ) и использовали в эксперименте.
Микроструктуру поверхности полимерных композитов и матриксов исследовали с применением сканирующей электронной микроскопии (микроскоп ТМ-3000, Hitachi, Япония). Суммарную пористость и влагопоглощение матриксов определяли методом предельной адсорбции воды. Физико-механические характеристики образцов регистрировали на универсальной электромеханической испытательной машине Instron 5565,5 KN (Великобритания).
Исследование пористых матриксов in vitro
Изоляция культуры ММСК
ММСК выделены из бедренных и большеберцовых костей умерщвленных передозировкой эфирной ингаляции лабораторных крыс. Костный мозг выделяли в асептических условиях после удаления шейки кости; в открытый костномозговой канал с помощью шприца вводили 1 мл среды α-МЕМ с добавлением 20 % телячьей сыворотки и 50 ед. гепарина, костный мозг вымывали и тщательно суспендировали, затем дважды центрифугировали и промывали питательной средой, суспензию клеток переносили в чашку Петри диаметром 90 мм и помещали в СО2-инкубатор.
Посев ММСК на матриксы
П3ГБ пористые матриксы были простерилизованы Н2О2-плазмой (медицинский стерилизатор Sterrad N.X., Jh.&Jh., США) и помещены в 24-луночные культуральные планшеты. После 3 пассажей проводили рассев клеток на стерильные матриксы из расчета 100 000 клеток/мл. Культивирование клеток на матриксах проводили в течение 21 дня в среде ДМЕМ с добавлением 10 % ЭТС, раствора антибиотиков, 0,15 мМ аскорбиновой кислоты, 10 нМ дексаметазона и 10мМ β-глицерофосфата (реактивы Sigma-Aldrich) в 5 %-й атмосфере СО2 при 37 °С с заменой среды на каждый третий день.
Активность щелочной фосфатазы
Для подтверждения дифференцировки клеток в остеобластоподобные использовали один из биохимических маркеров формирования костной ткани – активность фермента костной щелочной фосфатазы, выделяемой остеобластами и предположительно участвующей в минерализации остеоидов. Щелочную фосфатазу оценивали с помощью Alkaline Phosphatase Detection Kit (Sigma) согласно приложенному протоколу.
Исследование пористых матриксов in vivo
Остеопластические свойства П3ГБ исследованы на модели костного дефекта бедренной кости диафизарной зоны у кроликов-самцов породы шиншилла 4–5-месячного возраста. В эксперименте использовано 12 животных, по 4 в каждой группе (n = 3). Костный дефект в первой экспериментальной группе закрывали пористым матриксом на основе П3ГБ, во второй группе – композитным материалом гидроксиапатит/коллаген (препарат «Коллапол», ЗАО Полистом, Москва). В группе сравнения восстановление дефекта осуществляли аутокостью (рис. 1).
Под ксилазиновым наркозом после обработки операционного поля 70 % спиртовым раствором хлоргексидина по переднемедиальной поверхности бедра животным производили разрез кожи длиной 5 см. Мышцы тупым способом разводили и фиксировали. С помощью остеотома на передней поверхности бедра кролика моделировали костный дефект размером 3×4 мм. Далее в костную полость имплантировали матриксы на основе П3ГБ и «Коллапол» (экспериментальные группы), при этом пластика выполнена таким образом, чтобы вся полость дефекта кости была заполнена. Поверх дефекта выполняли периостальную пластику надкостницы ультратонкой пленкой из ПГА. Рана послойно ушивалась наглухо. Накладывалась асептическая повязка. Для профилактики переломов дополнительно проводили иммобилизацию конечности гипсовой лонгетой. Перевязку проводили один раз в сутки в течение семи дней. На протяжении первых трех суток с целью обезболивания вводили в/м Sol. Ketonali 0,1. В послеоперационном периоде осуществляли динамическое наблюдение за состоянием животных (аппетит, двигательная активность, состояние оперированных конечностей). Рентгенологическое исследование оперированных конечностей опытных животных выполняли на аппарате РУМ-20 в режиме 44 mA 0,1 kB с экспозицией в 1 с. Проводили сравнительный анализ рентгенографических данных на 60-е, 90-е, 120-е сутки после пластики костной полости. Оценивались размеры костного дефекта, его форма, однородность структуры регенерата, состояние надкостницы, кортикальной пластины и костномозгового канала, а также переломы в месте формирования дефекта.
Для морфологического исследования образцы костной ткани подвергались декальцинации в растворе «Трилона-Б» с последующей парафиновой проводкой. Гистологические срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином. При микроскопическом исследовании оценивали состояние окружающих кость мягких тканей, надкостницы, кортикального слоя, костномозгового канала.
Результаты исследования и их обсуждение
Сконструированы и исследованы 3D пористые матриксы на основе П3ГБ диаметром 4 мм, высотой 5 мм, весом 0,0552 г. Анализ микроструктуры носителей, выполненный с применением морфологического анализа (программа обработки данных Scanmaster), показал, что кроме основных крупных пор в носителе сформирована система более мелких пор по границе контактов между полимерными ячейками; приведены соответствующие дифференциальные и интегральные кривые распределения пор по размерам. Суммарная площадь всех выделенных пор составляет около 87,3 %. При этом крупные поры размером 104–120 мкм составляют в носителе до 90 %; остальные 10 % приходятся на мелкие поры (5,7–10 мкм). Результаты компьютерного анализа согласуются с экспериментальными данными по определению суммарного объема пор по влагоемкости (88 %). Влагопоглощение полимерного носителя составило 38,5 ± 0,20 %.
Рис. 1. Технология эксперимента пластики костного дефекта: А – группа сравнения; 2 – группа с применением «Коллапола»; В – пористый матрикс на основе П3ГБ
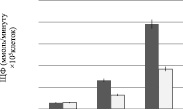
По результатам МТТ-теста (рис. 2), проведенного на 3, 7 и 10 сутки, количество клеток на на 3D матриксах составило 0,63⋅10 5 клеток/мл, что достоверно выше, чем на культуральном пластике 0,3⋅10 5 клеток/мл. Результаты определения активности щелочной фосфатазы согласуются с результатами МТТ-теста. ЩФ на 10 сутки культивирования ММСК на среде с факторами дифференцировки составила у клеток на 3D матриксах 3,908 ммоль/минуту⋅10 5 клеток по сравнению с контролем (рис. 3).

Рис. 2. 3D пористые матриксы на основе П3ГБ (слева – фотография, маркер 1 см; справа – РЭМ-изображение)
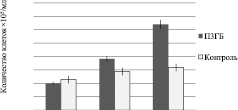
Рис. 3. Исследование способности матриксов адгезировать дифференцированные клетки ММСК в сравнении с контролем (культуральный пластик): а – количество жизнеспособных остеобластов на 3D матриксах; b – активность щелочной фосфатазы остеобластов на 3D матриксах после 10 дней культивирования.
Результаты эксперимента in vivo
Результаты сравнительного анализа клинической картины у экспериментальных животных первой экспериментальной группы (после замещения дефекта ПГБ) и второй экспериментальной группы (замещение Коллаполом) и группы сравнения представлены в таблице.
В раннем послеоперационном периоде наблюдали вялое состояние животных, кролики мало двигались, не опирались на оперированную конечность. Восстановление аппетита и двигательной активности кроликов произошло к 3–5 суткам, на 7–9 сутки после операции у животных второй экспериментальной группы появлялся отек мягких тканей в области операции, в группе сравнения – локальная гиперемия кожи. В среднем на 15,5 ± 1,2 сутки отек и гиперемия купировались. Опора на конечность появлялась на 5,01 ± 1,5 сутки после операции. Операционные раны заживали per prima, случаев нагноения не отмечено, послеоперационные швы удалялись на 7 сутки. Летальных случаев не зафиксировано.
При анализе рентгенологических исследований оперированных конечностей кроликов выявлено следующее. При замещении костного дефекта пористым 3D матриксом на основе П3ГБ уже на 60-е сутки определялась полость округлой формы в средней трети бедренной кости размерами 1,5×2 мм, что значительно меньше, чем во второй экспериментальной группе. Полость дефекта имела четкие контуры, без ободка склероза. Надкостница не изменена, периостальная реакция отсутствовала. На 120-е сутки произошло полное восстановление костного дефекта бедренной кости (рис. 4).
Во второй экспериментальной группе на 60-е сутки на обзорной рентгенограмме нижних конечностей, после имплантации Коллапола, определялась полость округлой формы в средней трети бедренной кости размерами 2×3 мм. Полость с четкими контурами без ободка склероза. Однако, на 120-е сутки в данной группе произошло сокращение размеров костного дефекта бедренной кости в 2 раза в сравнении с R-картиной на 60-е сутки наблюдения, визуализировалось уменьшение полости до 1×1,5 мм. Контуры полости нечеткие за счет прорастания (заполнения) костной ткани в полость дефекта, периостальная реакция отсутствовала, тем не менее полного восстановления дефекта не произошло.
Течение послеоперационного периода у экспериментальных животных