какие наблюдения и эксперименты подтверждают основные положения молекулярно кинетической теории
Основные положения молекулярно-кинетической теории и их опытное обоснование
Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория.
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема. Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул:
Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:
Отношение массы вещества m к числу молекул N в данном веществе:
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаNА:
Количество молекул, содержащихся в 1 моль вещества.
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль.
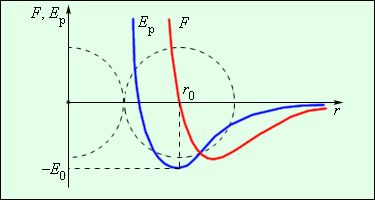
Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r r0 – притяжение, причем оно быстро убывает. На расстоянии r0 система двух молекул обладает минимумом потенциальной энергии (сила взаимодействия равна нулю) – это состояние устойчивого равновесия
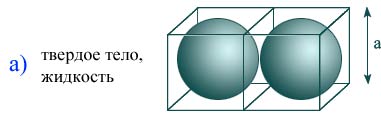
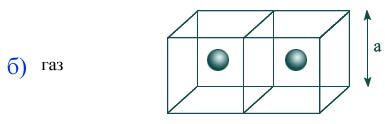
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга.
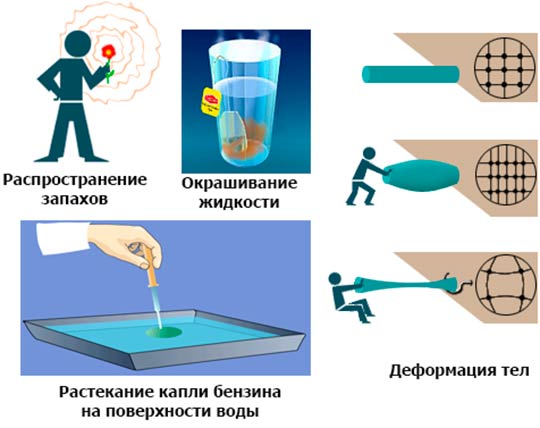
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
Б) Броуновского движения
Краткие итоги
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения, которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Основные положения молекулярно-кинетической теории

Всего получено оценок: 218.
Всего получено оценок: 218.
Одним из видов энергии в природе является внутренняя тепловая энергия. Природа этой энергии изучается в рамках теории, которая называется молекулярно-кинетической (МКТ). Познакомимся с основными положениями молекулярно-кинетической теории.
Возникновение молекулярно-кинетической теории
Первые представления о том, что тепло — это движение мельчайших неделимых частиц вещества, высказывались еще в античности. В учении Левкиппа и Демокрита движение атомов являлось причиной всего сущего.

Однако античные взгляды были в основном умозрительны и не основывались на исследованиях и опытах. Первые научные эксперименты, послужившие основой будущей теории, были проведены в начале эпохи Возрождения, а окончательную научную форму МКТ начала принимать лишь в XVIII в.
Вначале была популярна идея об особом «тепловом флюиде», флогистоне или теплороде, который содержится в горючих веществах и высвобождается при горении. Флогистон рассматривался как одна из составляющих вещества. Составлялись специальные таблицы, описывающие движение флогистона. То, что масса вещества при горении увеличивается, приписывалось отрицательной массе флогистона.
Однако результаты исследований Г. Кавендиша, А. Лавуазье, М. Ломоносова полностью опровергли теорию флогистона и положили начало молекулярной теории тепла. Согласно М. Ломоносову, все вещества состоят из мельчайших частиц-молекул, а тепло — это вращательное движение этих частиц.
В конце концов, в результате исследований строения вещества основные положения молекулярно-кинетической теории приняли современный вид. Эти положения гласят:
Доказательства положений МКТ
Первоначально опытные обоснования утверждений МКТ были косвенными. Например, конечность растекания масла по поверхности воды говорит о том, что можно оценить размер молекул, зная объем капли масла и площадь максимального растекания.
Диффузные явления (самопроизвольное смешивание газов и жидкостей) также можно объяснить лишь тем, что частицы вещества находятся в постоянном движении, и это движение связано с температурой, поскольку диффузия при увеличении температуры ускоряется.
Наконец, был открыт закон постоянных отношений Д. Дальтона, который говорит, что отношения масс элементов, участвующих в химических реакциях, всегда имеют целые значения. Его также можно объяснить, только если предположить, что вещества состоят из молекул, каждая из которых имеет строго определенное количество атомов элементов.
Но прямое доказательство положений МКТ было получено в 1827 г. английским ботаником Р. Броуном. Он наблюдал под микроскопом взвесь пыльцы растений и обнаружил, что частицы находятся в постоянном хаотическом движении, зависящем от температуры.
Броуновское движение доказывает сразу все три положения МКТ. Движение броуновских частиц возможно, только если предположить, что они окружены мельчайшими частицами жидкости, которые способны двигаться и взаимодействовать, передавая механический импульс броуновским частицам и друг другу. При этом, поскольку интенсивность броуновского движения увеличивается с температурой, то скорость молекул также зависит от температуры, и ее можно оценить, используя специальные формулы.
Что мы узнали?
Основные положения молекулярно-кинетической теории гласят: все вещества состоит из мельчайших частиц-молекул, которые находятся в постоянном хаотичном движении и при этом взаимодействуют друг с другом. Все тепловые явления — это результат такого взаимодействия. Главным доказательством этого является броуновское движение.
Основные положения молекулярно-кинетической теории. Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Масса и размеры молекул.
1. Основные положения молекулярно-кинетической теории.
«Механика» изучает движение тел, но она не в состоянии объяснить, почему существуют твердые, жидкие и газообразные тела и почему эти тела могут переходить из одного состояния в другое.
Исследование внутренних свойств тел не входит в задачу механики. В механике говорят о силах, как о причинах изменения скоростей тел, но происхождение и природа этих сил не выясняется. Остается непонятным, почему при сжатии тел возникают силы упругости, почему возникают силы трения. На эти и многие другие вопросы механика Ньютона ответов не дает.
Чтобы получить ответы на эти вопросы, мы начинаем изучение раздела «молекулярная физика»
1. Основные положения МКТ:
1) Все вещества состоят из молекул, между которыми существуют промежутки.
2) Молекулы находятся в непрерывном и хаотическом движении.
3) Между молекулами на небольших расстояниях действуют силы притяжения и силы отталкивания. Природа этих сил электромагнитная.
2. Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества.
Все эти положения были доказаны и подтверждены с помощью опытов.
I положение: были определены размеры и массы молекул. Молекула – наименьшая частица вещества, сохраняющая свойства этого вещества и способная к самостоятельному существованию.
Опыт: краска в жидкости (мелкие частицы краски беспорядочно перемещаются из одного места в другое, более крупные лишь колеблются).
Броуновское движение объясняется тем, что молекулы жидкости ударяются о частички краски, приводя их тем самым в движение.
III положение: попробуйте сломать толстую палку. Это сделать трудно. Палка состоит из молекул, и если бы между ними не было сил притяжения, то палка рассыпалась бы. И вообще все вещества в природе находились бы только в газообразном состоянии. Но т.к. есть еще жидкости и твердые тела, следовательно, между молекулами существуют силы притяжения. Но кроме притяжения на близких расстояниях возникают силы отталкивания. Почему?
При сближении молекул между ними начинают действовать силы притяжения, которые возникают между электронами одной молекулы и ядром другой. При еще большем сближении на расстояние меньше радиусов молекул, когда электронные оболочки атомов начинают перекрываться, возникают силы отталкивания, которые быстро нарастают и превышают силы притяжения. Таким образом, силы взаимодействия молекул зависят от расстояния между ними.
Хаотическое движение молекул – это движение тепловое, т.е. при нагревании тела, скорость движения молекул увеличивается.
Скорость движения молекул была вычислена экспериментально в опыте Штерна (1920г).

покрытая слоем серебра. По этой проволочке пропускают электрический ток. В стенке цилиндра А имеется узкая щель. Воздух из цилиндров откачан.
Вначале прибор неподвижен. При прохождении тока по нити слой серебра испаряется и внутренний цилиндр заполняется газом из атомов серебра. Некоторые атомы пролетают через щель и осаждаются на внутренней поверхности цилиндра В. В результате прямо против щели образуется узкая полоска серебра М. Затем цилиндры приводят во вращение с угловой скоростью ω. Теперь за время t, необходимое атому для прохождения пути, равного разности радиусов цилиндров rВ – rА, цилиндры повернутся на некоторый угол. В результате атомы попадут на внутреннюю поверхность цилиндра В не прямо против щели, а на некотором расстоянии ℓ. Это расстояние равно: ℓ = ω ּ rВ ּ t
Скорость атома υ =
Подставляя в эту формулу значение t из первой формулы получим:
υ =
Зная ω, rА, rВ, и измеряя смещение ℓ находят среднюю скорость атомов серебра. В опыте Штерна она оказалась близкой к 500 м / с.
4. Масса и размеры молекул
Экспериментальным подтверждением первого положения МКТ было определение размеров молекул.
Опыт (масло на поверхности воды никогда не займет всей поверхности, предполагают, что оно расплылось
Молекулы и атомы очень малы, что представить себе их размеры можно только путем сравнений. Например, атом железа во столько же раз меньше грецкого ореха, во сколько раз орех меньше Луны.
Как ни мала атомы и молекулы их массы измерены довольно точно
По международному соглашению массы всех атомов молекул сравнивают с 

где m0 – масса молекулы;

Относительные атомные массы элементов представлены в периодической таблице Менделеева.
Следующее понятие, с которым мы познакомимся, это количество вещества ν выражается оно в молях.
Моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько их содержится в 0,012 кг углерода.
1 моль любого вещества содержит одинаковое количество атомов или молекул. Количество молекул в одном моле вещества называется постоянной Авогадро в честь итальянского ученого XIX в. и обозначается NА
Используя NА можно выразить количество вещества:
ν = 
Количество вещества равно отношению числа молекул в данном теле к постоянной Авогадро. Вместе с относительной молекулярной массой используется молярная масса – это масса вещества взятого в количестве одного моля:
Масса любого количества вещества равна произведению массы одной молекулы на число молекул в теле:
а N = 
а из формулы [2 ] выразим NА= 
Подставим значения N и Na в формулу [1 ]
ν
ν
Количество вещества равно отношению массы вещества к его молярной массе.
Число молекул из формулы [1]:
N = ν 
Вопросы для самоконтроля и повторения
Вопросы для самоконтроля и повторения
1. Назовите основные положения МКТ.
2. Какие опыты доказывают первое положение? второе? третье?
3. Что называется молекулой?
4. Что такое диффузия?
5. Какое движение называется броуновским?
6. Что называют относительной молекулярной массой?
Основные положения молекулярно-кинетической теории и их опытное обоснование
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
Эти основные положения подтверждаются экспериментально и теоретически.
Состав вещества
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
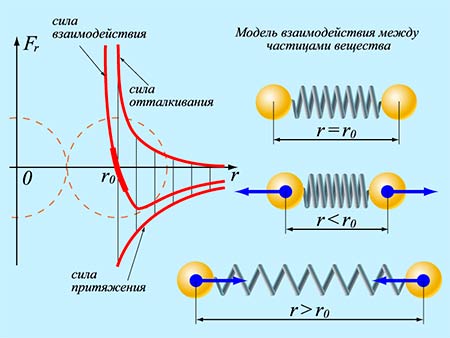
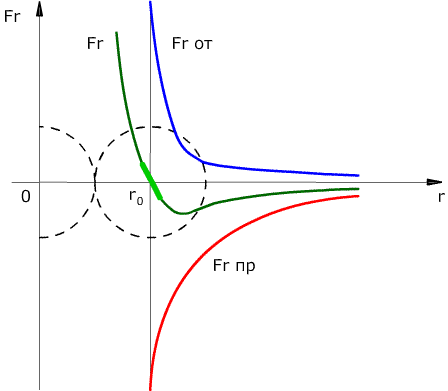
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
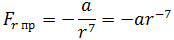 | (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
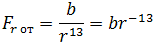 | (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
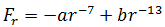 | (1.3) |
При r > r0 притяжение молекул превосходит отталкивание, при r
Основные положения МКТ
Молекулярно-кинетическая теория – это учение о строении и свойствах вещества, основанное на представлении о существовании атомов и молекул, как наименьших частиц химических веществ.
Основные положения молекулярно кинетической теории строения вещества
Основные положения молекулярно-кинетической теории молекулы:
Основные положения мкт и их примеры были перечислены выше. Между частицами имеется малое гравитационное воздействие.
Броуновское движение молекул и атомов подтверждает существование основных положений молекулярно кинетической теории и опытно обосновывает его. Данное тепловое движение частиц происходит с взвешенными в жидкости или газе молекулами.
Опытное обоснование основных положений молекулярно кинетической теории
Выражение r 2 > = D t объясняет диффузионный закон. По теории имеем, что D монотонно возрастает с увеличением температуры. Беспорядочное движение проглядывается при наличии диффузии.
Диффузия – это определение явления проникновения двух или нескольких соприкасающихся веществ друг в друга.
Данный процесс происходит быстро в неоднородном газе. Благодаря примерам диффузии с разными плотностями можно получить однородную смесь. При нахождении в одном сосуде кислорода O 2 и водорода H 2 с перегородкой то при ее удалении газы начинают смешиваться, образую опасную смесь. Процесс возможен при нахождении вверху водорода, а внизу кислорода.
Процессы взаимопроникновения также протекают в жидкостях, но намного медленней. Если растворить твердое тело, сахар, в воде, то получим однородный раствор, который является наглядным примером диффузионных процессов в жидкостях. При реальных условиях смешивание в жидкостях и в газах замаскировано быстрыми процессами перемешивания, к примеру, при возникновении конвекционных потоков.
Диффузия твердых тел отличается своей замедленной скоростью. Если поверхность взаимодействия металлов очистить, то можно увидеть, что с течением большого периода времени в каждом из них появятся атомы другого металла.
Диффузия и броуновское движение считаются родственными явлениями.
При взаимопроникновении частиц обоих веществ движение беспорядочно, то есть, наблюдается хаотичное тепловое перемещение молекул.
Броуновское движение
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы имеют в своем составе положительные и отрицательные заряды. При больших расстояниях преобладают силы межмолекулярного притяжения, при небольших – силы отталкивания.
Беспорядочное хаотичное движение молекул называют тепловым движением.
В твердых телах молекулы двигаются беспорядочно около фиксированных центров, то есть, положений равновесий. В пространстве может быть распределены нерегулярным образом (у аморфных тел) или с образованием упорядоченных объемных структур (кристаллических тел).
Агрегатные состояния веществ
Свобода теплового движения молекул просматривается в жидкостях, так как у них нет привязки к центрам, что позволяет производить перемещения по всему объему. Этим объясняется ее текучесть.
Если молекулы располагаются близко, то могут образовывать упорядоченные структуры с несколькими молекулами. Данное явление получило название ближнего порядка. Дальний порядок характерен для кристаллических тел.
Расстояние в газах между молекулами намного больше, поэтому действующие силы малы, а их движения идут вдоль прямой, ожидая очередного соударения. Значение 10 – 8 м является средним расстоянием между молекулами воздуха в нормальных условиях. Так как взаимодействие сил слабое, газы расширяются и могут заполнять любой объем сосуда. Когда их взаимодействие стремится к нулю, то говорят о представлении идеального газа.
Кинетическая модель идеального газа
В мкт количество вещества считается пропорциональным числу частиц.
Данная величина совпадает с массой протона и нейтрона.
Отношение массы атома или молекулы данного вещества к 1 12 массы атома углерода называют относительной массой.