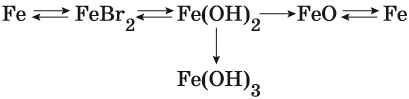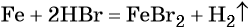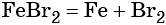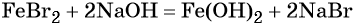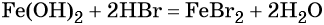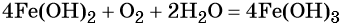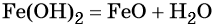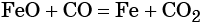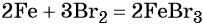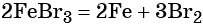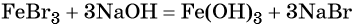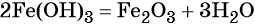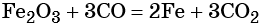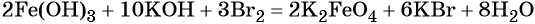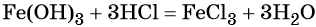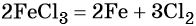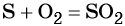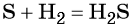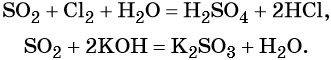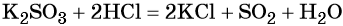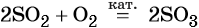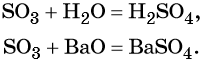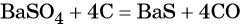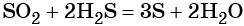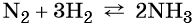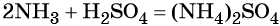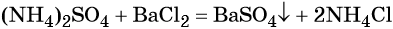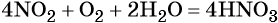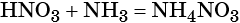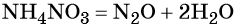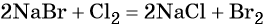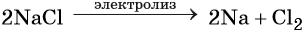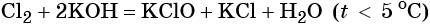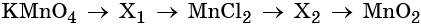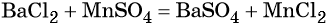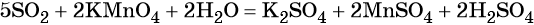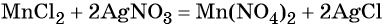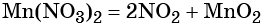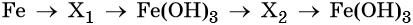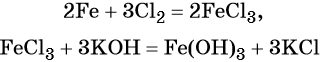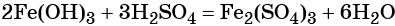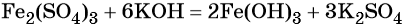какие надо взять реагенты чтобы осуществить цепь превращения
Какие надо взять реагенты чтобы осуществить цепь превращения
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Можно ли записать реакцию в виде Сu(NO3)2=CuO+N2O5
Нет, потому что разложение нитрата меди выглядит так
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для третьего превращения:
4)
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1162271
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
В Госдуме предлагают сделать бесплатным проезд на общественном транспорте для детей до 16 лет
Время чтения: 2 минуты
ФИПИ опубликовал демоверсии ОГЭ и ЕГЭ 2022
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
На новом «Уроке цифры» школьникам расскажут о разработке игр
Время чтения: 1 минута
Российские школьники установили рекорд на олимпиаде по астрономии
Время чтения: 2 минуты
Кузнецова призвала разработать закон о психологической помощи
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Практическая работа по химии «Осуществление цепочки превращений»
Дата___________ ФИ ___________________________________
ПРАКТИЧЕСКАЯ РАБОТА №1
ОСУЩЕСТВЛЕНИЕ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ
С правилами поведения в кабинете химии ознакомлен(а) _________ (_________________)
С техникой безопасности при проведении практической работы ознакомлен(а)____________(___________)
— обобщить знания об основных классах неорганических соединений
— осуществление цепочки химических превращений экспериментальным путем ;
-применение теоретических знаний в решении экспериментальных задач;
— совершенствование навыков проведения реакций ионного обмена;
— повторить свойства и некоторые способы получения основных классов химических веществ;
Развивающие – способствовать развитию логического мышления, развитию наблюдательности, умения объяснять, анализировать, сопоставлять, проводить химический эксперимент;
Воспитательная – воспитание интереса к предмету.
Тип урока : практическая работа
Оборудование: штатив с пробирками, спиртовка, пробиркодержатель, шпатель, мерная ложка, стеклянная палочка, воронка, фильтровальная бумага.
Реактивы: карбонат магния, соляная кислота, растворы гидроксида натрия, серной кислоты, хлорида цинка, сульфата меди( II ), хлорид алюминия, уголь.
3. Постановка целей и задач урока. Мотивация учебной деятельности.
Какова тема практической работы?
Чем мы будем заниматься на уроке? Сформулируйте цель практической работы. (Выяснить существуют ли генетические связи между неорганическими веществами)
4. Формирование навыков на основе применения их в стандартных условиях.
Откроем учебники и посмотрим, какие опыты мы будем проводить ( изучение инструкции проведения опытов).
Определяем план действий.
Какая перед нами стоит задача?
Какие необходимы приборы и материалы для проведения опытов?
Какие правила техники безопасности мы должны соблюдать при выполнении работы?
Класс делится на две группы и выполняют два варианта практической работы
Учащиеся получают таблицы для записей наблюдений:
При проведении практической работы мы должны заполнить таблицу
Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
Осуществим 1-ю цепочку превращений
Бурное выделение бесцветного газа, «вскипание» раствора
Записать ионные уравнения
Магния можно получить в результате взаимодействия карбоната магния с соляной кислотой
К раствору MgCl 2 добавляем пипеткой по каплям раствор NaOH
Образуется осадок белого цвета(гидроксид магния)
MgCl 2 + 2 NaOH → 2 Na Cl + Mg( OH ) 2 ↓ Записать ионные уравнения
Для получения нерастворимого основания Mg( OH ) 2 ↓ нужно к раствору хлорида мыгния добавить щелочь
К раствору Mg( OH ) 2 ↓ добавили раствор H 2 SO 4
Осадок растворился, раствор стал прозрачным
Mg( OH ) 2 ↓ + H 2 SO 4 → Mg SO 4 + 2 H 2 O Записать ионные уравнения
Раствор сульфата магния можно получить в результате реакции нейтрализации между нерастворимым основанием Mg( OH ) 2 ↓ и серной кислотой
Осуществим 2-ю цепочку превращений
Образуется осадок белого цвета(гидроксид цинка)
ZnCl 2 + 2NaOH → Zn(OH) 2 ↓+ 2NaCl
Записать ионные уравнения
Нерастворимое основание Zn ( OH ) 2 ↓+ можно получить при взаимодействии раствора соли и щелочи
Нерастворимое основание разделили на две пробирки. В одну пробирку добавили избыток щелочи
В другую пробирку добавили избыток соляной кислоты
Осадок гидроксида цинка растворяется
Осадок гидроксида цинка растворяется
Записать ионные уравнения
Zn ( OH ) 2 ↓+ HCl → ZnCl 2 + 2 H 2 O Записать ионные уравнения
Гидроксид цинка проявляет свойства кислот, растворяя осадок и образуя растворимую соль циниат натрия
Гидроксид цинка проявляет свойства оснований, растворяя осадок и образуя растворимую соль хлорид цинка
Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
Осуществим 1-ю цепочку превращений
В пробирку налили 1-2 мл раствора сульфата меди. Добавили 1-2 мл гидроксида натрия
Образуется осадок голубого цвета(гидроксид меди)
Записать ионные уравнения
Нерастворимое основание Cu ( OH ) 2 ↓ можно получить в результате реакции обмена между растворами сульфата меди и щелочи
Закрипили пробирку с раствором гидроксида меди в пробиркодержателе и осторожно нагрели
Постепенно голубая окраска изменяется на черную- это оксид меди
Оксид меди можно получить в результате реакции разложения гидроксида меди
Отфильтровали осадок CuO с помощью фильтровальной бумаги. Просушили. Поместили в сухую пробирку смесь порошка CuO и угля. Нагрели полученную смесь.
Ченая окраска постепенно меняется на красную окраску меди
CuO + C → Cu + CO 2 ↑ Записать ОВР.
Медь можно получить реакцией восстановления оксида меди
Осуществим 2-ю цепочку превращений
Образуется осадок белого цвета(гидроксид цинка)
AlCl 3 + 3NaOH → Al(OH) 3 ↓+ 3NaCl
Записать ионные уравнения
Нерастворимое основание Al ( OH ) 3 ↓+ можно получить при взаимодействии раствора соли и щелочи
Нерастворимое основание разделили на две пробирки. В одну пробирку добавили избыток щелочи
В другую пробирку добавили избыток соляной кислоты
Осадок гидроксида алюминия растворяется
Осадок гидроксида алюминия растворяется
Al ( OH ) 3 ↓+ HCl → AlCl 3 + 2 H 2 O Записать ионные уравнения
Гидроксид алюминияпроявляет свойства кислот, растворяя осадок и образуя растворимую соль алюминат натрия
Гидроксид алюминия проявляет свойства оснований, растворяя осадок и образуя растворимую соль хлорид алюминия
Общий вывод: в ходе выполнения практической работы были обобщены знания об основных классах неорганических соединений, освоены принципы планирования и проведения опытов согласно предложенным схемам, закреплены навыки составления ионных уравнений о окислительно- восстановительных реакций.
5. Самоконтроль выполнения работы.
Обучающиеся заполняют таблицу и делают выводы по каждому опыту
6. Итоги урока. Рефлексия.
Как живые организмы имеют родственные связи, так и неорганические вещества имеют родственные связи, т.е. с помощью цепочки превращений из одного класса веществ можно получить другой класс веществ. Мы доказали существование генетических связей неорганических веществ
7. Домашнее задание: закончить оформление практической работы в тетради
ПРАКТИЧЕСКАЯ РАБОТА №1
ОСУЩЕСТВЛЕНИЕ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ
Опыт 1. Инструкция к выполнению первой цепочки переходов.
1)Выданы пробирки №1, №2, №3. В пр.№1насыпана соль MgCO3. Для осуществления превращений приливайте по 1-2 мл необходимых реактивов;
-после проведения 1-ого опыта отделите раствор от непрореагировавшего вещества, слейте его в пр. №2;
— в пр.№2 к полученному после добавления выбранного вами реактива осадку добавьте 1-2 мл воды, перемешайте смесь и отфильтруйте в стаканчик, промойте осадок 2-3мл воды;
— осадок перенесите стеклянной палочкой в пр. №3 и осуществите третье превращение.
Опыт 2. Инструкция к выполнению второй цепочки переходов.
2)Для осуществления второй цепочки переходов выданы пробирки №4, №5;
а) в обе пробирки прилейте по 1-2 мл раствора хлорида цинка и получите в обеих пробирках студенистый осадок гидроксида цинка (реактива приливайте по 1-2 мл в каждую пробирку).
ПРАКТИЧЕСКАЯ РАБОТА №1
ОСУЩЕСТВЛЕНИЕ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ
Опыт 1. Инструкция к выполнению первой цепочки переходов.
2)Второй и третий переход проводите в этой же пробирке (№1). В пробирку №2 положен кусочек алюминия.
Опыт 2. Инструкция к выполнению второй цепочки переходов.
2)Для осуществления второй цепочки переходов выданы пробирки №3, №4. В обе пробирки прилейте по 1-2 мл раствора хлорида алюминия и получите в обеих пробирках студенистый осадок гидроксида алюминия (используйте 1-2 мл раствора реактива). В пр.№3 получите AlCl3, в пр.№4 получите NaAl(OH) 4
Составьте молекулярные и ионные уравнения реакций.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-362451
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
В 16 регионах ввели обязательную вакцинацию для студентов старше 18 лет
Время чтения: 1 минута
В Госдуме предлагают сделать бесплатным проезд на общественном транспорте для детей до 16 лет
Время чтения: 2 минуты
На новом «Уроке цифры» школьникам расскажут о разработке игр
Время чтения: 1 минута
ФИПИ опубликовал демоверсии ОГЭ и ЕГЭ 2022
Время чтения: 1 минута
Минпросвещения работает над единым подходом к профилактике девиантного поведения детей
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Взаимосвязь различных классов неорганических веществ
Рассмотрим её на нескольких примерах.
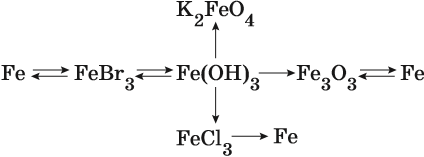
Пример 1. Взаимосвязь соединений железа.
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
Восстановление оксида железа (II) приводит к железу:
Пример 2. Взаимосвязь соединений железа.
Реакция железа с бромом приводит к бромиду железа (III):
Получить из этого соединения железо можно электролизом расплава:
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
Восстановлением оксида железа (III) можно получить железо:
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
Из хлорида железа (III) электролизом можно получить железо:
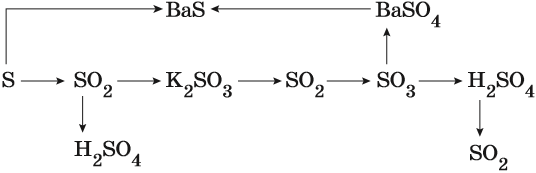
Пример 3. Взаимосвязь соединений серы.
Сера окисляется кислородом воздуха до оксида серы (IV):
Взаимодействие серы с водородом приводит к сероводороду:
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
Под действием сильных кислот сульфит калия разлагается до SO2:
Каталитическое окисление SO2 приводит к оксиду серы (VI):
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
Из сульфата бария восстановлением углём можно получить сульфид бария:
Восстановление SO2 приводит к сере:
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
4. SiO2 → Si → X → BaSiO3.