Зона репарации в желудке что это такое
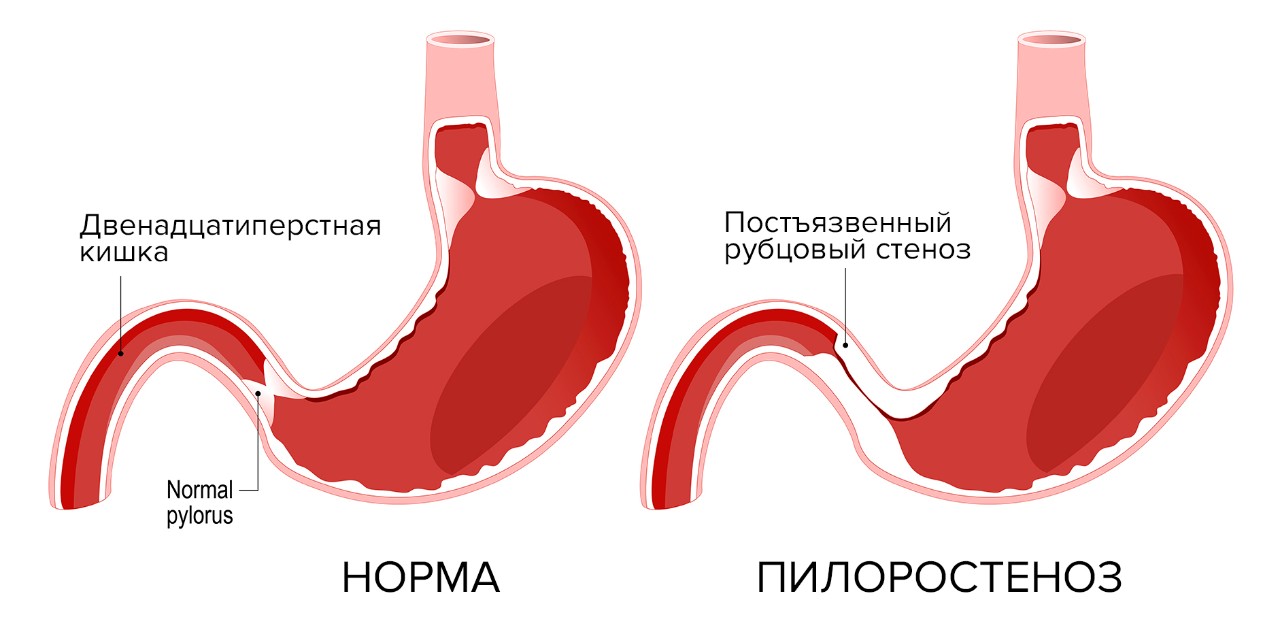
Пилоростеноз (высокая желудочно-кишечная непроходимость)
Главная угроза – полная невозможность прохождения пищи из желудка в нижележащие отделы ЖКТ и развитие истощения.
Постъязвенный рубцовый стеноз привратника (пилоростеноз) или двенадцатиперстной кишки – осложнение язвенной болезни выходного отдела желудка (пилорического отдела) или луковицы двенадцатиперстной кишки. На месте зажившей язвы образуется рубец, ткань в области рубца стягивается, прохождение пищи из желудка в двенадцатиперстную кишку затрудняется. Это место постоянно травмируется пищевыми массами, на него воздействует соляная кислота. Возникает хроническое воспаление, зона сужения прогрессирует, проход становится ещё уже. Затем развивается декомпенсация: пища проходит с большим трудом, желудок расширяется и теряет свою перистальтическую функцию. У пациентов с признаками декомпенсированной дуоденальной непроходимости желудок может достигать огромных размеров, пища перестает проходить дальше в кишку, процесс пищеварения останавливается. Возникает истощение.
Язва проявляется болями в брюшной полости. Это могут быть голодные боли или боли после еды. Сужение выходного отдела желудка проявляет себя тошнотой и чувством переполнения желудка после приёма пищи. В норме человек должен просыпаться утром с чувством голода, но пациент с высокой непроходимостью просыпается с чувством переполнения желудка. Декомпенсация стеноза характеризуется рвотой пищей, съеденной за 2-3 часа до этого. Декомпенсация – угрожающее жизни состояние, следует незамедлительно обратиться к врачу.
Для того, чтобы диагностировать постъязвенный рубцовый стеноз выходного отдела желудка, применяются компьютерная томография с водорастворимым контрастом и рентгенологическое исследование с водорастворимым контрастом или с барием. Чтобы понять, через какое время у пациента происходит эвакуация содержимого желудка в нижележащие отделы ЖКТ, врач даёт пациенту барий, делает рентгеновский снимок, и видит, куда барий распространился. Затем снимки делаются через 3, 6, 12 часов – это позволяет оценить динамику прохождения контраста и степень стеноза. В Ильинской больнице пациентам с подозрением на высокую кишечную непроходимость всегда выполняется эндоскопическая диагностика: с помощью эндоскопа врач точно локализует место стриктуры и определяет объем хирургической помощи.
Источник изображения: Designua / Shutterstock
Если степень желудочно-кишечной непроходимости не позволяет провести баллонную дилатацию, но серьёзной формы декомпенсации еще нет – хирурги Ильинской больницы выполняют пациенту лапароскопическую операцию – пилоропластику. Через небольшие разрезы на брюшной стенке (размером около 10 мм) в брюшную полость вводятся лапароскоп и хирургические манипуляторы. Одновременно через рот в просвет желудка вводится эндоскоп. С помощью лапароскопических инструментов хирург рассекает суженную зону двенадцатиперстной кишки и выходного отдела желудка в продольном направлении, а сшивает в поперечном, тем самым значительно расширяя место сужения и разрешая непроходимость. Второй хирург ассистирует ему из просвета желудка с помощью эндоскопа, обеспечивая максимальную безопасность манипуляций. Это малотравматичная операция, дающая устойчивый положительный эффект.
Рак желудка
Рак желудка незаметен на ранних этапах, так как симптомы заболевания проявляются в виде неприятного чувства в верхней части желудка, что можно спутать со множеством других недугов желудочно-кишечного тракта.
В условиях современного мира показатели по высокой смертности с диагнозом «рак желудка» активно снизились. Но это заболевание является наиболее опасным, как у мужчин, так и у женщин, несмотря на то, что первые болеют данным недугом довольно чаще.
Классификация рака желудка
Злокачественная опухоль в желудке может иметь несколько форм:
Согласно врачебным наблюдениям и клиническим рекомендациям представляется своя классификация по признакам:
Опухолевый процесс в кишечнике схож по строению с этим видом рака в желудке. Сама опухоль состоит из эпителия и имеет характерные железистые структуры. Важную роль в его появлении играют бактерии Хеликобактер пилори, которые и провоцируют рак желудка.
Возникновение этого вида заболевания характеризуется наследованием дефектного гена. При развитии данной формы онкологии образуется несколько опухолей внутри органа, появляются острые симптомы, и болезнь имеет быстрое течение.
Тенденция в современном мире показывает, что рак желудка, особенно такой как вид гистологической опухоли, как перстневидноклеточный рак, проявляется больше у женщин, чем у мужчин. Хотя показатели говорят о том, что проявление признаков опухолевого процесса в желудке свойственно больше мужчинам.
Стадии рака желудка
Международная классификация изучив симптомы и этапы развития заболевания, позволила создать общую группировку стадий заболевания, как рак желудка.
Симптомы рака желудка
Опасный недуг долго может не проявляться и симптомы выражены только чувством дискомфорта в верхней части желудка. Когда прорастание опухоли начинает проходить в ткани органа, где имеются нервные окончания, то болевые ощущения становятся более явными. Но такие признаки, как боль и дискомфорт могут быть распознаны, как симптомы других заболеваний.
При достижении опухолевого процесса симптомы заболевания становятся более выраженными:
Причины возникновения рака желудка
Причины проявления злокачественного образования многофакторные и способствуют развитию рака, как у женщин, так и у мужчин.
Важным фактором появления онкологии желудка является неправильное питание вредной пищи. Значительное употребление пищу мясных продуктов и соли.
Инфекционные факторы, включающие в себя наличие бактерий и вирусов также влияют на появление онкологии.
На развитие заболевания влияет образ жизни и эколгия. Плохая экология и работа на вредных производствах, употребление алкоголя и табака, ожирение.
Мутагенные процессы в связи с наследственностью также могут спровоцировать рак желудка.
Диагностика рака желудка
Диагностируется рак желудка изначально с помощью консультации специалиста, где выявляются симптомы и собирается общий и семейный анамнез.
Клинические рекомендации в дальнейшем предполагают проведение некоторых исследований с использованием эндоскопа для просматривания изменений внутри органа и взятия биоматериала для проведения гистологии и цитологии.
Ультразвуковые исследования и ренгенография позволяют обнаружить метастазы в других ближайших и отдаленных органах.
Брюшная лапароскопия представляет собой исследование полостей с помощью разреза под общим наркозом, что позволяет определить стадию заболевания и метастазирование в соседние органы.
Лечение рака желудка
Рак желудка лечится в зависимости от сложности опухолевого процесса и проявления признаков заболевания. С учетом возраста, сопутствующих недугов, а также определению места локализации опухоли, переносимости препаратов и индивидуальных особенностей организма подбирается схема лечения.
Когда рак желудка определяется на начальном этапе развития, то возможно удаление опухоли с помощью эндоскопа.
Если опухоль уже активно развивается, то происходит радикальное удаление опухоли вместе с органом, а также с лимфоузлами. Если метастазирование происходит в пищевод, кишечник и печень, то происходит резекция этих участков. Полное удаление желудка исключается, если есть возможность сохранить хотя бы четверть органа.
Для сохранения результата и избежания возможного рецидива применяется химиотерапия. Клиническими рекомендациями показано применение дооперационного и послеоперационного лечения. А при невозможности хирургического избавления от онкологии химиотерапия назначается в качестве режимного приема препаратов.
Когда симптомы сильно выражены и рак желудка метастазировал в отдаленные органы, то назначается паллиативное лечение. Его суть заключается в расширение просвета желудка для проходимости пищевода. Специальное устройство вводится с помощью эндоскопа в те места, где опухоль сдавливает стенки пищевода.
Для повышения эффективности химиотерапии и после удаления желудка назначается лучевая терапия.
Основные осложнения при раке желудка
Расстройство желудка, такие как постоянная тошнота и позывы к рвоте являются основным осложнением лечения онкологии желудка. Это связано с разрушением клеток слизистой оболочки. Такие симптомы удаляются с помощью противорвотных препаратов.
Сопутствуют этим признакам осложнение в виде жидкого стула. Это происходит из-за повреждения раковых клеток в прямом и тонком кишечнике. Для избавления диареи клиническими рекомендациями является обильное питье и инфузионная терапия в виде капельниц. Капельным способом также происходит лечение сопутствующей анемии.
Повреждения кожи в области стоп и ладоней появляется на фоне химиотерапии. Для лечения такого синдрома применяют сложные препараты на основе растительных компонентов в виде кремов и мазей. Восстановление кожных покровов происходит в долгий период, но процесс полностью обратим.
Профилактика рака желудка
Важным вопросом в лечении является питание. После хирургического вмешательства начинается голодание, и питательные вещества поступают через капельные вливания или зонд. Через рот пациент начинает потреблять пищу только тогда, когда наладиться устойчивая работа кишечника. Для пациентов подбирается определенная диета и желательно применение ферментов для лучшего переваривания пищи.
Рак желудка после лечения оставляет отголоски, но вернуться к наиболее комфортному уровню жизни возможно. Главное оценивать свое состояние, внимательно относится к болезненным ощущениям и чувству дискомфорта внутри организма, не игнорировать симптомы.
Тенденция в современном мире показывает, что рак желудка, особенно такой как вид гистологической опухоли, как перстневидноклеточный рак, проявляется больше у женщин, чем у мужчин. Хотя показатели говорят о том, что проявление признаков опухолевого процесса в желудке свойственно больше мужчинам.
Филиалы и отделения где лечат рак желудка
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Эндоскопическая диагностика при острых гастродуоденальных язвенных кровотечениях
В настоящее время эзофагогастродуоденоскопия (ЭГДС) является ведущим методом диагностики при желудочно-кишечных кровотечениях вообще и при гастродуоденальной геморрагии в частности. В данном разделе приводятся сведения о необходимом техническом обеспечении ЭГДС, выполняемой по поводу кровотечения, стандартной терминологии и классификациях, используемых для описания эндоскопической картины.
Учитывая то, что ЭГДС при гастродуоденальных кровотечениях проводится зачастую практически в экстремальных условиях, обусловленных тяжелым состоянием больного, экстренностью выполняемого исследования, возможными сложностями визуализации, необходимостью быстрого и точного выполнения диагностических и лечебных приемов у больного с продолжающейся геморрагией, а также известным грузом ответственности, возлагаемым на плечи врача-эндоскописта, к техническому оборудованию, используемому во время эндоскопии при ОГДЯК предъявляются повышенные требования к возможностям визуализации, манипуляционным и эргономическим качествам эндоскопического оборудования. Хотим обратить внимание еще на один немаловажный организационный момент. Эндоскопическое оборудование относится к разряду высокоточного и высокотехнологичного, а следовательно, весьма чувствительного к различного рода механическим повреждениям. Поэтому транспортировка самих оптических систем и вспомогательного оборудования в пределах стационара должна быть сведена к минимуму, что, в свою очередь, диктует необходимость наличия отдельной эндоскопической стойки (комплекса) непосредственно в отделении хирургической реанимации для проведения неотложных исследований.
Сегодня «золотым стандартом» визуализации при проведении эндоскопического исследования является использование видеоэндоскопов. Главное различие между видеоэндоскопом и стандартным фиброскопом заключается в способе получения изображения. Обычный фиброэндоскоп и видеоэндоскоп получают и передают оптическое изображение в форме света, передаваемого по пучку оптических волокон. При исследовании обычным фиброэндоскопом эндоскопист смотрит на изображение через окуляр, установленный на корпусе фиброскопа. В отличие от фиброскопа видеоэндоскоп конвертирует световое изображение в электрические сигналы, которые обрабатываются видеопроцессором в аналоговый видеосигнал и демонстрируются на мониторе. Необходимость в наличие окуляра при видеоэндоскопии отпадает, а визуализация изображения на мониторе делает проведение исследования удобным для эндоскописта, и, что самое главное, дает возможность одновременной оценки эндоскопической картины хирургом. Как правило, качество изображения и по объективным критериям (освещенность, цветовая гамма, контрастность, степень разрешения), и по субъективной оценке при видеоэндоскопическом исследовании намного выше, чем при обычной фиброэндоскопии, что является принципиальным при исследованиях во время кровотечения. Видеоэндоскоп может являться составной частью эндоскопической стойки (комплекса), а может быть создан в результате присоединения к обычному фиброэндоскопу видеоконвертора (по сути – видеокамеры). Так, фиброэндоскопы Pentax могут быть преобразованы в видеоэндоскопы присоединением аналоговой видеокамеры PSV-4000, фиброэндоскопы Olympus серии OES-40 могут быть преобразованы в видеоэндоскопы присоединением цифровых видеоконвекторов OVC-70 и OVC-140. В последних двух случаях речь идет об устройствах, преобразующих аналоговый видеосигнал в цифровой и позволяющих получить изображение с оптимальной яркостью, контрастностью, высоким разрешением, что делает возможной максимальную структурную детализацию объекта исследования, а также сохранять информацию в цифровом формате на носителях. В настоящее время в отечественной и зарубежной клинической практике при проведении эндоскопических исследований широко используются видеоэндоскопические системы, основу которых составляют видеоэндоскопы с цифровой системой передачи изображения: видеосистема Olympus V-70, видеоинформационная система Olympus EVIS Exera, видеосистемы Pentax 70K и Pentax 80K, Fujinon-RARMO (2200, 4400).
Манипуляционные свойства фибро- и видеоэндоскопов определяются их техническими характеристиками: углом поля зрения (указывает на размеры видимой через аппарат зоны), направлением обзора (прямой, косой и боковой обзор), диапазоном угла изгиба дистального конца (указывает на возможности эндоскопа по достижению неудобно расположенных зон обследуемой области), диаметром дистального конца (влияет на легкость и удобство введения эндоскопа), диаметром инструментального канала (определяет максимальный размер инструментов, пригодных к использованию с эндоскопом). При ЭГДС, проводимой по поводу гастродуоденального кровотечения, как правило, используются гибкие эндоскопы с торцевой оптикой (прямой обзор, 00), углом обзора не менее 1200, диапазоном угла изгиба дистального конца не менее 2100 вверх, 900 вниз, по 1000 вправо и влево. Диаметр дистального конца эндоскопа при проведении ЭГДС у взрослых принципиального значения не имеет и находится в прямой зависимости от диаметра инструментального канала. Данный параметр эндоскопа является при кровотечении особенно важным, поскольку определяет возможность применения того или иного инструмента для проведения эндогемостаза (инъектор, электрод электрокоагулятора, термозонд, световод лазера, зонд для аргоно-плазменной коагуляции, клиппатор). При гастродуоденальных кровотечениях применяются эндоскопы с диаметром инструментального канала не менее 2, 8 мм. В настоящее время в клинической практике при ОГДЯК используются следующие модели гастродуоденоскопов.
— фиброэндоскопы с диаметром инструментального канала 2, 8 мм: Olympus GIF-E (E3, XQ40) ; Pentax 29V (29W) ; Fujinon FG-1Z;
— видеоэндоскопы с диаметром инструментального канала 2, 8 мм: Olympus GIF-160 (Q160, 160Z) ; Pentax FG-2770K; Fujinon EG-490WR5 (450CT5), FG-1Z;
— фиброэндоскопы с диаметром инструментального канала 3, 8 мм: Pentax FG-34W; Fujinon FG-100CT;
— видеоэндоскопы с диаметром инструментального канала 3, 8 мм: Olympus GIF-1Т30; Pentax FG-2970 (80) K; Fujinon EG-450CT5;
Кроме того, могут применяться видеоэндоскопы с двумя инструментальными каналами (2, 8 и 3, 8 мм): Olympus GIF-2T160, Fujinon EG-450D5 и сверхширококанальные эндоскопы с диаметром инструментального канала более 5 мм.
Следует отметить, что применение самых совершенных технических средств в эндоскопии может быть достаточно эффективным лишь при наличии возможности объективной регистрации результатов эндоскопической диагностики и лечения, а также их оценки. Использование стандартизованной эндоскопической терминологии, способов формализованной регистрации результатов эндоскопического исследования позволяет не только существенно уменьшить число диагностических ошибок, но и сократить время выполнения эндоскопического исследования. Это также повысит эффективность работы врача-клинициста, уменьшив вероятность постановки неверного клинического диагноза и, как следствие, назначения неправильного лечения.
Русский язык неповторимо богат многозначностью своих определений, что дает ощущение наслаждения читателю поэтической лирики, но в то же время нередко ставит в крайне затруднительное положение хирурга, пытающегося представить истинное положение дел по протоколу эндоскопического исследования. Так, при описании только факта кровотечения можно встретить такие понятия как «потоком», «струйное», «массивное», «профузное», «фонтанирующее», «активное» (термина «пассивное кровотечение», к счастью, встречать не доводилось). Весьма неприятным следствием разночтений в анатомической терминологии могут явиться серьезные затруднения в интраоперационной топической диагностике язвы, вплоть до необходимости повторной ЭГДС уже на операционном столе. Очевидно, аналогичная ситуация сложилась не только в русскоговорящих регионах, поэтому с начала 1990-х годов представителями Европейского общества гастроинтестинальной эндоскопии (ESGE), Американского общества гастроинтестинальной эндоскопии (ASGE) и Всемирной организации эндоскопии пищеварительной системы (OMED) проводилась работа по созданию единой унифицированной эндоскопической терминологии. В настоящее время мировым эндоскопическим (равно как хирургическим и гастроэнтерологическим) сообществом в повседневной клинической практике используется вторая версия Международной стандартной терминологии в эндоскопии. Весь свод терминологии достаточно объемен, поэтому приведем лишь разделы, касающиеся проблемы гастродуоденальных язвенных кровотечений.
Таблица. Анатомические отделы, используемые для топографического описания результатов эндоскопического исследования верхнего отдела пищеварительного тракта.
Возможность проведения терапии нестероидными противовоспалительными препаратами у пациентов с эрозивно-язвенным поражением гастродуоденальной зоны
В настоящее время практикующий клиницист любой специальности располагает обширным информационным материалом о побочных эффектах наиболее востребованной группы лекарственных средств – нестероидных противовоспалительных препаратов (НПВП). Хорошо известно, что наиболее характерным и частым побочным эффектом при применении данного класса препаратов является токсическое воздействие традиционных НПВП на слизистую оболочку пищеварительной трубки, в подавляющем большинстве случаев проявляющееся развитием эрозивно-язвенного процесса в гастродуоденальной зоне, так называемой НПВП-индуцированной гастропатии. Помимо индукции острых эрозий и язв на ранее неизмененной слизистой гастродуоденальной зоны, применение традиционных НПВП может способствовать обострению язвенной болезни и формированию одного из морфологических субстратов данного страдания – типичной хронической язвы.
Прежде всего, считаем необходимым уточнить некоторые нюансы терминологии и, что уже более существенно, особенности патогенеза хронических и НПВП-индуцированных гастродуоденальных язв, связанные с применением традиционных нестероидных препаратов. НПВП-индуцированная и хроническая язвы, как с точки зрения патогенеза, так и с точки зрения патоморфологии (рис. 1) являются проявлением двух различных нозологических единиц: в первом случае – НПВП-индуцированной гастропатии, во втором – язвенной болезни желудка и двенадцатиперстной кишки (ДПК).
И если в первом случае НПВП являются эксклюзивным этиологическим фактором ульцерогенеза, то во втором случае НПВП является лишь одним из множества факторов, вызывающих возникновение типичной хронической (пептической) язвы желудка или ДПК. Действительно, доказана связь приема НПВП и обострения язвенной болезни. В то же время утверждать, что «прием НПВП ведет к возникновению пептических язв желудка и ДПК» по своей сути неверно, поскольку генетически детерминированное хроническое страдание – язвенная болезнь, этиологически связанное с персистенцией НР, гиперпродукцией соляной кислоты, дисциркуляцией в подслизистом слое и с рядом других факторов, очевидно, не может являться исключительным следствием терапии нестероидными препаратами.
Тем не менее, механизм токсического действия традиционных НПВП на слизистую гастродуоденальной зоны как при НПВП-гастропатии, так и при язвенной болезни одинаков. Традиционные НПВП в одинаковой степени блокируют ЦОГ-2, редуцируя локальную или системную воспалительную реакцию, и ЦОГ-1 в слизистой пищеварительной трубки, уменьшая репаративный потенциал слизистой за счет снижения секреции слизи, бикарбонатов, уменьшении перфузии слизисто-подслизистого слоя и активности пролиферации камбиальных элементов желудочных ямок. Соляная кислота, пепсин, желчные кислоты и экзогенные альтерирующие агенты являются производящими факторами, которые и вызывают локальный некроз незащищенной слизистой оболочки и глубжележащих слоев желудочной и дуоденальной стенки. Очевидно, что токсическое действие традиционных НПВП с большей вероятностью реализуется либо на измененной слизистой пищеварительной трубки (хронический гастрит, тип В и С), либо при гиперпродукции соляной кислоты (язвенная болезнь). Взаимоотношения НР и НПВП в механизме ульцерогенеза остаются предметом дискуссий. Так, Л.И. Аруин и В.А. Исаков (1998), постулируя ведущую роль нарушений апоптоза в генезе воспалительно-некротических процессов в гастродуоденальной слизистой, указывают, что как при персистенции НР, так и во время терапии НПВП резко возрастает количество апоптозов в поверхностном эпителии слизистой [1], то есть отмечается синергизм двух данных факторов. В данном контексте позволим себе заметить, что персистенция НР и воздействие НПВП индуцируют два различных типовых патологических процесса: в первом случае – хроническое воспаление, во втором – дистрофию и некроз. В исследовании А.Е. Каратеева и соавт. (2002) показано, что эрадикационная в отношении НР терапия существенно не влияет на возникновение и течение НПВП-индуцированных язв и, следовательно, проведение антигеликобактерной терапии больным с эрозивно-язвенными изменениями слизистой оболочки желудка и двенадцатиперстной кишки, возникшими на фоне приема НПВП, нецелесообразно [4].
Таким образом, токсическое действие традиционных НПВП на слизистую пищеварительного тракта является клинически доказанным и обоснованным с точки зрения фундаментальной медицины фактом. При этом вероятность развития эрозивно-язвенного поражения при терапии НПВП зависит от исходного состояния слизистой, активности производящих повреждение факторов, а также от интенсивности и длительности самой терапии. Очевидно, что при уже имеющемся эрозивно-язвенном процессе в гастродуоденальной зоне вне зависимости от его этиологии продолжение терапии традиционными НПВП не только поддерживает существование эрозий и язв, но и способствует прогрессированию язвенного процесса с закономерным развитием осложнений в виде кровотечения и перфорации. Тем не менее, существует группа больных, нуждающихся в продолжении терапии НПВП, несмотря на верифицированные гастродуоденальные эрозии и язвы или высокий риск язвообразования.
Решение данной проблемы следует разделить на две составляющие: проведение противоязвенной терапии и подбор НПВП, не оказывающего токсического воздействия на пищеварительный тракт. Первая составляющая решения наименее дискутабельна: при любом эрозивно-язвенном поражении гастродуоденальной зоны показано назначение антисекреторных препаратов и антацидов. Возможно включение в терапию гастропротекторов и прокинетиков [6]. В отношении хронических гастродуоденальных язв практически законодательно закреплена необходимость проведения эрадикационной в отношении НР терапии в том или ином варианте. При выборе антисекреторного препарата следует учитывать, что М1-холинолитики и Н2-блокаторы в настоящее время представляют скорее исторический интерес, данные классы антисекреторных средств не влияют на репарацию НПВП-индуцированных язв [3,6,7,12,13,20,22]. Препаратами выбора при проведении антисекреторной терапии являются ингибиторы протонной помпы (ИПП) – омепразол, рабепразол, эзомепразол. Сложнее обстоит дело с второй составляющей решения – выбором конкретного НПВП для продолжения терапии в условиях эрозивно-язвенного процесса. До сих пор в литературе можно встретить следующие рекомендации: «В тех случаях, когда нельзя отменить НПВП, целесообразно, если позволяет состояние больных, уменьшить дозировку этих средств или перевести больных на менее «ульцерогенные» препараты» [2]. Как выполнить подобную рекомендацию, если состояние больных часто не позволяет уменьшить дозировку НПВП, а понятие «менее ульцерогенные НПВП» в справочниках лекарственных препаратов отсутствует?! Из традиционных НПВП, облигатно обладающих дозозависимой гастротоксичностью [9,10,12,13,15,17], этот выбор возможен лишь теоретически. Принципиально изменилась ситуация с внедрением в клиническую практику препаратов класса коксибов (целекоксиб, рофекоксиб), селективно ингибирующих ЦОГ-2 и не влияющих на ЦОГ-1, то есть не оказывающих токсического действия на слизистую пищеварительного тракта. Многие отечественные авторы расширяют спектр безопасных в отношении пищеварительного тракта НПВП, выделяя «специфические» ингибиторы ЦОГ-2 (коксибы), «преимущественно селективные» ингибиторы ЦОГ-2 (мелоксикам, нимесулид) и неселективные НПВП. Данная градация, не лишенная некоторого лукавства (попробуйте с точки зрения лексикологии четко разграничить два первых термина), сложна для однозначного восприятия, особенно в рассматриваемой клинической ситуации, когда необходимо однозначное заключение: безопасен препарат или нет. В классификации американской Food and Drugs Administration (FDA) все НПВП разделены только на две группы: 1) селективные в отношении ЦОГ-2 НПВП и 2) неселективные НПВП. К первой группе отнесены препараты из группы коксибов, ко второй группе – все остальные НПВП. Таким образом, с точки зрения FDA только коксибы в полной мере можно считать безопасными в отношении пищеварительного тракта НПВП. Аналогичной точки зрения придерживается и European Agency for the Evaluation of Medicinal Products (EMEA) (см. табл. 1). Следует заметить, что альтернативная и по-настоящему клиническая классификация НПВП, принятая в организациях, наиболее щепетильных в отношении контроля качества и безопасности лекарственных препаратов, базируется на результатах многочисленных клинических исследований, доказавших отсутствие риска желудочно-кишечных осложнений при приеме целекоксиба, в том числе СLASS, SUCCESS, ARAMIS [5,7,14,15,17,18,19,20,21].
Таблица. 1. Классификация НПВП по версии Food and Drugs Administration и European Agency for the Evaluation of Medicinal Products [24,25].
ЦОГ-2 селективные НПВП
Неселективные НПВП
Классификация FDA*
Коксибы (целекоксиб, рофекоксиб, эторикоксиб)