Гмк что это в медицине
Гмк что это в медицине
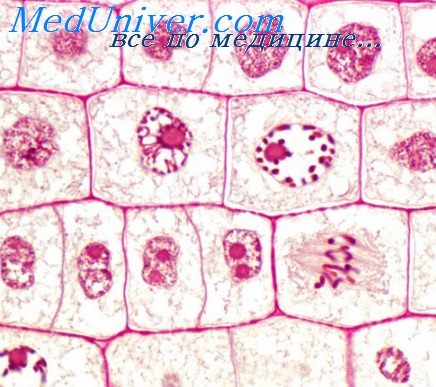
Поражение сердца или кровеносных сосудов индуцирует процесс ремоделирования, который при нормальных условиях является путем адаптации, а с точки зрения патофизиологии заболевания выступает как звено дезадаптации. В ответ на физиологические стимулы сосудистые гладкомышечные клетки (ГМК) медии пролиферируют и мигрируют в интиму, где формируется многослойное сосудистое поражение, или неоинтима.
В норме этот процесс самоограничен, поэтому в результате образуется хорошо зарубцевавшаяся рана, а кровоток не изменяется. Однако при определенных сосудистых заболеваниях пролиферация сосудистых ГМК становится избыточной, в результате развивается патологическое поражение сосудистой стенки, и появляются клинические симптомы. Для этих заболеваний обычно характерно системное или локальное воспаление, усугубляющее пролиферативную реакцию сосудистых ГМК. Ингибиторы CDK семейства CIP/ KIP — важнейшие регуляторы ремоделировапия тканей сосудистой системы. Белок p27(Kipl) конститутивно экспрессирован в сосудистых ГМК и эндотелиальных клетках артерий.
При сосудистом поражении или воздействии митогенов на сосудистые ГМК и эндотелиальные клетки его активность угнетается. После всплеска пролиферации сосудистые ГМК синтезируют и секретируют молекулы внеклеточного матрикса, которые, передавая сигнал сосудистым ГМК и клеткам эндотелия, стимулируют активность белков p27(Kipl) и p21(Cip1) и подавляют циклин E-CDK2. Экспрессия CIP/KIP ингибиторов CDK останавливает клеточный цикл и тормозит деление клеток. Белок p27(Kipl), благодаря своим эффектам на пролиферацию Т-лимфоцигов, выступает и в роли важнейшего регулятора процессов воспаления тканей. В кровеносной системе белок p27(Kipl), регулируя процессы пролиферации, воспаления и образования в костном мозге клеток-предшественников, участвует в заживлении сосудистых повреждений.
В опытах на мышах было показано, что деления в гене p27(Kip1) сопровождается доброкачественной гиперплазией эпителиальных и мезодермальных клеток во многих органах, включая сердце и сосуды.
Белок p21(Cipl) необходим для роста и дифференцировки клеток сердца, костей, кожи и почек; кроме того, он обеспечивает восприимчивость клеток к апоптозу. Этот ингибитор CDK функционирует как р53-зависимым, так и р53-независимым путем. В сердце p21(Cipl) экспрессируется независимо от наличия р53 в кардиомиоцитах; избыточная экспрессия p2l(Cip1) в миоцитах приводит к гипертрофии миокарда.
Большинство раковых клеток человека несут мутации, изменяющие функции р53, Rb либо путем прямой модификации их генетической последовательности, либо путем воздействия на гены-мишени, которые, действуя эпистатически, т.е. подавляя проявление других генов, препятствуют их нормальному функционированию. Белок Rb ограничивает пролиферацию клеток, препятствует их переходу в S-фазу. Механизм состоит в блокировании факторов транскрипции E2F генов-активаторов, необходимых для репликации ДНК и метаболизма нуклеотидов. Мутации в белке р53 встречаются более чем в 50% всех случаев рака у человека.
Белок р53 накапливается в ответ на клеточный стресс, обусловленный повреждениями ДНК, гипоксией и активацией онкогенов. Белок р53 инициирует программу транскрипции, которая запускает остановку клеточного цикла или апоптоз. Под действием р53 белок p21(Cipl) индуцирует апоптоз в опухолевых и других клетках.
Основной функцией клеточного цикла является регуляция процесса деления клеток. Репликация ДНК и цитокинез зависят от нормального функционирования клеточного цикла. Циклины, CDK и их ингибиторы рассматривают как вторичные важнейшие регуляторы процессов карциногенеза, воспаления тканей и заживления ран.
Современные основы диагностики и коррекции атерогенных дислипопротеидемий
Конец ХХ века ознаменовался крупными достижениями в лечении атеросклероза. Это связано в основном с успешной коррекцией дислипопротеидемий (ДЛП), которые являются патогенетическим звеном атерогенеза и одним из главных факторов риска коронарной (ишемическ
Конец ХХ века ознаменовался крупными достижениями в лечении атеросклероза. Это связано в основном с успешной коррекцией дислипопротеидемий (ДЛП), которые являются патогенетическим звеном атерогенеза и одним из главных факторов риска коронарной (ишемической) болезни сердца (КБС).
В процессе атерогенеза в стенке артерий происходит накопление и отложение холестерина (ХС), что во многом определяет начальные этапы и дальнейшее развитие атеросклероза. Вместе с тем имеются веские основания полагать, что в основе данной патологии лежит не само по себе повышение уровня ХС в сыворотке (плазме) крови, то есть не «гиперхолестеринемия» как таковая. Точнее было бы сказать, что развитие заболевания определяется типом и концентрацией в крови липопротеидных частиц, транспортирующих ХС, и зависит от судьбы этих частиц в кровотоке и артериальной стенке.
Помимо ХС в состав липопротеидов входят другие липидные компоненты и аполипопротеины (апо) разных классов. Холестерин свободный и в виде эфиров и триглицериды (ТГ) являются компонентами как атерогенных, так и неатерогенных липопротеидов. Атерогенные липопротеиды низких плотностей отличаются от антиатерогенных липопротеидов высокой плотности (ЛВП) по белковому составу: основным апобелком липопротеидов низкой и очень низкой плотности (ЛНП и ЛОНП) является апо В, которого нет в ЛВП, а основным белковым компонентом ЛВП — апо А. Определение в сыворотке крови уровня апо А и апо В позволяет с высокой степенью достоверности оценить уровень липопротеидов высокой и низкой плотности; однако на практике проведение количественного измерения этих апобелков для большинства клинических лабораторий пока недоступно.
Содержание каждого класса липопротеидов с достаточной для клинической практики степенью достоверности характеризуется уровнем входящего в их состав холестерина. Известно, что ЛОНП служат основным транспортером триглицеридов, а содержание ХС ЛОНП рассчитывается по формуле
ХС ЛОНП (ммоль/л) = ТГ (ммоль/л)/2,2 или ХС ЛОНП (мг/дл) = ТГ (мг/дл)/5.
Уровень ХС ЛВП определяется в плазме или сыворотке крови после осаждения апо В-содержащих липопротеидов низких плотностей. После измерения уровней общего ХС, ТГ и ХС ЛВП (липидной триады) рассчитывают уровень ХС, входящего в состав наиболее атерогенных ЛНП по формуле Фридвальда:
ХС ЛНП = общий ХС — ТГ/2,2 — ХС ЛВП (при расчете в ммоль/л) или ХС ЛНП = общий ХС — ТГ/5 — ХС ЛВП (при расчете в мг/дл).
Липопротеиды различных классов обладают разным атерогенным потенциалом. В развитии атеросклероза большую роль играет проникновение в артериальную стенку из кровотока ЛНП, липопротеидов промежуточной плотности (ЛПП), подфракции мелких частиц липопротеидов ЛОНП. Чем выше содержание в сыворотке крови этих липопротеидов, тем выше риск атеросклероза и связанных с ним заболеваний. Подфракции крупных частиц ЛОНП и хиломикроны не проникают в артериальную стенку из-за большого размера частиц, поэтому не считаются атерогенными.
В настоящее время твердо установлено, что не только гиперхолестеринемия (повышенный уровень в крови ЛНП), но и гипертриглицеридемия, то есть повышенное содержание липопротеидов, обогащенных триглицеридами, ассоциируется с преждевременным развитием коронарного атеросклероза.
Гиперхолестеринемия и гипертриглицеридемия могут быть вторичными по отношению к ряду заболеваний (сахарный диабет, хроническая почечная недостаточность и нефротический синдром, гипотиреоз, алкоголизм и др.). ДЛП является одним из четырех основных компонентов высокоатерогенного метаболического синдрома. В этих случаях выявление и коррекция ДЛП необходимы для диагностики и лечения этих состояний.
Антиатерогенные ЛВП рассматриваются как показатель сниженного риска атеросклероза: чем ниже содержание в крови ЛВП и холестерина, входящего в их состав (ХС ЛВП), тем выше риск развития КБС. ЛВП обладают несколькими механизмами защиты от атеросклероза. В первую очередь, это участие их в обратном транспорте холестерина, когда частицы ЛВП захватывают ХС с мембран клеток, в том числе и артериальных, и транспортируют его в печень, где он превращается в желчные кислоты и выводится из организма. Эта способность ЛВП считается их основным физиологическим свойством. Кроме того, ЛВП препятствуют развитию атеросклероза благодаря своим антиоксидантным, антивоспалительным, антиагрегаторным и профибринолитическим свойствам. Низкий уровень ЛВП ассоциируется с «атерогенным» образом жизни, так как ХС ЛВП снижается при курении, ожирении, гиподинамии.
Среди практикующих врачей общепринятым стало мнение, что прогноз развития атеросклеротических заболеваний для пациента, у которого значительная доля ХС входит в состав ЛВП, отличается от прогноза для больного с таким же уровнем общего ХС, который, однако, распределен преимущественно в ЛНП, а доля ХС ЛВП низка.
В настоящее время появляется все больше информации о практических достижениях в области коррекции липидных нарушений. Это в значительной мере обусловлено созданием новых мощных гиполипидемических лекарственных препаратов, к разработке которых подталкивает понимание того, что современный крайне неблагоприятный образ жизни способствует повышению риска развития сердечно-сосудистых заболеваний (ССЗ), включая КБС. Независимо от уровня ХС увеличение массы тела способно изменять процессы метаболизма липопротеидов и приводить к потенциально атерогенным отклонениям в спектре липопротеидов. Иными словами, диагностика и коррекция ДЛП, которая основывается на понимании роли липопротеидов в атерогенезе и влияния образа жизни на их метаболизм, представляют собой намного более адекватный подход к профилактике атеросклероза, нежели лечение, нацеленное только на коррекцию уровня ХС.
Немаловажным в патогенезе атеросклероза является тот факт, что характер ДЛП оказывает мощное влияние на состояние сосудистого эндотелия: повышенное содержание ХС в ЛНП и ЛОНП вызывает нарушение ответа эндотелия на действие эндотелий-зависимых вазодилятаторов, тогда как ЛВП обладают противоположным действием. Более того, оказалось, что, если животным отменить питание, индуцирующее гиперхолестеринемию, функция эндотелия восстанавливается. Можно полагать, что и у людей гипохолестеринемическая диета будет сопровождаться коррекцией эндотелиальной дисфункции.
Каковы же механизмы, обусловливающие нарушение нормального функционирования эндотелия кровеносных сосудов при ДЛП? Для комбинированной ДЛП, то есть при увеличении концентрации как ЛНП, так и ЛОНП (общего ХС и ТГ), характерно накопление в крови мелких, плотных, модифицированных, чаще всего окисленных частиц ЛНП. Такие частицы вызывают дисфункцию эндотелия. Попадая в субэндотелиальное пространство, мелкие ЛНП подвергаются дальнейшему окислению, захватываются макрофагами и таким образом участвуют в образовании пенистых клеток, которые являются неотъемлемым компонентом атероматозной бляшки.
Химически модифицированные липопротеиды (окисленные, гликозилированные и др.) способны запускать аутоиммунный ответ. Это сопровождается формированием ЛНП-содержащих аутоиммунных комплексов, которые, в свою очередь, активируют макрофаги и повреждают эндотелиальные клетки. Кроме того, модифицированные ЛНП (и содержащие их иммунные комплексы) эффективно стимулируют выброс или секрецию моноцитами или образовавшимися из них макрофагами повышенного количества цитокинов, таких, как фактор некроза опухоли-альфа (TNF-α) и интерлейкин 1-бета (IL-1β). Патогенетический потенциал такой стимуляции в ускоренном атерогенезе огромен. Цитокины индуцируют адгезию лейкоцитов к эндотелиальным клеткам, способствуют синтезу и секреции эндотелием соединений, обладающих прокоагулянтными свойствами, а также факторов роста, способствующих пролиферации гладкомышечных клеток (ГМК).
Пролиферация ГМК считается одной из наиболее ярких характеристик развития атеросклеротического поражения. Было показано, что в условиях in vitro промежуточные продукты, образующиеся при синтезе ХС (изопреноиды), стимулируют рост и миграцию в интиму этих клеток. Поэтому лекарственные препараты, блокирующие синтез ХС на этапе образования мевалоната (ингибиторы ГМГ-КоА редуктазы), угнетают пролиферацию ГМК и таким образом могут независимо от действия на липопротеиды влиять на развитие атеросклероза и ИБС.
Модифицированные ЛНП оказывают хемотаксический эффект на моноциты, способствуя их прилипанию к эндотелию. Модифицированные ЛНП тормозят пролиферацию эндотелиальных клеток, которая представляет собой механизм восстановления поврежденного эндотелия. В противоположность этому ЛВП, наоборот, стимулируют пролиферацию эндотелия и способствуют нормализации его функций.
Имеются данные о том, что модифицированные ЛНП усиливают секрецию эндотелина-1, тормозят активность NO-синтазы и тем самым провоцируют спазмирование артерий. При повышенном уровне ХС ЛНП нарушается продукция простациклина — мощного вазодилятатора и ингибитора агрегации тромбоцитов; в то же время ЛВП усиливают его синтез и секрецию. Модифицированные ЛНП снижают активность фибринолиза, ингибируя секрецию эндотелиальными клетками тканевого активатора плазминогена (ТАП), стимулируя продукцию этими же клетками ингибитора ТАП (ИТАП-1) и усиливая таким образом тромбообразование.
Особенно атерогенной формой ЛНП является липопротеид (а) [ЛП (а)], состоящий из ЛНП и специфического апопротеина (а). Апо (а) по своей структуре в значительной мере подобен плазминогену. Предполагается, что ЛП (а), связываясь с рецепторами для плазминогена на поверхности эндотелия, конкурентно ингибирует превращение плазминогена в плазмин, что также способствует тромбообразованию.
Нарушением метаболизма липопротеидов можно объяснить ряд изменений в системе гемостаза, усугубляющих атеротромбоз. Процесс свертывания крови вызывается происходящей на клеточной поверхности активацией фактора VII, что имеет место при пищевой липидемии и усиливается при увеличении в плазме концентрации насыщенных жирных кислот. В результате активации фактора VII усиливается синтез фибриногена, индуцирующего агрегацию тромбоцитов и образование фибринового сгустка.
Таким образом, накопленные к настоящему времени фундаментальные знания о метаболизме липопротеидов служат основой как для проведения более дифференцированной диагностики атерогенных ДЛП, так и для разработки эффективных схем коррекции липидных нарушений, что позволяет достичь поставленных задач при лечении различных категорий пациентов, относящихся к группе высокого риска.
Исходя из этого, группа экспертов трех Европейских научных обществ, объединяющих специалистов в области сердечно-сосудистых заболеваний (по изучению гипертонии, атеросклероза и общества кардиологов), разработала методику коррекции факторов риска, прежде всего ГЛП и артериальной гипертонии, с использованием данных по оценке суммарного риска развития острых эпизодов (осложнений) КБС в ближайшие 10 лет.
Суммарный риск рассчитывается по прогностическим программам, составленным на основании данных проспективного наблюдения за заболеваемостью и смертностью в больших выборках населения, обследованных первично на наличие и уровень возможных факторов риска КБС. Суммарный риск рассчитывается либо по таблицам, опубликованным в зарубежной и отечественной литературе, так называемым специальным «счетчикам риска», выпускаемым рядом фармацевтических компаний, либо с помощью компьютерных программ, например подготовленной немецкими исследователями программы, созданной на основании эпидемиологического проспективного исследования программы PROCAM.
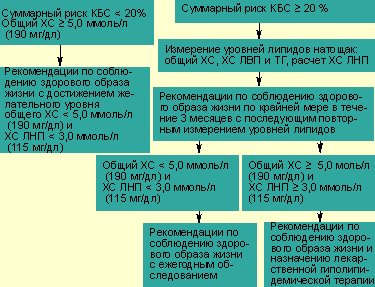 |
| Схема показаний к лечению гиперхолестеринемии с учетом уровня общего холестерина и суммарного коронарного риска (риска КБС) |
Тактика коррекции ДЛП строится исходя из уровня липидов (в основном общего ХС и ХС ЛНП) и из значений суммарного риска КБС каждого пациента (см. схему). При суммарном риске менее 20% предпочтительна немедикаментозная коррекция ДЛП, то есть оздоровление образа жизни по трем направлениям: гиполипидемическая диета, отказ от курения, физическая активация. При суммарном риске более 20% наряду с методами коррекции образа жизни решается вопрос о медикаментозном лечении ДЛП.
Состояние здоровья человека напрямую зависит от количества данных форменных элементов. Для того чтобы определить их количество, назначают общий анализ крови. С помощью полученных результатов можно наблюдать течение болезни и характер воспалительных процессов, которые могут протекать в организме. Также общий анализ крови назначают при появлении таких симптомов, как усталость, постоянные головные и мышечные боли, утомляемость.
Для чего назначают общий анализ крови?
Кровь в организме человека выполняет ряд важных функций, поэтому ее состав очень информативен при диагностике возможных заболеваний. Чаще всего во время планового обследования назначается общий анализ крови. При подозрительных результатах назначается развернутый биохимический анализ.
Процедура сдачи общего анализа крови
Перед визитом в клинику не рекомендовано принимать пищу. Также в течение нескольких дней следует прекратить прием медикаментов (только по рекомендации врача). Процедура проводится утром. Забор крови делают из пальца или вены.
Таблица – Нормы общего анализа крови для взрослых
Из таблицы выше следует что, нормы анализа крови у мужчин и женщин отличаются. Во время беременности также изменяются показатели анализа крови.
Гемоглобин
Гемоглобин – это белок, в составе которого имеются ионы железа. Он отвечает за дыхательную функцию крови и производит газообмен между клетками организма.
Если у человека обезвоживание организма, сердечная недостаточность; имеются проблемы с пищеварением, вследствие чего была рвота и диарея – то анализ покажет пониженный уровень гемоглобина.
При повышенном уровне речь идет о закупорке сосудов за счет того, что кровь становится гуще. Из-за этого образуются тромбы, что повышает риск развития сердечно-сосудистых заболеваний.
После рассмотрения результатов анализов должно быть подобрано соответствующее лечение для улучшения показателей. Самолечение в данном случае недопустимо.
Эритроциты
Если человек испытывает стресс, сидит на изнуряющих диетах, которые сочетаются с высокими физическими нагрузками, то уровень эритроцитов будет понижен.
Для коррекции происходящих в организме нарушений назначаются лекарства. Препарат должен быть подобран врачом с учетом результатов проведенных исследований и особенностей организма пациента.
Если при расшифровке биохимического анализа крови СОЭ выше нормы, то это говорит о том, что в организме идут инфекционные и воспалительные процессы, также возможны онкологические заболевания.
Снижение уровня СОЭ свидетельствует о болезнях, сопровождающиеся изменениями формы эритроцитов, например серповидно-клеточная анемия.
Лейкоциты
В норме общее количество лейкоцитов в крови находится в диапазоне 4х109/л до 1,1х1010 /л. Лейкоциты – это форменные элементы крови. Если количество выше нормы, то это указывает на то, что в организме происходит воспалительный процесс. Причины повышения лейкоцитов могут быть следующие: острые инфекции, онкологические заболевания, острое и хроническое воспаление.
Чтобы осуществить подсчет процентного соотношения лейкоцитов разных видов в лабораторной диагностике используют лейкоцитарную формулу. Если из результатов биохимического анализа крови видно, что идет сдвиг лейкоцитарной формулы влево, это значит, что в крови находятся незрелые нейтрофилы. Хотя в норме они должны быть только в костном мозге.
Тромбоциты
Образование тромбоцитов идет в красном костном мозге. Норма у женщин составляет 170,0-320,0х109/л и у мужчин 180,0-320,0х109/л.Туберкулез, рак печени и почек, острые инфекции, отравления, стресс провоцируют повышенное содержание тромбоцитов при расшифровке общего анализа крови.
Пониженное содержание тромбоцитов при расшифровке анализа наблюдается при частом приеме лекарственных препаратов. Низкий уровень тромбоцитов наблюдается также у людей, страдающих алкоголизмом. Если при расшифровке показателей анализа у женщин наблюдается низкий уровень тромбоцитов, то это может говорить о затяжных менструациях.
Гематокрит
При расшифровке биохимического анализа крови особое место выделяют такому показателю, как гематокрит. Он указывает на отношение объема клеток крови к общему объему крови и выражается в процентах.
У женщин низкий уровень гематокрита может говорить о наступлении беременности. Биохимические исследования крови являются важным показателем при установке диагноза пациента и назначении лечения. Сдавать общий анализ крови рекомендовано не только при возникновении недомоганий, но и в целях диагностики организма на отсутствие болезней.
Интерпретация полученных результатов проводится на приеме у врача, который назначил анализ. Специалист учитывает половую принадлежность и возраст пациента. На основании полученных данных врач разрабатывает индивидуальную схему лечения.
Самостоятельная расшифровка полученных результатов может привести к получению ложного представления о диагнозе. Без определенных знаний невозможно определить состояние здоровья даже при наличии результатов анализа крови. Доверяйте расшифровку результатов лабораторных исследований опытным специалистам.
Гипервентиляционный синдром и дисфункциональное дыхание
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях дыхания, относят 1871 год, когда Да Коста (Da Costa Jacob, 1833–1900), американский врач, принимавший участие в Гражданской войне США, применил термин «гипервентиляционый синдром» (ГВС) у пациентов с так называемым «солдатским сердцем». С тех пор для характеристики дыхательных расстройств предлагались различные альтернативные определения: «дыхательный невроз», «нейрореспираторная дистония», «респираторный синдром», «респираторная дискинезия», «идиопатическая гипервентиляция», «нейрореспираторный синдром», «неустойчивое дыхание» и др. Однако указанные термины не получили широкого признания. Они являются достаточно общими и не отражают особенностей нарушений дыхания у конкретного больного [4]. Перечисленные определения нередко связывают с понятием «непонятная одышка» (unexplained dyspnea).
ГВС встречается в 6–11% от числа пациентов общей практики. Соотношение мужчин и женщин составляет 1:4, 1:5; чаще наблюдается в 30–40 лет, но возможно развитие в других возрастных группах, включая детей и пожилых. L. Lum (1987) подчеркивал, что «каждый врач в течение недели может встретить хотя бы одного больного с ГВС». Врачи различных специальностей — невропатологи, кардиологи, пульмонологи, психиатры — могут наблюдать у своих пациентов явления гипервентиляции. Острое течение ГВС встречается значительно реже, чем хроническое, и составляет лишь 1–2% от общего числа больных [2, 6, 7].
Причины развития ГВС довольно многочисленны. Это неврологические и психические расстройства, вегетативные нарушения, болезни органов дыхания, некоторые заболевания сердечно-сосудистой системы, органов пищеварения, экзогенные и эндогенные интоксикации, лекарственные средства (салицилаты, метилксантины, β-агонисты, прогестерон) и др. Считается, что в 5% случаев ГВС имеет только органическую природу, в 60% случаев — только психогенную, в остальных — комбинации этих причин [6].
Важной особенностью развития ГВС является то обстоятельство, что если причины, являющиеся триггерными, устраняются, то гипервентиляция, которая уже не соответствует требованиям конкретной ситуации, сохраняется, сохраняется и гипокапния. Происходит стабилизация гипокапнических нарушений газообмена и формируется «порочный круг» ГВС, который начинает циркулировать автономно, и симптомы могут персистировать достаточно долго — феномен «махового колеса». Эти изменения реакции дыхания указывают на уязвимую систему контроля дыхания, которая не способна поддержать нормальное парциальное давление углекислого газа в крови (РСО2) и кислотно-щелочной гомеостаз [8, 9, 10, 11].
В основе развития клинических проявлений ГВС лежат гипокапнические нарушения газообмена [2, 3, 10]. Среди множества клинических проявлений ГВС одышка является ведущей жалобой и встречается практически в 100% случаев. Одышка может быть единственным клиническим проявлением, но чаще сочетается с другими симптомами.
Основные клинические проявления ГВС
Респираторные: одышка, вздохи, зевота, сухой кашель.
Общие: снижение трудоспособности, слабость, утомляемость, субфебрилитет.
Кардиальные: кардиалгия, экстрасистолия, тахикардия.
Психоэмоциональные: тревога, беспокойство, бессонница.
Гастроэнтерологические: дисфагия, боли в эпигастрии, сухость во рту, аэрофагия, запоры.
Неврологические: головокружение, обмороки, парестезии, тетания (редко).
Мышечные: мышечная боль, тремор.
Диагностика ГВС в первую очередь опирается на знание врачей самых различных специальностей об особенностях клинической картины ГВС. ГВС должен устанавливаться только после проведения дифференциальной диагностики с другими заболеваниями, протекающими с синдромом одышки. Полиморфизм клинических проявлений ГВС вызывает диагностические проблемы. Назначаются многочисленные обследования, дорогостоящие, ненужные, а иногда и опасные для больного. L. Lum (1987), обсуждая диагностические проблемы, называет среди врачебных ошибок бесполезные абдоминальные операции, операции на позвоночнике и других органах, инвазивные исследования, проводимые не без риска, и, что еще хуже, такие диагнозы, как эпилепсия и инфаркт миокарда. Взаимосвязи гипокапнии и ассоциированных с ней симптомов являются чрезвычайно сложными. Многие врачи при регистрации у больных низких значений РСО2 автоматически устанавливают диагноз ГВС, что является неправильным. Известно, что явления гипокапнии могут быть у больных рестриктивными легочными процессами, при лихорадочных состояниях, сердечной патологии, однако при этом «классических» гипокапнических жалоб может и не быть. И наоборот, так называемые гипокапнические жалобы, например тревога, одышка, парестезии и др., встречаются у пациентов с нормокапнией.
В практической медицине больной с ГВС — это пациент, предъявляющий жалобы на одышку, которая не соответствует данным объективного осмотра, показателям клинико-инструментальных исследований дыхания, с диспропорциональной, непонятной одышкой, субъективное восприятие которой является довольно тягостным. К сожалению, при отсутствии достоверных объяснений одышки больные обычно направляются для консультаций в различные лечебные учреждения. В конечном итоге они и формируют основной контингент альтернативной медицины, различных псевдоспециалистов «по тренировке правильного дыхания».
Исследование функции внешнего дыхания, имеющее важное значение в дифференциальной диагностике одышки, не помогает в верификации функциональных нарушений дыхания. Основным подтверждением ГВС служит выявление гипокапнических нарушений газообмена. Снижение РСО2 — прямое свидетельство альвеолярной гипервентиляции. Однако исходная гипокапния у больных с ГВС встречается не так часто. Поэтому в тех случаях, когда у пациента с предположительным ГВС в условиях покоя определяются нормальные значения углекислоты, рекомендуется определение изменений уровня СО2 при различных провокационных тестах. К «золотому стандарту» диагностики ГВС относят пробу с произвольной гипервентиляцией.
Департаментом пульмонологии университета г. Наймиген (Голландия) разработан Наймигенский опросник (Nijmegen questionnaire) для выявления физиологических показателей дизрегуляции вентиляции, сопоставимых с ГВС (табл.). Анкета содержит 16 пунктов, которые оцениваются по 5-балльной шкале (0 — никогда, 4 — очень часто). Минимальные и максимальные достижимые числа — 0 и 64 соответственно.
Данный опросник нашел свое применение прежде всего для скрининг-диагностики ГВС. Существует положение, согласно которому использование данного опросника позволяет корректно предсказывать ГВС в 90% от всех случаев [2, 12].
В последние годы в клиническую практику начинает внедряться понятие «дисфункциональное дыхание» (ДД). Приоритет внедрения термина принадлежит Ван Диксхорну (J. van Dixhoorn), который привел его в работе Hyperventilation and dysfunctional breathing (1997). Основанием для этого явилось понимание, что при функциональных нарушениях дыхания возможны различные изменения паттерна дыхания и значений РCO2, а не только гипокапнические расстройства, характерные для ГВС. ДД может проявляться также быстрым, аритмичным, поверхностным дыханием, частыми вздохами, преобладанием грудного типа дыхания.
Одной из сложных и дискуссионных проблем в пульмонологии является понимание взаимоотношений ГВС, ДД и бронхиальной астмы (БА) [15–18]. С. И. Овчаренко и др. (2002) у 22 из 80 больных БА выявили нарушения дыхания, соответствующие критериям ГВС. Сведений относительно встречаемости дисфункциональных нарушений дыхания при астме немного. Установлено, что среди лиц с диагнозом БА и по крайней мере с одним предписанием антиастматического препарата 29% имеют клинические признаки ДД [19]. Указывается, что ДД может усиливать симптомы БА и приводить к избыточному назначению лекарств.
Достаточно сложным является понимание механизмов развития дисфункциональных расстройств дыхания при БА; существует ряд предположений. К достаточно обоснованным факторам развития гипервентиляции относят тревожные расстройства. Использование больными бронходилататоров (β-2-агонисты, теофиллин), которые обладают эффектами стимуляции дыхания, также относят к факторам развития гипервентиляции. Обсуждается роль изменений перцепции одышки при БА. Анализ существующих проблем взаимосвязи ДД и БА провел M. Morgan (2002), представив следующие ключевые положения:
В зависимости от установления особенностей ДД должна осуществляться и программа лечения больных. При выявлении ГВС релаксирующие методы дыхательной гимнастики проводятся под руководством опытных инструкторов, назначаются β-адреноблокаторы, бензодиазепины [5, 22, 23]. При явлениях гиповентиляции — массаж дыхательных мышц, использование дыхательных тренажеров. Выявление ГВС при БА указывает на необходимость применения методов коррекции функциональных нарушений дыхания. Релаксирующие дыхательные упражнения за счет неспецифических механизмов дыхательного тренинга улучшают качество жизни у этих больных.
По вопросам литературы обращайтесь в редакцию.
В. Н. Абросимов, доктор медицинских наук, профессор
Рязанский ГМУ им. акад. И. П. Павлова, Рязань