Инвазия экстрамуральных сосудов что это
Инвазия экстрамуральных сосудов что это
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
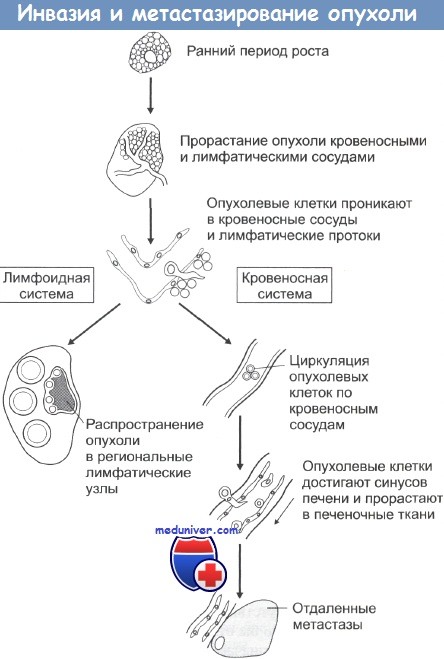
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Экстрамуральная сосудистая инвазия как индикатор наличия метастазов рака нижнеампулярного отдела прямой кишки
Рак прямой кишки занимает одно из лидирующих мест в структуре смертности у представителей обоих полов, при этом единственным радикальным методом лечения остается хирургическое вмешательство. Для планирования оперативного лечения важной является оценка метастатического поражения локорегионарных лимфатических узлов и наличия экстрамуральной лимфососудистой инвазии, являющейся важным предиктором возникновения рецидива заболевания, а также ранним индикатором появления отдаленных метастазов. Эффективность и достоверность дооперационного стадирования рака нижнеампулярного отдела прямой кишки значительно возросла после внедрения в клиническую практику магнитно-резонансной томографии, а также комплексного предоперационного лучевого обследования пациентов. Статья посвящена проблемам дооперационного стадирования и определению статистически значимых взаимосвязей между наличием экстрамуральной сосудистой инвазии и морфологическим типом, стадией опухоли и наличием отдаленных метастазов при раке нижнеампулярного отдела прямой кишки.
Extramural vascular invasion as an indicator of the presence of distant metastases of low rectal cancer
Rectal cancer is one of the leading pathologies in the structure of mortality for both genders, and the surgical intervention is the only radical method of treatment. Assessment of metastatic lesion of locoregional lymph nodes and the presence of extramural lymphovascular invasion, which is an important predictor of disease recurrence, as well as an early indicator of the appearance of distant metastases, is important for planning surgical treatment. The effectiveness and reliability of preoperative staging of the low rectal cancer significantly increased after the introduction of magnetic resonance imaging in clinical practice, as well as a comprehensive preoperative radiological examination of patients. The article is devoted to the problems of preoperative staging and the determination of a statistically significant correlation between the presence of extramural vascular invasion and the morphological type, stage of the tumor and the presence of distant metastases in patients with low rectal cancer.
Рак прямой кишки (РПК) представляет собой одну из актуальных и сложных проблем современной онкоколопроктологии. Распространенность заболевания и смертность населения от этой патологии по-прежнему остаются высокими. Так, только в России в 2014 году зарегистрировано 26785 новых случаев рака прямой кишки, а смертность составила 9,2 %. В структуре онкологической заболеваемости рак прямой кишки занимает 6-е место (5,2 %) среди мужчин и 7-е место (4,7 %) среди женщин [1]. В ряду колоректальных раков особое место занимают раки прямой кишки низких локализаций (ниже 6 см), при лечении которых применяются комбинированные методы, а частота местных рецидивов, несмотря на выполнение зачастую инвалидизирующих операций, значительно выше.
Магнитно-резонансная томография является диагностическим методом, сочетающим в себе преимущества пространственного и контрастного разрешения в сочетании с отсутствием лучевой нагрузки. Для низких локализаций рака прямой кишки неоспорима диагностическая роль МРТ в прогнозировании вовлечения латерального края резекции, так как на уровне мышц, поднимающих задний проход, толщина мезоректума значительно тоньше, чем в верхне- и среднеампулярных отделах прямой кишки [2, 3]. Высокое пространственное разрешение МР-изображений в коронарных плоскостях позволяет четко визуализировать леваторы ануса, комплекс внутренних и наружных сфинктеров и межсфинктерное пространство, что используется для стадирования низких колоректальных опухолей и планирования объема хирургического вмешательства (стандартная операция, сфинктеросохраняющая резекция, экстралеваторная брюшно-промежностная экстирпация прямой кишки) [4–8].
С помощью магнитно-резонансной томографии возможно визуализировать как нормальные вены мезоректальной клетчатки в виде серпигиозных структур с низким МР-сигналом, так и венозные сосуды патологической структуры при опухолевой инвазии. Это позволяет включить МРТ-исследование в стандартный протокол определения распространенности нижнеампулярного рака прямой кишки в предоперационном стадировании низких раков, непосредственно влияющем на дальнейшую тактику их лечения [10–14].
Инвазия экстрамуральных сосудов что это
Согласно переработанной Венской классификации [4] в понятие ранний рак могут быть включены пункты 4-2, 4-3, 4-4 и 5 (рис. 1).
Макроскопическая классификация раннего рака толстой кишки соответствует парижской классификации эпителиальных неоплазий приведенной на рис. 2.
Как в случае хирургического так и эндоскопического лечения рака толстой кишки опухоль должна быть удалена в пределах здоровых тканей. Однако, в отличие от хирургического лечения при эндоскопической резекции слизистой регионарные лимфатические узлы удалены быть не могут. Таким образом, местное удаление опухоли показано только пациентам с минимальным риском метастазирования в региональные лимфатические узлы.
Факторы риска
Ряд факторов рассматривается в качестве возможных индикаторов наличия или отсутствия метастазов в региональные лимфатические узлы при раннем инвазивном КРР. Это качественные критерии, как: степень дифференцировки опухоли, наличие или отсутствие инвазии в сосуды, отсевы и макроскопический тип раннего КРР. Единственным количественным фактором риска поражения лимфатических узлов является глубина подслизистой инвазии.
Дифференцировка опухоли
Инвазия в сосуды
Под инвазией в сосуды подразумевается инвазия в лимфатические или венозные сосуды (рис. 3).
Мы в своей работе также рассматриваем сосудистую (не зависимо лимфатическую или венозную) инвазию в качестве независимого фактора риска метастазирования в лимфатические узлы.
Отсевы
Отсевы это изолированные клетки опухоли или группы клеток расположенные в других отношениях здоровых тканях (рис. 4).
Макроскопический тип опухоли
Мы в своей практике не рассматриваем макроскопический тип в качестве независимого фактора риска метастазирования в лимфатические узлы, признавая однако, что опухоли с компонентом типа 0-IIc чаще имеют большую глубину инвазии в подслизистый слой, чем другие макроскопические типы. Однако большая вероятность метастазирования в этом случае будет связана с большей глубиной инвазии, а не с типом опухоли самой по себе.
Глубина инвазии
Глубина инвазии это расстояние от мышечной пластинки слизистой (или ее предположительного расположения) до наиболее глубоко лежащей границы опухоли (рис. 5).
Заключение
В настоящее время практически невозможно упомянуть все исследования посвященные факторам риска метастазирования в регионарные лимфатические узлы при раннем инвазивном КРР. Мы остановимся лишь на некоторых из них опубликованных японскими авторами (как обладающими наибольшим опытом в изучении этой проблемы) в 2000 – 2004 годах.
| Автор (год) | Число случаев (из них с метастазами в лимфатические узлы) | Метастазы в лимфатические узлы отсутствуют |
| Tanaka (2000) [16] | 521 (45) | Высокая или средняя степень дифференцировки опухоли без инвазии в сосуды в сочетании с глубиной подслизистой инвазии до 1500мкм |
| Sakuragi (2003) [13] | 278 (21) | Нет инвазии в лимфатические сосуды в сочетании с глубиной подслизистой инвазии до 2000мкм |
| Ueno (2004) [17] | 292 (33) | Высокая или средняя степень дифференцировки опухоли без инвазии в сосуды и отсевов в сочетании с глубиной подслизистой инвазии до 2000мкм |
| Shimomura (2004) [14] | 231 (21) | Нет отсевов, инфильтративного роста опухоли, инвазии в лимфатические сосуды в сочетании с глубиной подслизистой инвазии до 1500мкм |
| Yamamoto (2004) [20] | 301 (19) | Нет инвазии в сосуды в сочетании с глубиной подслизистой инвазии до 1000мкм |
Таким образом, основываясь на представленных данныx, по нашему мнению можно считать безопасным эндоскопическое удаление раннего КРР у пациентов с сочетанием следующих признаков (при условии отсутствия опухолевых клеток на уровне резекции):
Отсутствие любого из признаков 1-3 требует выполнения хирургического вмешательства по поводу раннего инвазивного КРР всем пациентам.
Данная проблема продолжает интенсивно изучаться во всем мире и подходы к радикальному эндоскопическому лечению раннего КРР продолжают меняться по мере поступления новой информации.
ИНВАЗИЯ И МЕТАСТАЗИРОВАНИЕ ОПУХОЛЕВЫХ КЛЕТОК
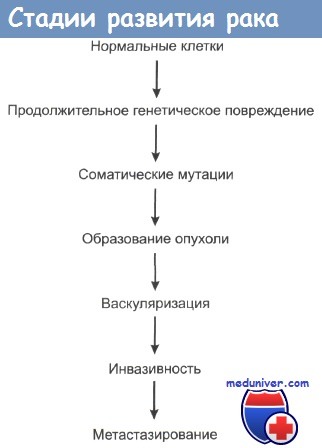
Способность трансформированных клеток к миграции, инвазии и метастазированию – это важнейшее (помимо бесконтрольной клеточной пролиферации) принципиальное отличие злокачественных опухолей от доброкачественных. Инвазия и метастазирование – это главные проявления прогрессии опухоли.
Процесс инвазии и начальный “рак на месте”.
Опухолевая инвазия — процесс, при котором раковые клетки или же агрегаты расходятся из первичного очага опухоли в соседние ткани. В случае злокачественных опухолей, процесс включает проникновение опухолевых клеток через базальную мембрану в результате её разрушения.
“Рак на месте” (carcinoma in situ, CIS) – характеризуется инвазией раковых клеток в пласт эпителия ткани. Возникает в эпителиальных тканях, с вероятным исходом – злокачественной инвазией с развитием раков и метастазированием. Типы дифференцируются в зависимости от локализации CIS, и обозначаются названием типа поврежденного эпителия.
Механизм развития CIS (рис. 1), начинается с поврежденной клетки, которая под действием эндо-и экзогенных канцерогенов, подвергается цитогенному прогрессированию с развитием злокачественной генной трансформации. При этом, новообразованная малигнизированная (опухолевая) клетка, подвергается пролиферации, с образованием однотипных клеток – малигнизированного клона, клетки которой, ввиду отсутствия сосудистой трофики, диффузно питаются веществами из тканевой жидкости.
CIS характеризуется экспансивным ростом, отсутствием сосудов, отсутствием псевдооболочки клеток, отсутствием внедрения в подлежащую эпителию соединительную ткань, следовательно и целостностью базальной мембраны эпителия. Продолжительность развития CIS до злокачественной инвазии, может занимать до 10 лет, в некоторых случаях и гораздо больший период времени.
Микроскопически, CIS представлен на примере переходно-клеточного эпителия мочевого пузыря (рис. 2).
На препарате видно, что поверхностный и базальный слои клеток сохранены в гистологической норме. В промежуточном слое, наблюдается резкое увеличение количества слоев клеток, с выраженным тканевым атипизмом. Базальная мембрана, подлежащая соединительная ткань, изменениям не подверглись.
Процесс злокачественного инвазивного роста.
Вторым этапом CIS, является развитие истинной опухоли, с инвазией в соединительную ткань и метастазированием. В основе процессов, лежат несколько этапов реализации. Начинается вторичная инвазия (инфильтративный рост) с дезинтеграции опухолевых клеток (рис. 3). Под действием различной природы мутагенов, происходит трансформация (мутация) в клетках опухоли гена CTNNB1, ответственного за кодирование белка бета-катенина, в следствие чего, появляются “неправильные” белки. Одномоментно, катенины теряют связь с кадгеринами (напр.: белок Е-кадгерин в эпителиальных клетках), и замещение последних менее стабильными плакоглобинами. Соответственно, теряется основная функция белков – контактное торможение, и неподвижные в норме клетки, начинают аттрактивные движения с помощью псевдоподий к хемоаттрактантам.
Утратив способность к контактному торможению, малигнизированные клетки, усиливают экспрессию интегриновых рецепторов, за счет избытка отрицательного заряда и сниженной концентрации ионов кальция. Происходит адгезия к веществам базальной мембраны, их деградация под действием специализированных ферментов. Образовавшиеся продукты деградации, служат хемоаттрактантами для движения в эту зону опухолевых клеток с псевдоподиями (рис. 3).
Внешние формы опухолей.
Узел – в виде полипа, бляшки, цветной капусты, гриба, узла…Экзофитный рост
Язва – с блюдцеобразными краями. Экзофитный рост.
Киста – полость наполненная жидкостью.
Инфильтрат. Эндофитный рост.
Смешанная форма. Инфильтративно-язвенная.
Метастазирование — заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы
Метастатический каскад
— Формирование эмболов (из опух.клеток, тромбоцитов и/или лимфоцитов)
— Взаимодействие опухолевых клеток с эндотелием венул, прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли
Пути метастазирования
По продолжению — по межтканевым щелям.
Лимфогенные — по лимфатическим сосудам в регионарные лимфоузлы, характерны для опухолей эпителиального происхождения (карцинома); Лимфоузлы поражаются в порядке удаления от основного узла опухоли.
Гематогенные — по кровеносным сосудам в любые органы, характерны для опухолей соединительнотканного происхождения (саркома); Опухоли органов, дренируемых воротной веной (непарные органы брюшной полости), часто дают метастазы в печень. Все опухоли могут метастазировать в легкие, так как большинство эмболов не проходит через легочные капилляры. Для некоторых онкозаболеваний характерна органоспецифичность метастазов, необъяснимая исходя только из законов эмболии.
Имплантационные — по ходу серозных полостей (брюшины, плевры, перикарда), очень редко — по ходу синовиальных влагалищ, нервов и трубчатых органов.
Ликворогенные — распространение опухолевых клеток ликворным путям в пределах ЦНС.
Исходы.
Выводы.
В последние десятилетия в сотни раз выросла вероятность возникновения опухолей, возросло число людей погибающих от злокачественных форм новообразований. Многие статистические данные и специфическая локализация, коррелируют с множественными канцерогенами, преимущественно экзогенной природы. Первая мера профилактики от опухолей, это создание изоляции опасных веществ и факторов, от их воздействия на организм человека. В процессе лечения, в последнее время много благоприятных исходов, однако, состояние некоторых пациентов становится хуже, и апробированная терапия показывает обратный результат. Основная причина таких случаев – поддельные фармакологические препараты, направленные на лечение опухолевых процессов. Устранив эти и другие тормозящие факторы, можно добиться колоссальных успехов в терапии, в свете инновационных технологий сегодняшнего дня.
Литература.
Синельников А. Я. Атлас макроскопической патологии человека. — М.: РИА «Новая волна»: Издатель Умеренков, 2007. — 320 с: ил.
Автор: А.И.Струков, В.В.Серов Издательство: Москва, «Медицина» Год: 1995; Патологическая анатомия.