Изофермент cyp2d6 что это
Изофермент cyp2d6 что это
Сычев Д.А. д.м.н., профессор кафедры клинической фармакологии Первого МГМУ им. И.М. Сеченова, зав. отделом персонализированной медицины и клинической фармакогенетики Центра клинической фармакологии НЦ ЭСМП Министерства здравоохранения РФ
Миронова Н.А., аспирант кафедры клинической фармакологии Первого МГМУ им. И.М. Сеченова
Генетические особенности генома пациента, влияющие на фармакологический ответ, представляют собой однонуклеотидные полиморфизмы в генах (замены, вставки, делеции), кодирующих белки, участвующие в фармакокинетике и / или фармакодинамике ЛС [2]. Выявление генетических особенностей при фармакогенетическом тестировании направлено на прогнозирование индивидуального фармакологического ответа (развитие неблагоприятной побочной реакции и / или резистентности к лечению) у пациента [3]. Однонуклеотидные полиморфизмы в том или ином гене, передаваемые из поколения в поколение, могут определять генетический вклад в индивидуальный фармакологический ответ [2, 4], в частности:
Однонуклеотидные полиморфизмы могут быть в генах, кодирующих белки, которые принимают участие в следующих процессах [1, 2, 3, 4, 5]:
· применение ЛС с большим спектром и значительной выраженностью неблагоприятных побочных реакций, как правило, с узким терапевтическим диапазоном, которое используется длительно (часто пожизненно);
· применение ЛС с большим межиндивидуальным разбросом в эффективности;
· у пациентов с высоким риском развития неблагоприятных побочных реакций и / или не эффективности лечения, в т.ч. с наследственным анамнезом по конкретным ЛС.
Полиморфизм генов CYP2D6 и CYP2C19: клинико-фармакологические аспекты.
Клиническая интерпретация результатов фармакогенетического тестирования по CYP2D6 и CYP2C19 1.
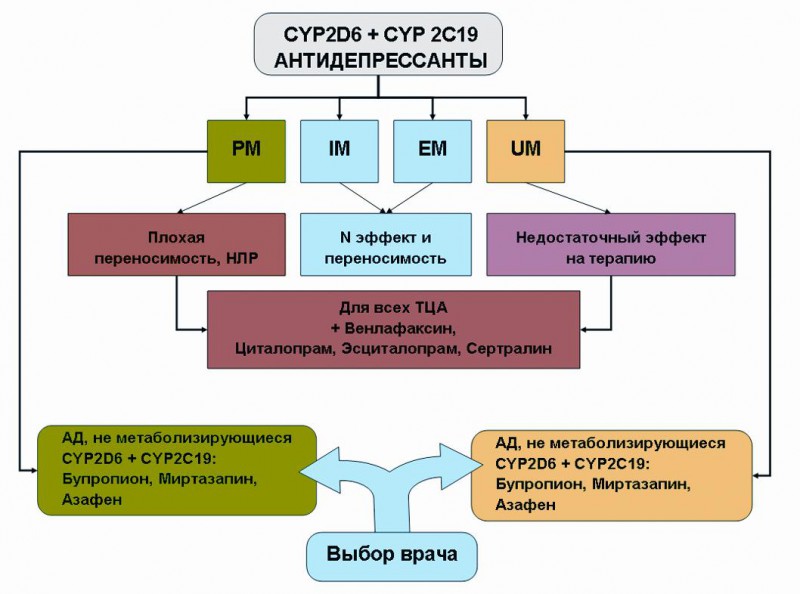
Рисунок 1. Алгоритм персонализированного выбора антидепрессантов (АД) по результатам фармакогенетического тестирования по CYP 2 D 6 и CYP 2 C 19 (10, 17).
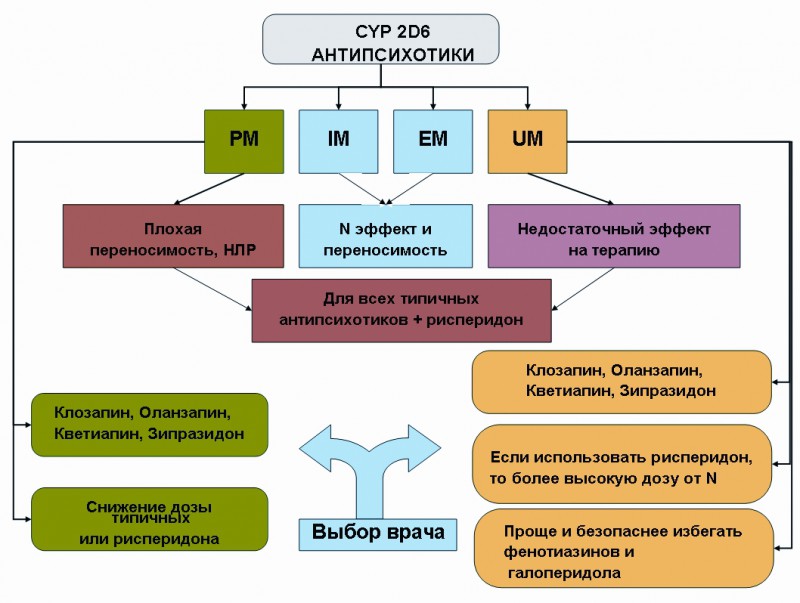
Рисунок 2. Алгоритм персонализированного выбора нейролептиков (антипсихотиков) по результатам фармакогенетического тестирования по CYP 2 D 6 (10, 17).
UM — носители дупликации функциональных аллелей гена CYP 2 D 6.
3. Персонализация выбора бета-адреноблокаторов по результатам фармакогенетического тестирования по CYP 2 D 6 [6, 7]:
· При выявлении генотипа CYP 2 D 6*1/*1 метопролол используют в дозах, регламентированных в инструкции по медицинскому применению.
o у пациентов с хронической сердечной недостаточностью (ХСН) максимальная доза метопролола не должна превышать 50 мг/сут, либо следует выбрать бисопролол или карведилол;
o у пациентов с ишемической болезнью сердца, артериальной гипертензией (АГ) следует выбрать другие бета-адреноблокаторы (атенолол, биспопролол) из-за очень высокого риска развития НЛР метопролола ( в первую очередь — брадикардии).
o у пациентов с ХСН максимальная доза метопролола не должна превышать 100 мг/сутки, либо следует выбрать бисопролол или карведилол.
o у пациентов с ИБС, АГ следует выбрать другие бета-адреноблокаторы (атенолол, биспопролол) из-за высокого риска развития НЛР метопролола (и в первую очередь — брадикардии).
4. Персонализация выбора обезболивающих средств на основе результатов фармакогенетического тестирования по CYP 2 D 6:
· При выявлении генотипа CYP 2 D 6*1/*1 трамадол используется в дозах, регламентированных в инструкции по медицинскому применению.
5. Персонализация выбора ингибиторов протонного насоса на основе результатов фармакогенетического тестирования по CYP 2С19 [6, 19, 20, 21, 22]:
· При выявлении генотипа CYP 2 C 19*1/*1 рекомендуется назначить омепразол в дозе 40 мг/сутки или эзомепразол в дозе 20 мг/сутки, или лансопразол в дозе 60 мг/сутки.
· При выявлении гетерозиготного носительства по полиморфному маркеру 681 G / A гена CYP 2 C 19 рекомендуется назначить омепразол в дозе 40 мг/сутки или лансопразол в дозе 30 мг/сутки.
· При выявлении гомозиготного носительства по полиморфному маркеру 681 G / A гена CYP 2 C 19 рекомендуется назначать омепразол в дозе 20 мг/сутки или лансопразол в дозе 30 мг/сутки.
6. Персонализация выбора антиагрегантов на основе результатов фармакогенетического тестирования по CYP 2С19 [6, 11, 12, 16]:
· При выявлении генотипа CYP 2 C 19*1/*1 клопидогрел применяется в дозах, регламентированных в инструкции по медицинскому применению: нагрузочная доза- 300 мг, далее по 75 мг/сутки.
Таким образом, генотипирование по CYP 2 D 6 и CYP 2 C 19 в клинической практике может способствовать персонализации выбора широкого круга лекарственных средств и их режимов дозирования, что повысит эффективность и безопасность лечения пациентов, однако ключевым моментом должна быть обоснованная клиническая интерпретация результатов фармакогенетического тестирования.
1. Weber W.W. Pharmacogenetics // Oxford: Oxford University Press, 1997.
2. Сычев Д.А., Игнатьев И.В. и др. Клиническая фармакогенетика / Под ред. В.Г. Кукеса, Н.П. Бочкова. — М.: ГЭОТАР-МЕДИА, 2007. — 248 с.
3. Cohen N. Pharmacogenomics and Personalized Medicine Nadine // Humana Press, 2010, 528 p.
4. Середенин С.Б. Лекции по фармакогенетике // М.: МИА, 2004. — 303 с.
7. Сычев Д.А., Игнатьев И.В. и др. Фармакогенетические исследования системы биотрансформации и транспортеров для персонализации фармакотерапии в кардиологии (российский опыт). Сообщение второе: фармакогенетические исследования CYP2D6.//Клиническая фармакология и терапия.- 2007.- №4.- с. 62-66.
8. Wuttke H, Rau T. et al. Increased frequency of cytochrome P450 2D6 poor metabolizers among patients with metoprolol-associated adverse effects. Clin Pharmacol Ther. 2002 Oct;72(4):429-37.
9. Rau T, Wohileben G. et al. CYP2D6 genotype: impact on adverse effects and nonresponse during treatment with antidepressants—a pilot study. Clin Pharmacol Ther 2004;75:386–93.
11. Gladding P, Webster M et al. The pharmacogenetics and pharmacodynamics of clopidogrel response: an analysis from the PRINC (Plavix Response in Coronary Intervention) trial. JACC Cardiovasc Interv. 2008 Dec;1(6):620-7.
12. Комаров А.Л., Панченко Е.П. и др. Факторы, определяющие клиническую эффективность клопидогрела и прогноз у больных со стабильной формой ишемической болезни сердца.// Кардиология.- 2011.- №2.- с. 8-18.
18. de Leon J, Armstrong SC, Cozza KL. Clinical guidelines for psychiatrists for the use of pharmacogenetic testing for CYP450 2D6 and CYP450 2C
20. Исаков В.А. Фармакогеномика гастроэзофагеальной рефлюксной болезни. // Вестник РАМН.- 2005.- №6.- с. 33-36.
Изофермент cyp2d6 что это
Московская Медицинская Академия им. И.М. Сеченова
Во врачебной практике пациентам часто назначают комплексное лечение, состоящее из нескольких лекарственных средств, что может привести к изменению эффективности и безопасности фармакотерапии в результате лекарственного взаимодействия. Основное место занимает фармакокинетическое взаимодействие, включающее в себя влияние лекарственных средств на микросомальную окислительную систему цитохрома Р-450, поскольку данный цитохром участвует в метаболизме практически всех известных химических соединений.
Одним из подсемейств цитохрома Р-450 является 2D (CYP2D), которое включает изофермент CYP2D6.
Изофермент CYP2D6 участвует в метаболизме более 20 % лекарственных средств, в т. ч. β-адреноблокаторов (метопролол, пропранолол, тимолол и др.), антидепресcантов (амитриптилин) и других. Важно учитывать, что данная группа лекарственных средств принимается пациентами длительно, нередко в течение всей жизни, поэтому избежать совместного приёма с другими лекарственными средствами невозможно. В этом случае возможно влияние на функциональную активность печёночных изоферментов, что может повлечь за собой изменение в скорости метаболизма основного лекарственного средства [6].
Наиболее мощным ингибитором CYP2D6 является пароксетин. Совместное применение субстратов CYP2D6 c ингибиторами CYP2D6 приводит к угнетению метаболизма субстратов, следствием чего может быть возникновение побочных эффектов, связанных с применением лекарственных средств – субстратов, вплоть до интоксикации за счёт замедления их клиренса (таблица).
Маркерными субстратами, используемыми для фенотипирования цитохрома CYP2D6, являются дебризохин, декстрометорфан и спартеин [3].
В настоящее время стало очевидным, что генетические особенности пациентов могут определять до 50 % всех атипичных фармакологических ответов: неэффективность лекарственных средств или нежелательные лекарственные реакции (НЛР) (W.E. Evans, 2003; В.С. Моисеев, 2002; В.Г. Кукес, 2004, С.Б. Середенин, 2004; D.W. Nebert, 2005). Эти генетические особенности представляют собой полиморфные участки генов белков, участвующих в фармакокинетике или фармакодинамике лекарственных средств, называемые полиморфными маркерами или аллельными вариантами (Н.П. Бочков, 2001, R. Weinshilboum, 2003, С.Б. Середенин, 2004).
Большинство людей имеют нормальные гены ферментов метаболизма, однако в определённом проценте случаев распространены мутантные гены. По мутации гена выделяют следующие группы:
Влияние изофермента CYP2D6 на метаболизм лекарственных препаратов и методы определения его активности
Полный текст:
Аннотация
Ключевые слова
Об авторах
Список литературы
1. Kukes VG. Metabolism of drugs: clinical and pharmacological aspects. Moscow: Reafarm; 2004 (in Russian).
2. Caldwell J. Drug metabolism and pharmacogenetics: the British contribution to fields of international significance. Br J Pharmacol. 2006; 147: 89-99.
3. Verschuren JJ., Trompet S., Wessels JA., Guchelaar HJ., de Maat MP., Simoons ML., Jukema JW. A systematic review on pharmacogenetics in cardiovascular disease: is it ready for clinical application? Eur Heart J. 2012; 33(2): 165-75.
4. Fux R., Morike K., Prohmer A.M., Delabar U., Schwab M., Schaeffeler E., et al. Impact of CYP2D6 genotype on adverse effects during treatment with metoprolol: a prospective clinical study. Clin Pharmacol Ther 2005; 78: 378-87.
5. Nagele P., Liggett S.B. Genetic variation, β-blockers, and perioperativemyocardial infarction. Anesthesiology 2011; 115: 1316-27.
6. Shams M.E., Arneth B., Hiemke C. CYP2D6 polymorphism and clinical effect of the antidepressant venlafaxine. J Clin Pharm Ther. 2006; 31: 493-502.
7. Gasche Y., Daali Y., Fathi M., Chiappe A., Cottini S., Dayer P., Desmeules J. Codeine intoxication associated with ultrarapid CYP2D6 metabolism. N Engl J Med. 2004; 351: 2827-31.
9. Lynch T., Price A. The effect of cytochrome P 450 metabolism on drug response, interactions, and adverse effects. Am Fam Physician 2007; 76(3): 391-6.
10. de Leon J., Armstrong S.C., Cozza K.L. Clinical guidelines for psychiatrists for the use of pharmacogenetic testing for CYP450 2D6 and CYP450 2C19. Psychosomatics 2006; 47: 75-85.
11. Eichelbaum M., Ingelman-Sundberg M., Evans W.E. Pharmacogenomics and individualized drug therapy. Annu Rev Med. 2006; 57: 119-37.
12. Jiang X.L., Shen H.W., Yu A.M. Pinoline may be used as a probe for CYP2D6 activity. Drug Metab Dispos. 2009; 37(3): 443-6.
Для цитирования:
Смирнов В.В., Абдрашитов Р.Х., Егоренков Е.А., Гильдеева Г.Н., Раменская Г.В., Пермяков Р.А. Влияние изофермента CYP2D6 на метаболизм лекарственных препаратов и методы определения его активности. Ведомости Научного центра экспертизы средств медицинского применения. 2015;(3):32-35.
For citation:
Smirnov V.V., Abdrashitov R.H., Egorenkov E.A., Gildeeva G.N., Ramenskaya G.V., Permyakov R.A. Influence of CYP2d6 on drug metabolism and methods for determining its activity. The Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. 2015;(3):32-35. (In Russ.)
Фармакокинетические особенности лекарственных взаимодействий ингибиторов протонной помпы
Henning Blume, Frank Donath, Andre Warnke, Barbara S. Schug
Результаты сравнительных исследований показали, что ингибиторы протонной помпы обеспечивают более эффективное угнетение секреции соляной кислоты, облегчение боли и заживление повреждений пищевода, язв желудка и двенадцатиперстной кишки, чем антагонисты гистаминовых Н2-рецепторов 6. Таким образом, ингибиторы протонной помпы в настоящее время являются наиболее предпочтительным средством лечения гастроэзофагеальной рефлюксной болезни, пептической язвы (ПЯ) и синдрома Золлингера — Эллисона и формируют ключевой компонент тройной схемы терапии для эрадикации H. pylori у пациентов с ПЯ [7]. Кроме того, ингибиторы протонной помпы эффективны для профилактики ПЯ, вызванной стрессом и приемом нестероидных противовоспалительных препаратов (НПВП) [8, 9].
Кислотозависимые заболевания — обычно хронические, многофакторные состояния, требующие длительного лечения, что повышает вероятность проведения сопутствующей терапии [10]. По мере того как количество препаратов, принимаемых одновременно, увеличивается, потенциальная возможность взаимодействия различных комбинаций также повышается [11]. Это особенно относится к пациентам пожилого возраста, у которых часты как кислотозависимые заболевания [12], так и случаи полифармации (полипрагмазии) [13]. Таким образом, появляется реальная возможность развития клинически значимых лекарственных взаимодействий у пациентов, получающих ингибиторы протонной помпы совместно с другими лекарствами [14], особенно препаратами с небольшим терапевтическим индексом.
Лекарственные взаимодействия являются частой причиной отсутствия эффекта терапии и побочных лекарственных реакций [15]. Действительно, частота побочных лекарственных реакций особенно высока среди пациентов, находящихся в стационарах, и лиц пожилого возраста, которые проживают в интернатах и принимают много медикаментов [16, 17]. Частота случаев лекарственных взаимодействий варьирует у отдельных лиц и зависит от возраста пациента, количества одновременно принимаемых препаратов (которое также увеличивается с возрастом) [18, 19], генетической конституции пациента [20], а также схемы лечения и особенностей метаболизма препарата [20]. Вместе с тем, несмотря на высокую вероятность лекарственных взаимодействий с участием ингибиторов протонной помпы, клинически значимых взаимодействий документально зафиксировано мало [15]. Данный обзор, не будучи систематическим анализом литературы, имеет целью осветить сходства и различия ингибиторов протонной помпы в отношении вероятности, релевантности и механизмов лекарственных взаимодействий. Поиск литературы для обзора производился с помощью электронной базы данных MEDLINE с использованием терминов MESH (Medical Subject Heading — Медицинский предметный рубрикатор), таких, как «лекарственные взаимодействия и ингибиторы протонной помпы» («drug interactions AND PPIs»), помимо этого, с помощью ручного поиска по спискам литературы соответствующих обзоров и работ, отбирали дополнительные статьи.
1. Механизмы лекарственных взаимодействий с участием ингибиторов протонной помпы
В целом в основе лекарственных взаимодействий могут лежать фармакодинамические (то есть связанные с эффектами синергизма или антагонизма) или фармакокинетические (то есть связанные с всасыванием, распределением, метаболизмом или выведением) процессы [21]. Более того, взаимодействия также могут быть обусловлены биофармацевтической модификацией лекарственных средств, например, изменением растворимости активного лекарственного ингредиента препарата или высвобождения из лекарственной формы. Некоторые взаимодействия можно прогнозировать, зная лежащие в их основе фармакологические или биофармацевтические механизмы, но другие процессы развиваются (или не развиваются) неожиданно, их нельзя предсказать исходя из специфических свойств препаратов.
В целом фармакокинетические взаимодействия можно рассматривать в двух аспектах: влияние данного препарата на фармакокинетику сопутствующего медикамента или влияние сопутствующего медикамента на фармакокинетику данного препарата. Первый тип взаимодействия характерен прежде всего для пациентов, получающих сопутствующие препараты с небольшим терапевтическим индексом, например фенитоин или варфарин. Для этих лекарств даже небольшие нарушения фармакокинетики могут привести к значительным изменениям клинической эффективности и развитию нежелательных побочных явлений [22].
1.1. Модуляция желудочной кислотности
Повышение желудочного рН, вызванное введением ингибитора протонной помпы, является одним из возможных механизмов, лежащим в основе взаимодействий ингибиторов протонной помпы и других препаратов. Ингибиторы протонной помпы путем снижения желудочной кислотности потенциально могут изменять растворимость других лекарственных субстанций или влиять на высвобождение лекарства из препаратов, характеристики растворения которых зависят от значений рН. Этот вид взаимодействий — группоспецифический и, таким образом, присущ всем отдельным ингибиторам протонной помпы.
Второй пример — итраконазол, который практически нерастворим в разведенных кислых растворах и воде, поэтому его не рекомендуется назначать пациентам с отсутствием желудочной кислотности или лицам, принимающим такие препараты, понижающие желудочную кислотность, как ингибиторы протонной помпы. Данный вывод был сделан на основании результатов исследования, показавшего, что сопутствующее лечение омепразолом в дозе 40 мг уменьшало среднюю AUC24 и максимальную концентрацию в плазме крови (Cmax) итраконазола после его перорального приема в форме капсул по 200 мг, на 64 и 66% соответственно [25]. Вместе с тем, если итраконазол применяли в форме раствора для приема внутрь, то сопутствующее введение омепразола в дозе 40 мг не оказывало значительного влияния на Cmax, время достижения Cmax (Tmax) или AUC8 [26].
Таким же образом, по мере повышения рН желудка в результате приема омепразола, понижается растворимость индинавира, ингибитора протеазы вируса иммунодефицита человека (ВИЧ). Это может уменьшать его всасывание, что, в свою очередь, снижает его анти-ретровирусную эффективность. Эффективность индинавира может также снижаться в результате вызванной омепразолом индукции изофермента ЗА цитохрома Р450 (CYP). Например, в небольшом исследовании с участием ВИЧ-инфицированных лиц одновременный прием омепразола (в суточной дозе 20-40 мг) и индинавира (по 800 мг каждые 8 ч) приводил к снижению концентрации индинавира в плазме крови почти у половины исследуемых пациентов [27]. В противоположность этому, всасывание висмута, содержащегося в антацидном средстве в виде висмута субцитрата (трикалия дицитратовисмутата), повышалось у пациентов, принимавших омепразол в суточной дозе 40 мг в течение 1 нед, что связывают с повышением рН в желудке [28].
Несмотря на то, что такие изменения рН в желудке могут играть роль в некоторых взаимодействиях, в последнее время большинство лекарственных взаимодействий считают обусловленными, вероятнее всего, действием на β-гликопротеин 2 или на метаболическую систему CYP.
1.2. Взаимодействия с β-гликопротеином — транспортным белком, АТФ-зависимым выкачивающим насосом
Связанные с мембраной системы транспортных белков, таких как β-гликопротеин, находятся на апикальных участках поверхностных цилиндрических клеток тонкого кишечника, а также в других тканях (например, в клетках гематоэнцефалического барьера, в ткани почек или билиарной системы). Действие этих транспортных систем также может изменять фармакокинетику лекарств [29]. В настоящее время известно большое количество субстратов, ингибиторов и индукторов этой транспортной системы, к которым, в частности, относятся дигоксин, циметидин, такролимус, нифедипин, кетоконазол и амитриптилин [20]. Транспортная система β-гликопротеина может также изменять доступность препаратов, введенных принятых перорально, для действия кишечного фермента CYP3A4, участвующего в метаболизме многих лекарств, в том числе циклоспорина и фелодипина [30].
1.3 Система ферментов цитохрома Р450 (CYP)
Основная функция метаболизма лекарств — повышение их гидрофильности и облегчение их выведения с мочой или желчью. Многие вещества проходят фазу I метаболизма, катализируемую главным образом ферментами системы CYP, с образованием продуктов биотрансформации, которые либо выводятся почками сразу, либо перед выведением метаболизируются дальше в реакциях фазы II [31].
Система CYP представляет собой многочисленное семейство изо-ферментов, обнаруживаемых преимущественно в гепатоцитах и в энтероцитах тонкого кишечника и в меньшей степени — в почках, легких, мозге и других тканях. В человеческом организме метаболизм лекарств осуществляется в основном с участием шести изоферментов CYP: CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 [31]. Результаты недавно проведенных исследований указывают на то, что эти ферменты катализируют реакции биотрансформации, лежащие в основе большинства клинически значимых лекарственных взаимодействий [20].
Анализ этих взаимодействий затруднен наличием ряда других факторов, влияющих на активность системы ферментов CYP, таких, как курение, употребление алкоголя, возраст, генетический полиморфизм ферментов, особенности питания и интеркуррентные заболевания. Эти факторы являются причиной большой индивидуальной вариабельности процессов угнетения или индукции системы CYP, а также предрасположенности к развитию лекарственных взаимодействий [21].
Большинство лекарственных взаимодействий отмечается в результате конкурентного ингибирования, при котором два вещества конкурируют друг с другом за один участок связывания с изоферментом CYP. Выраженность взаимодействий и их последствия зависят от относительной аффинности обоих соединений к данному ферменту CYP: вещество с более высокой аффинностью к ферменту будет связываться и, таким образом, угнетать биотрасформацию субстрата с более низкой аффинностью [20]. Большинство важных лекарственных взаимодействий, обусловленных конкурентным ингибированием системы CYP, происходит с участием изоферментов в двух основных локализациях: кишечник и печень.
1.3.1. Взаимодействия с участием систем CYP в кишечнике
Угнетение активности CYP в кишечнике может вызывать изменения в пресистемном метаболизме. В системе CYP кишечника человека преобладает изофермент CYP3A4, уровень активности которого считают важным фактором, определяющим степень биодоступности лекарств [30]. Многие препараты, например, циклоспорин [32], мидазолам [33] и нифедипин [20], после перорального приема подвергаются значительному пресистемному метаболизму в кишечной стенке. Таким образом, угнетение CYP3A4 в кишечнике играет основную роль в лекарственных взаимодействиях, проходящих с участием этих препаратов [34].
Конкретные клинические последствия конкурентного ингибирования CYP3A4 в кишечнике зависят от относительной аффинности к этому ферменту обоих лекарств, которые применяются одновременно. Действительно, метаболизм препаратов с низкой аффинностью к CYP3A4 в кишечной стенке (например, фелодипин [35] или симвастатин [36]) снижается, и это может вызвать повышение их пероральной биодоступности в несколько раз. С другой стороны, вещества с более высокой аффинностью к CYP3A4, чем ингибиторы протонной помпы, такие, как кетоконазол и кларитромицин, могут угнетать метаболизм ингибиторов протонной помпы и других лекарств, таким образом повышая содержание последних в плазме крови [15]. Такие изменения биодоступности одновременно применяемых лекарственных веществ могут изменять их эффективность или частоту развития побочных явлений, хотя это специально не изучалось в клинических исследованиях.
1.3.2. Взаимодействия с участием систем CYP в печени
Индукция или угнетение активности изоферментов CYP в печени может приводить к изменениям печеночного клиренса. Ингибиторы протонной помпы метаболизируются в печени преимущественно с участием CYP2C19 и CYP3A4 [15]. Li и соавторы [37] сравнивали степень активности и специфичность пяти применяющихся в настоящее время ингибиторов протонной помпы в отношении угнетения четырех ферментов CYP (CYP2C9, 2С19, 2D6 и 3А4) с использованием препаратов микросом печени человека и рекомбинантного CYP2C19. Хотя особенности ингибирования у препаратов были сходны, in vitro наиболее активным ингибитором CYP2C19 оказался ланзопразол (константа ингибирования (Ki)=0,4-1,5 мкМ), а CYP2C9 — пантопразол (Ki=6 мкМ).
В другом исследовании [38], с использованием как изоферментов микросом печени человека, так и рекомбинантного CYP3A4, показано, что омепразол (в виде лево- или правовращающих энантиомеров — R- или S-энантиомеров) метаболизировался быстрее, чем пантопразол. Вместе с тем при использовании рекомбинантного CYP2C19 эзомепразол (S-омепразол) и пантопразол имели сходную скорость метаболизма, и только R-омепразол метаболизировался быстрее.
Несмотря на то, что эти наблюдения in vitro свидетельствуют о потенциальной способности развития лекарственных взаимодействий и разной степени активности ингибиторов протонной помпы, такие эффекты не обязательно наблюдают in vivo. Например, выраженное конкурентное ингибирование CYP2C9 (с использованием в качестве маркера активности CYP2C9 в реакции 4′-гидроксилирования диклофенака) пантопразолом не находит отражения в клинике. In vivo пантопразол не влиял на фармакокинетику диклофенака ни путем конкурирования с CYP2C9, ни путем уменьшения секреции соляной кислоты в желудке. Аналогично диклофенак не влиял на фармакокинетику пантопразола [39]. Более выраженное конкурентное ингибирование CYP2C19 ланзопразолом по сравнению с омепразолом или эзомепразолом также не дает клинических эффектов. Содержание в плазме крови фенитоина, например, являющегося субстратом для CYP2C19, значительно не изменялось при его одновременном введении с 60 мг ланзопразола [40].
Помимо взаимодействия с определенными изоферментами CYP, которое необходимо для их собственного метаболизма, ингибиторы протонной помпы могут также изменять активность других изоферментов CYP. Например, и омепразол и ланзопразол могут индуцировать активность CYP1A2 [41], что может влиять на биотрансформацию таких лекарств, как теофиллин и варфарин [20]. Вместе с тем недостаточно клинических данных для подтверждения существования взаимодействий такого типа.
2. Особенности взаимодействия ингибиторов протонной помпы
Особенности взаимодействия омепразола и пантопразола были широко изучены, в то время как особенности эзомепразола, ланзопразола и рабепразола установлены хуже. Основные результаты этих исследований обобщены в таблице. Взаимодействия, имеющие отношения ко всей группе, например, основанные на фармакодинамическом эффекте ингибиторов протонной помпы в отношении рН в желудке, не представлены, так как они описаны выше.
| Сопутствующий препарат | Эффект ингибитора протонной помпы на сопутствующий препарат | ||||
| Эзомепразол | Ланзопразол | Омепразол | Пантопразол | Рабепразол | |
| Антацидное средство | Неизвестен | Противоречивые результаты [42, 43] | Отсутствует [44] | Отсутствует [45] | Отсутствует [46] |
| Феназон (антипирин) | Неизвестен | ↑ Клиренс [47] | ↓ Клиренс [10] | Отсутствует [48] | Неизвестен |
| Кофеин | Неизвестен | Отсутствует [49] | Противоречивые результаты [49, 50] | Отсутствует [49, 51] | Неизвестен |
| Карбамазепин | Неизвестен | Неизвестен | ↓ Клиренс [52] | Отсутствует [53] | Неизвестен |
| Оральные контрацептивы | Неизвестен | Противоречивые результаты [54] | Неизвестен | Отсутствует [55] | Неизвестен |
| Циклоспорин | Неизвестен | Неизвестен | Противоречивые результаты 57 | Отсутствует [59] | Неизвестен |
| Цинакальцет | Неизвестен | Неизвестен | Неизвестен | Отсутствует [60] | Неизвестен |
| Диазепам | ↓ Клиренс 61 | Отсутствует [64] | ↓ Клиренс [65, 66] | Отсутствует [67] | Отсутствуета [68] |
| Диклофенак | Неизвестен | Неизвестен | Отсутствует [69] | Отсутствует [39] | Неизвестен |
| Дигоксин | Неизвестен | Неизвестен | ↑ Всасывание [70] | Отсутствует b | Всасывание [72] |
| Этанол | Неизвестен | Отсутствует [73] | Отсутствует [73] | Отсутствует [74] | Неизвестен |
| Глибенкламид | Неизвестен | Неизвестен | Неизвестен | Отсутствует [75] | Неизвестен |
| Левотироксин натрий | Неизвестен | Неизвестен | Неизвестен | Отсутствует [76] | Неизвестен |
| Метопролол | Неизвестен | Неизвестен | Отсутствует [77] | Отсутствует [78] | Неизвестен |
| Напроксен | Неизвестен | Неизвестен | Отсутствует [69] | Отсутствует [79] | Неизвестен |
| Нифедипин | Неизвестен | Неизвестен | ↑ Всасывание ↓ Клиренс [80] | Отсутствует c [81] | Неизвестен |
| Фенпрокумон | Неизвестен | Неизвестен | ↓ Клиренс [82] | Отсутствует [83] | Неизвестен |
| Фенитоин | ↓ Клиренс [61,62] | Отсутствует [40] | ↓ Клиренс [66, 84, 85] | Отсутствует [86] | Отсутствует [87] |
| Пироксикам | Неизвестен | Неизвестен | Отсутствует [69] | Отсутствует [88] | Неизвестен |
| Такролимус | Неизвестен | ↓ Клиренс [89] | Неизвестен | Отсутствует [90] | Отсутствует [89] |
| Теофиллин | Неизвестен | Противоречивые результаты [91, 92] | Отсутствует [91, 93] | Отсутствует [91, 94] | Отсутствует [95] |
| Варфарин | ↓ Клиренс d [61, 62] | Отсутствует [43] | ↓ Клиренс d [96, 97] | Отсутствует [98] | Отсутствует [95] |
Есть сообщения о повышенных значениях международного нормализованного отношения (МНО) и протромбинового времени у пациентов, принимающих ингибиторы протонной помпы вместе с варфарином или фенпрокумоном. Следовательно, пациентов, принимающих такую комбинацию препаратов, необходимо контролировать в отношении возможного повышения МНО и протромбинового времени.
2.1. Омепразол
Омепразол метаболизируется почти полностью и поэтому практически не выводится с мочой или калом в неизмененном виде [99]. Основной реакцией метаболизма фазы I является формирование 5-гидроксиомепразола, которую катализируют CYP2C19 и CYP3A4. Омепразол также метаболизируется изоферментом CYP2C19 в омепразола гидроксисульфон и изоферментом CYP3A4 — в омепразола сульфон [100]. Исходное соединение обладает почти в 10 раз большей аффинностью к CYP2C19, чем к CYP3A4 [99]. Учитывая такую быструю и экстенсивную биотрансформацию, опосредованную изоферментами 2С19 и 3А4 системы CYP, представляются вероятными взаимодействия с другими субстратами или ингибиторами обеих систем.
Хорошо описанным примером такого типа лекарственного взаимодействия является снижение клиренса диазепама, обусловленное омепразолом. В результате конкурентного ингибирования CYP2C19 после приема омепразола в дозе 20 мг 1 раз в сутки клиренс диазепама после его однократного внутривенного введения у лиц с ускоренным метаболизмом снижался на 20-26% [65, 66, 68]. Омепразол также снижал у лиц с ускоренным метаболизмом клиренс десметилдиазепама, основного активного метаболита диазепама [65, 66, 68]. Как и ожидалось, это взаимодействие не наблюдалось у лиц с медленным метаболизмом, у которых активность CYP2C19 была значительно снижена [65, 68].
Ингибирование омепразолом (10 мкмоль/л) изофермента CYP2C19 in vitro угнетало биотрансформацию прогуанила (20 мкмоль/л) в циклогуанил, а in vivo снижало клиренс перорально принимаемого прогуанила примерно на одну треть [101]. Омепразол в дозе 40 мг также ингибировал CYP2C19-зависимый метаболизм антидепрессанта моклобемида (300 мг) у лиц с экстенсивным метаболизмом [102].
Индуцированное омепразолом конкурентное ингибирование CYP2C19 может также изменять метаболизм фенитоина и варфарина. Исследования фармакокинетики с участием здоровых добровольцев, например, показали, что омепразол при приеме в дозе 40 мг 1 раз в сутки повышает AUC фенитоина после перорального приема на 19% [84] и в такой же степени снижает клиренс фенитоина в плазме крови после внутривенного введения [66]. Тем не менее не отмечалось значительных изменений в концентрациях стабильного равновесия фенитоина в плазме крови пациентов с эпилепсией через 3 нед после начала сопутствующего лечения омепразолом в дозе 20 мг 1 раз в сутки [85]. В других исследованиях показан стереоизбирательный эффект омепразола в дозе 20 мг 1 раз в сутки на метаболизм варфарина в печени путем угнетения CYP2C19-опосредованной биотрансформации R-энантиомера, но не более активного S-энантиомера. В результате этого наблюдалось некоторое повышение среднего содержания R-варфарина в плазме крови [96, 97]. Вместе с тем только в одном из этих исследований отмечено значительное увеличение времени свертывания крови при сопутствующем приеме омепразола [96]. Имеются другие сообщения о случаях индуцированного омепразолом нежелательного повышения антикоагулянтного эффекта варфарина [103] и повышенной активности антикоагулянта фенпрокумона после его введения совместно с омепразолом [82].
Исследовали также влияние омепразола на фармакокинетику антацидов, метопролола, НПВП, железа [104] и теофиллина, но в этих исследованиях не были выявлены никакие клинически значимые результаты [44, 69, 77, 80, 93, 104]. Имеются два сообщения об индуцированной омепразолом задержке клиренса метотрексата с потенциальной возможностью накопления метотрексата в количествах, вызывающих токсический эффект [105, 106].
При изучении одновременного введения циклоспорина и омепразола получены противоречивые результаты. Несмотря на то, что данные отдельных наблюдений указывают на ассоциированное с омепразолом повышение содержания циклоспорина в плазме крови [56], результаты систематических клинических исследований дают менее четкую картину. Reichenspurner и соавторы [57] продемонстрировали, что у пациентов, перенесших трансплантацию сердца, одновременное введение омепразола (доза не уточняется) приводит к снижению коэффициента «доза — концентрация» циклоспорина, что соответственно вызывает повышение концентрации циклоспорина в плазме крови при его применении в той же дозе. С другой стороны, Blohme и соавторы [58] не могли выявить значительных изменений содержания циклоспорина в плазме крови пациентов, перенесших трансплантацию почки, после введения омепразола в дозе 20 мг.
2.1.1. Эффекты других лекарств на фармакокинетику омепразола
Лекарственные средства, обладающие высокой аффинностью к CYP3A4, такие, как кетоконазол [107], кларитромицин [108] и моклобемид [109] могут влиять на биодоступность омепразола путем повышения его содержания в сыворотке крови. Вместе с тем предполагают, что это может иметь клиническое значение только у пациентов с недостаточностью CYP2C19 (например, у лиц с замедленным метаболизмом), у которых реакции метаболизма омепразола проходят в основном с участием CYP3A4. Кетоконазол в суточной дозе 100-200 мг течение 4 дней угнетал формирование омепразола сульфона у всех пациентов, а у лиц с медленным метаболизмом вызывал двукратное повышение концентрации омепразола в сыворотке крови [107]. Сходным образом, применение кларитромицина в дозе 400 мг 2 раза в сутки в течение трех дней подряд приводило к значительному повышению содержания омепразола в плазме крови здоровых лиц, в то время как содержание его сульфонового метаболита в плазме крови снижалось [108].
С другой стороны, содержание омепразола и омепразола сульфона в плазме крови были значительно снижены у пациентов, принимавших индуктор CYP2C19 гинкго двулопастный в дозе 140 мг 2 раза в сутки в течение 12 дней [110] или зверобой продырявленный в дозе 300 мг в течение 14 дней [111]. Ингибитор CYP2C19 и CYP1A2 — флувоксамин (в дозе 50 мг/сут в течение 6 дней) снижал метаболизм омепразола после его однократного приема внутрь в дозе 40 мг у лиц с экстенсивным, но не с медленным метаболизмом, подтверждая таким образом, что его активность опосредуется через CYP2C19 [112].
Комбинированный пероральный контрацептив, содержащий этинилоэстрадиол, снижал активность CYP2C19 и соответственно увеличивал AUC омепразола у здоровых женщин после приема ингибитора протонной помпы в однократной дозе 40 мг. Не обнаружены эффекты угнетения этинилоэстрадиолом формирования омепразола сульфона посредством CYP3A4 [113].
Таким образом, несмотря на ряд сообщений о лекарственных взаимодействиях с участием омепразола, не все из них расцениваются как клинически значимые. Причина преобладания сообщений о лекарственных взаимодействиях, связанных с применением омепразола, по сравнению с другими ингибиторами протонной помпы может быть проста. Омепразол, впервые выпущенный в 1989 г., является самым долго применяемым ингибитором протонной помпы, а количество сообщений о лекарственных взаимодействиях, связанных с каким-либо препаратом, повышается пропорционально времени наличия этого препарата на рынке.
2.2. Эзомепразол
Рацемический омепразол и эзомепразол (чистый S-энантиомер омепразола) подвержены одинаковым метаболическим превращениям. Но при этом метаболизм S-энантиомера, по-видимому, происходит посредством несколько иных реакций, чем таковой R-омепразола. Эксперименты, проведенные in vitro на микросомах печени человека, свидетельствуют о том, что CYP2C19 обусловливает около 70% метаболизма S-омепразола (по сравнению с =90% метаболизма R-энантиомера), а остальные 30% метаболических реакций проходят в основном с участием CYP3A4 [114].
Эти наблюдения, полученные in vitro, согласуются с результатами исследований фармакокинетики омепразола и эзомепразола у здоровых добровольцев [61]. Содержание в плазме крови гидроксиметаболитов, образующихся главным образом с участием CYP2C19, было выше после введения рацемического омепразола, чем после такой же дозы эзомепразола. Напротив, образование сульфонового метаболита, катализируемого CYP 3А4, было выше после введения эзомепразола, чем рацемического омепразола [105]. Более того, общий клиренс метаболитов эзомепразола был несколько ниже, чем таковой рацемата, что являлось причиной более высокого содержания в плазме крови S-изомера по сравнению с рацематом после введения в одинаковых дозах [62].
Эзомепразол (и в меньшей степени рацемический омепразол), по-видимому, угнетает также собственный метаболизм путем взаимодействия с CYP2C19 [115], и данный феномен следует принимать во внимание при оценке степени лекарственных взаимодействий с этим ингибитором протонной помпы. Указанное угнетение усиливается в течение первых 5-7 дней лечения [116, 117] и затем стабилизируется, что объясняет различия, которые могут наблюдаться при проведении экспериментов по схеме применения препарата в однократной или повторных дозах.
Эзомепразол, вероятно, не способен взаимодействовать с лекарствами, которые метаболизируются преимущественно с участием CYP1A2, CYP2A6, CYP2C9, CYP2D6 или CYP2E1 [62]. С другой стороны, результаты исследования его лекарственных взаимодействий с фенитоином и R-варфарином свидетельствуют о том, что эзомепразол обладает потенциальной способностью взаимодействовать с соединениями, которые метаболизируются с участием CYP2C19; однако степень выраженности этих взаимодействий не достигает уровня клинически значимых. Тем не менее сделан вывод, что ингибитор CYP3A4 кларитромицин повышает концентрацию эзомепразола в плазме крови почти в два раза [62].
Недавно было установлено, что в результате многократного приема эзомепразола в дозе 40 мг повышается концентрация диазепама в течение 4 ч после введения в однократной дозе 0,1 мг/кг [63]. Эти фармакокинетические эффекты проявлялись клинически в виде изменение угловой скорости движения глаз (определяемой по саккадированным движениям глаз), времени реакции выбора и нарушение микросна. Drewelow и соавторы [63] предположили, что в результате действия эзомепразола на диазепам у пациентов, получающих оба препарата, могут отмечаться нарушения координации движений и внимания.
В заключение можно отметить, что, несмотря на некоторые (количественные, но не качественные) различия в характере метаболических реакций обоих энантиомеров омепразола, потенциальная способность эзомепразола и рацемического омепразола участвовать в лекарственных взаимодействиях, по-видимому, значительно не отличается. В этом контексте необходимо также принять во внимание, что рекомендуемая доза рацемата для лечения кислотозависимых заболеваний в два раза ниже таковой чистого S-энантиомера.
2.3. Пантопразол
Пантопразол метаболизируется с участием CYP2C19 и CYP3A4, но по сравнению с другими ингибиторами протонной помпы обладает меньшей аффинностью к этим ферментам [118]. В отличие от большинства продуктов, образующихся в фазе I биотрансформации других ингибиторов протонной помпы, первоначальный метаболит пантопразола, 4-гидроксипантопразол, образуемый в результате воздействия системы CYP, проходит затем вторичную (фаза II) биотрансформацию посредством конъюгации с сульфатом в цитозоле. Эту реакцию конъюгации, которая является относительно ненасыщаемым путем метаболизма лекарственных средств, часто расценивают как причину более низкой способности пантопразола вступать в лекарственные взаимодействия по сравнению с другими ингибиторами протонной помпы [6, 119, 120].
В исследованиях, проведенных с участием здоровых добровольцев и пациентов, продемонстрировано отсутствие значимых метаболических взаимодействий при применении пантопразола в комбинации с антацидами [45], феназоном (антипирином) [48], кофеином [51], карбамазепином [53], цинакальцетом [60], кларитромицином [121], циклоспорином [59], диазепамом [67], диклофенаком [39], β-ацетилдигоксином [71], этанолом [74], глибенкламидом [75], натрия левотироксином [76], метопрололом [78], напроксеном [79], нифедипином замедленного высвобождения [81], пероральными контрацептивами [55], фенпрокумоном [83], фенитоином [86], пироксикамом [88], такролимусом [90], теофиллином [94] или варфарином [98].
В исследовании, проведенном Ferron и соавторами [122], показано незначительное взаимодействие между пантопразолом в дозе 40 мг и цизапридом — 20 мг, которое не имело клинически значимых эффектов.
Имеется сообщение о случае тяжелой миалгии после инъекций метотрексата в дозе 15 мг у пациента с лимфомой, принимавшего пантопразол в дозе 20 мг/сут по поводу пищевода Баррета. Авторы обнаружили, что общее воздействие (AUC144) метаболита метотрексата — 7-гидроксиметотрексата увеличивалось приблизительно на 70% после введения препарата вместе с пантопразолом по сравнению с монотерапией метотрексатом. Период полувыведения этого метаболита удваивался (81,4 по сравнению с 36,4 ч), свидетельствуя о том, что данное лекарственное взаимодействие влияет на скорость выведения почками, а не на метаболизм [123]. Вместе с тем остается неясным, обусловлен ли этот эффект ингибитором протонной помпы или другими факторами, также отсутствуют другие сообщения о подобных случаях при применении пантопразола. Пантопразол не влиял на содержание циклоспорина у реципиентов почечных трансплантатов [59]. Таким образом, пантопразол можно назначать реципиентам трансплантатов без риска его влияния на иммуносупрессивную терапию циклоспорином.
В одной из недавно опубликованных работ сравнивали эффекты многократного приема пантопразола в дозе 40 мг и эзомепразола — 40 мг на фармакокинетику диазепама после его однократного применения в дозе 0,1 мг/кг. AUC120 для диазепама была на 28% больше при одновременном применении эзомепраза, чем пантопразола. В ранее проведенных исследованиях отмечено позднее (>12 ч) повышение концентрации диазепама, но различия в значениях Сmах указывали также на раннее повышение (приблизительно на 34%) содержания диазепама в случае его приема с эзомепразолом, в отличие от приема с пантопразолом, и этот эффект вызывал явные фармакодинамические эффекты. Клинические эффекты, такие, как изменение времени реакции выбора и частоты случаев микросна, были значительно более выражены при приеме вместе с эзомепразолом (p