Изофермент cyp3a4 что это
Изофермент cyp3a4 что это
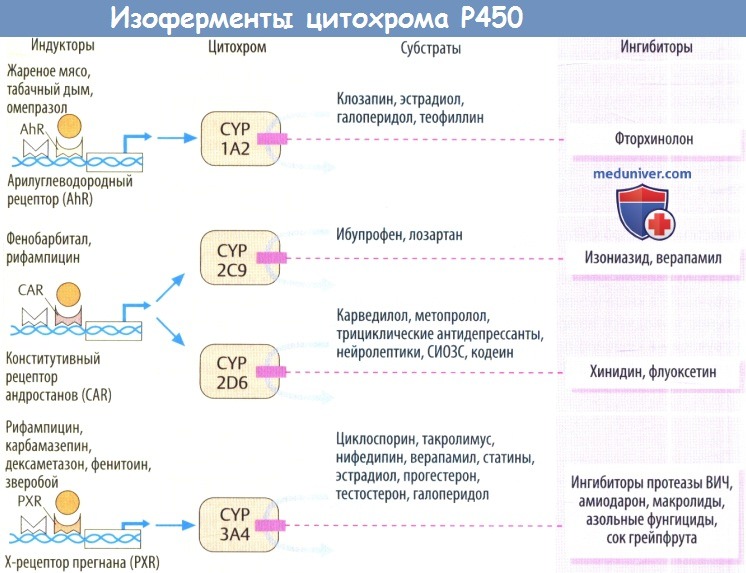
а) Цитохром Р450. Основная часть реакций I фазы катализируется гемопротеинами, так называемыми изоферментами цитохрома Р450 (CYP). До настоящего времени у человека идентифицировано примерно 40 генов цитохрома Р450.
Среди них группы белков CYP1, CYP2 и CYP3 имеют большое значение в метаболизме лекарственных средств. Основная часть изоферментов CYP расположена в печени и в стенке кишки, что объясняет, почему эти органы ответственны за метаболизм большинства лекарственных средств.
б) Субстраты, ингибиторы и индукторы. Цитохромы — ферменты, обладающие специфичностью ко множеству субстратов. Следовательно, лекарственные средства с разной химической структурой метаболизируются одним белком-ферментом. При метаболизме нескольких лекарственных средств одним и тем же изоферментом могут иметь место клинически значимые взаимодействия.
В таких взаимодействиях могут участвовать субстраты (лекарственные средства, которые метаболизируются CYP) и ингибиторы (лекарственные средства, которые связываются с CYP с высоким аффинитетом, препятствуя разрушению субстратов, и сами медленно метаболизируются). Количество печеночных CYP является основным определяющим фактором метаболической активности.
Повышение концентрации фермента обычно приводит к ускорению метаболизма лекарственного вещества. Множество эндогенных и экзогенных (таких как лекарственные средства) веществ усиливают экспрессию изоферментов CYP и таким образом действуют как индукторы CYP. Многие из этих индукторов активируют специфические факторы транскрипции в ядрах гепатоцитов, что приводит к активации синтеза мРНК и последующей продукции белка изофермента CYP.
Некоторые индукторы также повышают экспрессию переносчиков Р-гликопротеидов. При одновременном повышении активности метаболизма CYP и мембранного транспорта Р-гликопротеида лекарственное средство перестает действовать.
В таблице приводится обзор разных изоферментов CYP вместе с их субстратами, ингибиторами и индукторами. Очевидно, когда пациенту требуется несколько схем препаратов (особенно пациентам с несколькими заболеваниями), правильно будет начать лечение с проверки, относятся ли планируемые препараты к индукторам или ингибиторам CYP, поскольку некоторые из них могут сильно изменить фармакокинетику.
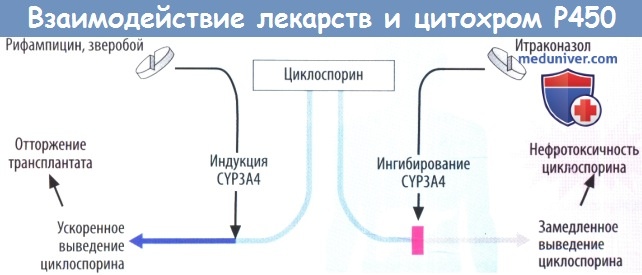
в) Лекарственное взаимодействие в результате индукции или ингибирования CYP. Угрожающие жизни взаимодействия отмечены у пациентов, принимающих индукторы изофермента CYP3A4, во время лечения циклоспорином для профилактики отторжения пересаженной почки и печени. Рифампин (рифампицин), а также зверобой обыкновенный (доступный без рецепта) могут повысить экспрессию CYP3A4 до такого значения, что уровень циклоспорина в плазме может упасть ниже терапевтического диапазона.
В силу неадекватной иммуносупрессии риск отторжения трансплантата увеличивается. При введении рифампина другие лекарственные средства, являющиеся субстратами CYP3A4, также могут оказаться неэффективными. По этой причине использование рифампина противопоказано у пациентов с ВИЧ-инфекцией, которые находятся на лечении ингибиторами протеаз. Как правило, ингибиторы CYP повышают уровень лекарственных средств в плазме, которые являются субстратами этих же изоферментов.
Таким же образом они повышают риск нежелательных токсических эффектов. Противогрибковое средство итраконазол посредством данного механизма увеличивает нефротоксичность циклоспорина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фармакогенетические подходы к прогнозированию эффективности и безопасности фармакотерапии артериальной гипертензии
Используя в клинической практике индивидуализированный подход к выбору фармакотерапии артериальной гипертензии, включающий определение фенотипических признаков и генетических особенностей пациентов с артериальной гипертензией, возможно добиться повышения
Using an individualized approach to the choice of pharmacotherapy of arterial hypertension in clinical practice, including the definition of phenotypic signs and genetic characteristics of patients with arterial hypertension, it is possible to increase to achieve both efficiency and safety of the therapy.
Одной из важнейших задач, стоящих перед практикующими врачами, является повышение эффективности и безопасности проводимой ими лекарственной терапии путем индивидуализации лечения больного. Для этого необходимо иметь полноценные представления об особенностях как лекарственного препарата (фармакокинетики и фармакодинамики), так и больного (индивидуальные характеристики пациента, в т. ч. генетические).
Как одно из наиболее распространенных сердечно-сосудистых заболеваний, артериальная гипертензия (АГ) является важным фактором риска развития различных сердечно-сосудистых осложнений, таких как инсульт, инфаркт миокарда (ИМ), хроническая сердечная недостаточность (ХСН), а также хроническая болезнь почек (ХБП) [1].
Снижение уровня артериального давления (АД) у пациентов с разной степенью АГ позволяет уменьшить риск инсультов и инфарктов миокарда, а также значительно улучшить качество жизни пациентов. Однако, несмотря на достаточно обширный выбор лекарственных средств, имеющихся в арсенале врача, контроль над уровнем АД в ряде случаев остается неудовлетворительным и с каждым годом количество людей с неконтролируемым АД увеличивается [2, 3]. Так, по данным различных авторов, у 10–45% пациентов применение лекарственных средств (ЛС) оказывается неэффективным [4–6].
Персонализированная медицина как реальный путь повышения эффективности и безопасности фармакотерапии
В настоящее время известно множество причин, которые могут лежать в основе межиндивидуальных различий фармакологического ответа, это пол, возраст, наличие вредных привычек, функциональное состояние органов и систем, прежде всего желудочно-кишечного тракта (ЖКТ), печени, почек и крови, характер течения основного заболевания и его этиология, сопутствующая терапия, а также генетические особенности пациента и т. д. Именно генетические особенности зачастую являются причиной нежелательных лекарственных реакций (НЛР) организма человека на ЛС [7–9]. Изучение генетических особенностей пациентов легло в основу развития фармакогенетики, а в дальнейшем и персонализированной медицины.
Персонализированная медицина — это подход к оказанию медицинской помощи на основе индивидуальных характеристик пациентов, для чего они должны быть распределены в подгруппы в зависимости от предрасположенности к болезням и ответа на то или иное вмешательство [10–12].
Технологии персонализации применения ЛС на основе изучения индивидуальных особенностей пациента были разработаны еще в XX веке, но только сейчас они становятся более или менее доступны для практического здравоохранения. К подобным технологиям относят фармакогенетическое тестирование, а также определение маркерных субстратов (биомаркеров).
Фармакогенетика активно развивается в последние десятилетия. Все этапы фармакокинетики ЛС (всасывание, распределение, метаболизм/биотрансформация, выведение) находятся под контролем соответствующих генов, поэтому полиморфизмы различных генов могут влиять на все вышеперечисленные фармакокинетические процессы.
Выявление генетических особенностей пациентов — основа персонализированной медицины, поскольку позволяет прогнозировать фармакологический ответ на ЛС, а значит, повысить эффективность и безопасность применения ЛС, так как идентификация соответствующего аллельного варианта, приводящего к изменениям фармакокинетики и/или фармакодинамики у больного, требует коррекции терапии — дозы ЛС, кратности его применения, пути введения, необходимости замены на другой препарат и пр. [13]. То есть использование подобного подхода в клинической практике позволяет индивидуализировать фармакотерапию.
Доказано, что наибольшее клиническое значение имеют полиморфизмы генов, контролирующих синтез и работу ферментов биотрансформации ЛС, а также транспортных белков?переносчиков, то есть транспортеров, участвующих в процессах всасывания, распределения и выведения ЛС. В частности, генетический полиморфизм характерен для генов, кодирующих ферменты I фазы метаболизма, главным образом изоферменты цитохрома Р-450, и для транспортеров, главным образом Р-гликопротеина [14].
Внедрение персонализированного подхода в практическую медицину при различных заболеваниях внутренних органов направлено как на повышение эффективности лечения, так и на повышение безопасности фармакотерапии [15]. Это особенно важно для целого ряда лекарственных средств, таких как антикоагулянты, психотропные препараты, ингибиторы протонной помпы, ряд препаратов для лечения ишемической болезни сердца и АГ.
Клинические аспекты функционирования системы цитохрома Р450
В настоящее время около 60% лекарственных препаратов окисляются с помощью ферментативной системы CYP3A4, т. е. являются субстратами этой системы. Система CYP3A4, которая является основной в организме человека, обладает индивидуальной активностью, а также характеризуется унимодальным распределением в популяции и отсутствием генетического полиморфизма [16–18].
Межиндивидуальные различия в скорости метаболизма ЛС позволят выделить группы индивидуумов, различающиеся по активности того или иного изофермента метаболизма.
Накоплено много данных о влиянии полиморфизма генов семейства цитохрома Р450 на индивидуальную чувствительность к антигипертензивным препаратам, так как именно изоферменты этого семейства участвуют в метаболизме некоторых препаратов, применяющихся в настоящее время для лечения АГ. Изофермент цитохрома Р450 2C9 (CYP2C9) — один из главных ферментов биотрансформации антагониста рецепторов ангиотензина — лозартана, метаболизирующий его до активного метаболита ЕXP-3174. По данным ряда авторов, носительство аллельных вариантов CYP2C9*2 и CYP2C9*3 («медленные» метаболизаторы) может приводить к нарушению образования указанного метаболита за счет снижения активности CYP2C9 и снижению клинического эффекта препарата из-за недостаточного образования активного метаболита, который и обладает антигипертензивным эффектом [19].
Клинические аспекты функционирования Р-гликопротеина
Важную роль в фармакокинетике ЛС играет, помимо изоферментов цитохрома Р450, P-гликопротеин (Р-gp). Локализуясь в кишечном эпителии, Р-гликопротеин осуществляет эффлюкс лекарственных веществ — его субстратов в просвет кишечника, тем самым снижая их всасывание. В гепатоцитах и почечном эпителии он опосредует выведение ксенобиотиков в просвет желчных капилляров и почечных канальцев соответственно, а в гистогематических барьерах обеспечивает их непроницаемость для липофильных веществ [20]. На сегодняшний день наиболее изученным является полиморфизм, связанный с изменением функционирования Р-гликопротеина. — это «молчащая», т. е. не приводящая к замене аминокислоты однонуклеотидная замена в экзоне 26 в позиции 3435 (С3435Т), замена цитозинового нуклеотида на тимидиновый в промоторной зоне ABCB1 (ранее именовался MDR1), гена, кодирующего синтез белка Р-гликопротеина [21–23]. Доказано, что у гомозигот по аллелю СС экспрессия гена ABCB1 в тонком кишечнике более чем в 2 раза превышала экспрессию у гомозигот по аллелю ТТ, что свидетельствовало о более высокой активности Р-гликопротеина у лиц с генотипом СС [24]. Этот факт еще раз доказывает необходимость изучения генетического полиморфизма ABCB1 с целью индивидуализации фармакотерапии.
_200.gif)
Немаловажная роль в последние годы отводится Р-гликопротеину как иммуномодулятору. Ген ABCB1 в физиологических условиях экспрессируется на периферических клетках (Т-лимфоцитах). При изучении нормальных Т-лимфоцитов человека в одном из экспериментов было продемонстрировано, что Р-гликопротеин участвует в трансмембранном транспорте таких цитокинов, как интерлейкин-2, интерлейкин-4, интерферон γ [29]. Предполагается, что Р-гликопротеин участвует в осуществлении внутриклеточного транспорта. Так, например, в некоторых исследованиях продемонстрировано, что Р-гликопротеин участвует в перераспределении холестерина в клеточной мембране и в перемещении его в эндоплазматический ретикулум, где в дальнейшем происходит его этерификация [30–32]. Гиперэкспрессия гена ABCB1 на поверхности энтероцитов приводит к тому, что холестерин мицелл из просвета кишечника активнее поступает внутрь энтероцитов. Таким образом, регуляция обмена холестерина является еще одной физиологической функцией Р-гликопротеина.
Биохимические соединения, взаимодействующие с Р-гликопротеином, могут быть разделены на субстраты и ингибиторы Р-гликопротеина. Изучение способностей лекарственных средств подавлять или усиливать функцию Р-гликопротеина имеет большое практическое значение, так как эти особенности могут изменять фармакокинетику и биодоступность ЛС при совместном их применении, а также привести к развитию токсических эффектов этих препаратов или, наоборот, к снижению концентрации субстратов в крови и, как следствие, к уменьшению их терапевтической активности [33].
Большое количество препаратов, используемых в кардиологической практике, является субстратами и/или ингибиторами Р-гликопротеина (табл.) [34].
В зависимости от различных условий одни и те же препараты могут одновременно являться и субстратами Р-гликопротеина, и его ингибиторами. Примером этого может служить препарат верапамил, который в небольших концентрациях является субстратом, а при увеличении дозы проявляет свойства ингибитора Р-гликопротеина [35].
Из антигипертензивных препаратов субстратом Р-гликопротеина является антагонист кальция амлодипин, один из наиболее распространенных на сегодня в клинической практике антагонистов кальция (АК), назначаемый как в монотерапии, так и в составе комбинированной терапии.
Антагонисты кальция в лечении АГ
Антагонисты кальция используются в клинической практике уже около пятидесяти лет, и в настоящее время это одна из наиболее часто назначаемых групп препаратов в кардиологии. АК представлены препаратами дигидропиридинового ряда (нифедипин, фелодипин, амлодипин), фенилалкиламинами (верапамил, галлопамил) и бензотиазепинами (дилтиазем, клентиазем) [36].
На сегодняшний день самым назначаемым представителем АК дигидропиридинового ряда является представитель третьего поколения препаратов этой группы амлодипин. Преимущества эффективности и безопасности представителей третьего поколения у больных подтверждены результатами крупных рандомизированных исследований с амлодипином, таких как PREVENT, ALLHAT, VALUE [37].
Показаниями для применения данного препарата в первую очередь являются АГ и стабильная стенокардия напряжения, что находит отражение в клинических рекомендациях ведущих мировых сообществ кардиологов [38, 39].
Известно, что амлодипин эффективно снижает систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) и используется как в монотерапии, так и в комбинации с другими классами антигипертензивных лекарственных средств [40]. Однако известно, что
20% пациентов прекращают прием амлодипина в связи с развитием у них НЛР, таких как отек лодыжек, гиперемия лица и учащенное сердцебиение [41]. Среди многих имеющих место факторов, влияющих на индивидуальную эффективность и безопасность амлодипина, генетика может быть одним из значимых.
С позиции клинической фармакокинетики среди всех АК амлодипин проявляет наиболее высокую и стабильную биодоступность, которая составляет 65%. Препарат также характеризуется медленной скоростью достижения концентрации в плазме крови (через 6–12 часов) и максимальным периодом полувыведения (Т½ около 40 часов), что обеспечивает стабильность плазменной концентрации при однократном приеме в сутки на протяжении более 24 часов [42]. По этим наиболее важным фармакокинетическим характеристикам амлодипин превосходит АК второго поколения (нифедипин ретард, фелодипин и пр.) и АК третьего поколения (лацидипин, лерканидипин) [43, 44]. Благодаря описанным выше особенностям фармакологических и фармакокинетических свойств амлодипин показывает наименьшие эквивалентные дозы для достижения гипотензивного эффекта в сравнении с другими АК [45–47].
По данным литературы для АК характерна прямая корреляционная связь между гипотензивным эффектом и плазменной концентрацией, что свидетельствует об их прямом вазодилатирующем действии. Именно поэтому стабильность гипотензивного эффекта антагонистов кальция в течение суток зависит от стабильности уровня их плазменной концентрации. Отсутствие достаточной остаточной концентрации в конце междозового интервала может быть причиной недостаточной эффективности в ночное время и в ранние утренние часы. Известно, что тяжесть осложнений АГ связана, как правило, с недостаточным ночным снижением АД у больных, а утренний подъем АД является причиной высокой частоты развития инсультов и инфарктов. По данным A. D. Baindridge и соавт., остаточная концентрация через 24 часа после приема 5 мг амлодипина составляет 67%, что свидетельствует о высокой стабильности концентрации последнего на протяжении суток [44, 48].
Известно, что амлодипин метаболизируется изоферментами подсемейства цитохрома P450 (CYP)3А в печени. У взрослых из изоферментов подсемейства CYP3A функционируют CYP3A4 и CYP3A5. Активность CYP3A может значительно варьировать у различных людей и определять в конечном итоге различия в эффективности и переносимости амлодипина [49].
Следует учитывать и тот факт, что амлодипин является субстратом Р-гликопротеина. Многочисленные исследования проводились и проводятся в мире, целью которых является изучение влияния носительства того или иного генотипа по полиморфному маркеру С3435Т гена ABCB1 на работу и уровень экспрессии Р-гликопротеина. Полученные результаты весьма противоречивы [50–52]. В одной из работ было показано, что генетический полиморфизм ABCB1 оказывает некоторое влияние на фармакокинетику амлодипина, что, однако, не влечет за собой изменений фармакодинамических параметров [53].
Предполагается, что носительство генотипа ТТ приводит к повышению экспрессии гена ABCB1. В то же время в ряде исследований высказываются предположения, что носительство генотипа ТТ приводит к снижению работы Р-гликопротеина, и в результате обнаруживаются более высокие концентрации в крови лекарственных препаратов — субстратов данного белка-транспортера, и, как следствие, проявляются токсические эффекты ЛС [54, 55]. Последнее предположение подтверждается результатами исследования, согласно которому у больных с постоянной формой фибрилляции предсердий, являющихся гомозиготами по полиморфному маркеру С3435Т гена ABCB1 (генотип ТТ, n = 28), по сравнению с пациентами, не несущими данный генотип (генотипы СТ, n = 55, и СС, n = 20), чаще наблюдаются симптомы гликозидной интоксикации — у 57% и 13% соответственно (р = 0,0001) при его длительном приеме в дозе 0,25 мг/сут. Причиной данного феномена является то, что именно у пациентов с генотипом ТТ регистрировали более высокие значения минимальной равновесной концентрации дигоксина в плазме крови по сравнению с пациентами с генотипами СТ и СС. При этом выявление генотипа ТТ с чувствительностью 62% и специфичностью 84% прогнозирует развитие симптомов гликозидной интоксикации у пациентов, принимающих дигоксин в дозе 0,25 мг/сут. Связь между концентрацией дигоксина в плазме крови и возникновением симптомов гликозидной интоксикации была доказана в мультицентровом исследовании DIG, поэтому результаты, описанные выше, можно объяснить низкой активностью гликопротеина Р или низким уровнем экспрессии гена ABCB1 у пациентов с генотипом ТТ в кишечнике, печени, почках. В литературе также существуют работы, в которых авторы не обнаруживают разницы в экспрессии ABCB1 и в эффективности «работы» Р-гликопротеина между носителями того или иного генотипа по полиморфному маркеру С3435Т. Это еще раз доказывает необходимость дальнейших исследований разных генотипов (СС, СТ, ТТ) по полиморфному маркеру C3435T гена ABCB1 именно с точки зрения персонализированного подхода при назначении ряда лекарственных средств, в частности амлодипина, с целью оптимизации фармакотерапии АГ.
Заключение
Несмотря на достаточно обширный выбор ЛС для фармакотерапии АГ, имеющихся в арсенале врача, контроль над уровнем АД в ряде случаев остается неудовлетворительным и с каждым годом количество людей с неконтролируемым АД увеличивается. В настоящее время доказано, что это может быть связано, помимо прочих факторов, с генетическими особенностями пациентов, которые также зачастую являются и причиной развития НЛР на ЛС. Имеется большой объем данных о влиянии полиморфизмов генов семейства цитохрома Р450 на фармакологический ответ индивидуумов на то или иное лекарство. Также важную роль в фармакокинетике ЛС играет, помимо изоферментов цитохрома Р450, P-гликопротеин. Используя в клинической практике индивидуализированный подход к выбору фармакотерапии, включающий определение фенотипических признаков и генетических особенностей пациентов с АГ, возможно добиться повышения как эффективности, так и безопасности проводимой терапии.
Литература
* ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
** ГБОУ ДПО РМАПО МЗ РФ, Москва
Цитохром Р450 (изоферменты CYP2C19 и CYP3A4)

Цитохром Р450 представляет комплекс белка с ковалентно связанным гемом (металлопротеином), обеспечивающим присоединение кислорода. Гем, в свою очередь, является комплексом протопорфирина IX и двувалентного атома железа. Число 450 обозначает, что восстановленный гем, связанный с СО, отличается максимумом поглощения света при длине волны 450 нм.
Цитохромы Р-450 участвуют не только в метаболизме лекарств, но и в превращении гемоглобина в билирубин, синтезе стероидов и др. Все изоформы цитохрома Р-450 объединены в семейства CYP1, CYP2, CYP3. Внутри семейств выделены подсемейства A, B, C, D, E. В пределах подсемейств изоформы обозначены порядковым номером. Например, CYP2C19 — наименование 19-го по порядку цитохрома подсемейства «С», семейства «2». Всего существует около 250 различных видов цитохрома Р-450, из них примерно 50 — в организме человека и только шесть из них (CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4) имеют отношение к метаболизму лекарств.
На активность цитохромов Р-450 оказывает влияние множество факторов — курение, алкоголь, возраст, генетика, питание, болезни. Эти факторы отвечают за формирование индивидуальных особенностей работы ферментов Р-450 и определяют эффекты лекарственного взаимодействия у конкретного пациента.
Важность цитохромов Р450 для гастроэнтерологии
Значительно возросший в последнее время интерес гастроэнтерологов к изоформам цитохрома Р450 CYP2C19 и CYP3A4 обусловлен в их ролью в метаболизме производных бензимидазола, к которым относятся все лекарственные препараты из группы по АТХ A02BC «Ингибиторы протонового насоса» (омепразол, панторазол, лансопразол, рабепразол и эзомепразол). Клинически существенно, что ген CYP2C19 отличается полиморфностью и от состояния этого гена у пациента в значительной степени зависит величина терапевтического эффекта различных ИПП.
Среди ИПП наибольшее ингибирующее действие в отношении CYP2C19 проявляет лансопразол, в меньшей степени омепразол и эзомепразол. Еще ниже эффект рабепразола, однако значительное ингибирующее воздействие на активность CYP2C19 оказывает его тиоэфир, образующийся в ходе неферментного метаболизма. Наименьшее влияние на CYP2C19 оказывает пантопразол. Наибольшее ингибирующее воздействие на CYP3A4 in vitro у пантопразола, далее (по мере уменьшения эффекта) омепразол, эзомепразол и рабепразол и лансопразол. Для пациентов, получающих несколько лекарственных препаратов, из ИПП предпочтительнее пантопразол (Бордин Д.С.).
При активном участии CYP3A4 происходит метаболизм домперидона, цизаприда и большого числа других лекарств.
Целый ряд гастроэнтерологических препаратов ингибируют цитохром CYP3A4, оказывая тем самым влияние на фармакокинетику принимаемых совместно лекарств.
Проблема взаимодействия лекарств
В современной клинической практике широко распространено комбинированное применение лекарств, что связано с наличием у пациента нескольких заболеваний или недостаточной эффективностью монотерапии. При комбинированной терапии возможно взаимодействие лекарств. Более одного лекарства принимает примерно 56 % пациентов в возрасте до 65 лет и 73 % пациентов старше 65 лет. Прием двух лекарств приводит к их взаимодействию у 6 % пациентов. Назначение 5 (или 10) лекарств повышает частоту взаимодействий до 50 (или 100) %.
Потенциально опасные комбинации лекарств являются серьезной клинической проблемой. Имеются данные, что от 17 до 23 % назначаемых врачами комбинаций лекарств являются потенциально опасными. Только в США из-за непредусмотренного взаимодействия лекарств умирает 48 тысяч больных в год. FDA сняло с регистрации несколько лекарств (в том числе прокинетик цизаприд) по причине их потенциально опасных взаимодействий с другими лекарствами, приводивших, в том числе и к летальным исходам.
Основные механизмы взаимодействий лекарств связаны с изменением их фармакокинетики или фармакодинамики. Наиболее существенными, согласно современным представлениям, являются изменения фармакокинетики при метаболизме лекарств с участием цитохромов Р-450.
Примером опасного взаимодействия является недавно обнаруженное взаимодействие ИПП и клопидогрела, широко применяемого при лечении больных ишемической болезнью сердца. Для уменьшения риска гастроинтестинальных осложнений больным, получающим ацетилсалициловую кислоту в комбинации с клопидогрелом, назначают ИПП. Поскольку биоактивация клопидогрела происходит с участием CYP2C19, прием ИПП, метаболизируемых этим цитохромом, может снизить активацию и антиагрегантный эффект клопидогрела. В мае 2009 года на конференции Общества сердечно-сосудистой ангиографии и вмешательств (SCAI) были представлены данные, свидетельствующие, что одновременное использование клопидогрела и ИПП значительно повышает риск возникновения инфаркта миокарда, инсульта, нестабильной стенокардии, необходимости повторных коронарных вмешательств и коронарной смерти (Бордин Д.С.).
Цитохром CYP2C19
Изоформа цитохрома Р450 CYP2C19 (S-мефенитоин гидроксилаза) катализирует реакции 5-гидроксилирования пиридинового кольца и 5′-деметилирования в бензимидазольном кольце. В человеческом организме CYP2C19 располагается в гепатоцитах.
| Генотип CYP2C19 | Распростра-ненность (Ткач С.М. и др., 2006) | Российская популяция (Никонов Е.Л.) | Тип метаболизма | Период полувыведения ИПП, T½, час (Лапина Т.Л.) | Кислото-ингиби-рующий эффект ИПП | |
| европеоидная раса | монголоидная раса | |||||
| Без мутаций (гомозиготы) | 90 % европеоидной популяции | 50,6 % | 34,0 % | Быстрый | 1 | Низкий |
| Мутация в 1-й аллеи (гетерозиготы) | 10 % европеоидной популяции | 40,5 % | 47,6 % | Промежуточный | — | Средний |
| Мутация в обеих аллеях | 20-30 % азиатской популяции | 3,3 % | 18,4 % | Медленный | 2–10 | Высокий |
Медленные метаболизаторы от быстрых и промежуточных отличаются двукратно более высокими концентрацией ИПП в плазме крови и периодом полувыведения. Полиморфизм гена, кодирующего изоформу 2С19, определяет различную скорость метаболизма ИПП у пациентов. В связи с вышесказанным подбор ИПП рекомендуется проводить под контролем суточной рН-метрии (Хавкин А.И., Жихарева Н.С., Дроздовская Н.В.).
Влияние различных генотипов CYP2C19 на эффективность эрадикации Helicobacter pylori
В силу того, что молекулярно-генетические исследования малодоступны практикующему врачу, заподозрить «быстрых» метаболизаторов можно ориентируясь на сохранение болевого абдоминального синдрома на 3–4-е сутки от начала приёма ИПП, а также принимая во внимание медленную эндоскопическую динамику при эпителизации эрозий и рубцевании язвенных дефектов у пациента. В свою очередь, недостаточность антисекреторного эффекта от терапии с применением ИПП можно верифицировать методом суточной внутрижелудочной рН-метрии (Маев И.В. и др.).
Цитохром CYP3A4
Фермент CYP3A4 катализирует реакцию сульфоксидирования, приводящую к образованию сульфогруппы. CYP3A4 является одним из самых важных для фармацевтики цитохромов, так как им биотрансформируется, по крайней мере, частично, около 60 % окисляемых препаратов. Хотя активность CYP3А4 широко варьирует, он не подвержен генетическому полиморфизму. Расположение CYP3А4 на апикальных мембранах энтероцитов тонкой кишки и гепатоцитах облегчает исполнение им метаболизм лекарств, предшествующий попаданию вещества в системный кровоток, что известно, как «эффект первого прохождения».